鞣花酸对肠道上皮细胞凋亡及相关蛋白Bcl-2、Bax、cle-Caspase-3表达的影响
2022-06-20欧正阳郑进萍李若南谢怀能俞道进
欧正阳,郑进萍,李若南,徐 睿,谢怀能,俞道进
(福建农林大学 动物科学学院(蜂学学院),福建 福州 350002)
鞣花酸(Ellagic acid,EA)是一种广泛存在于植物中的天然多酚。已有大量文献报道EA在清除自由基、抗突变、抗肿瘤、抗衰老以及抗氧化等方面有突出作用。EA对肠道上皮细胞的保护具有显著作用,可以维持肠道的生理状态,保护消化功能,促进肠道内容物中营养物质的吸收,防止肠道中的致病菌在肠道上皮细胞中定殖。EA是亲营养素的一种,其最大优点是它们不影响肠道菌群,并且没有停药期。虽然关于EA的功能和作用上的研究众多,但是关于EA对于IPEC-J2凋亡方面的研究还未见报道。
Bcl-2和Bax都是Bcl-2家族的成员,Bcl-2具有抑制凋亡的作用,而Bax具有促进凋亡的作用。Caspase-3是细胞凋亡的启动关键酶,Bcl-2通过抑制pro-Caspase-3激活成为cle-Caspase-3,起到抑制凋亡的作用,同时cle-Caspase-3的激活量受到Bcl-2/Bax比率的影响。本试验检测EA对正常细胞生长的影响,采用四甲基偶氮盐(MTT)法,流式细胞仪测定IPEC-J2细胞凋亡率,ELISA法检测Bcl-2、Bax和cle-Caspase-3的表达情况。本研究通过探讨EA对细胞Bcl-2,Bax,cle-Caspase-3的表达量与细胞的抗凋亡能力之间的关系,进一步了解关于EA抑制细胞凋亡的机制,为今后更好开发和利用EA提供基础。
1 材料与方法
1.1 主要试剂
ELISA试剂盒、EA(用0.01 μg/mL NaOH溶液现配现用),购自北京索莱宝科技有限公司;细胞凋亡检测试剂盒、RIPA(中)细胞裂解液(含抑制剂),均购于江苏凯基生物技术股份有限公司;胰蛋白酶、胎牛血清(FCS)、DMEM/F12培养基,均购自HyClone公司;IPEC-J2,购自广州吉妮欧生物科技有限公司;二甲基亚矾,购自Amersco公司。
1.2 主要仪器
HERA cell 150细胞培养箱、EVOS FLC 倒置生物显微镜,购自美国Thermo公司;净化工作台,购自苏州净化设备有限公司;GloMax96孔多功能发光检测仪,购自美国Promega公司;流式细胞仪,购自森生物(杭州)有限公司。
1.3 细胞培养
细胞培养液使用含10% FBS、1%谷氨酰胺、青链双抗和90%的DMEM/F12空白培养基,隔天需要更换培养基。当细胞生长到80%时,将其用含有0.25%EDTA的胰蛋白酶消化并传代。将培养瓶放于CO培养箱中(37 ℃,95%湿度,5%CO),定期观察细胞粘附和生长情况。
1.4 MTT检测细胞生长
采用单因子试验设计,设计5个浓度梯度组,其中空白对照组1组,EA处理组4组,每组重复5个,浓度分别为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL。取生长到对数期细胞,将其进行消化计数后接种于96孔板中,保证每个孔中细胞量为0.1 mL(1×10个/孔),等细胞贴壁后将原培养基去除,然后使用PBS溶液洗涤,依照试验设计加入含有不同浓度的EA的完全培养基,孵育12 h。培养结束后,先向96孔板中加入10 μL MTT(MTT的终浓度为0.5 mg / mL),然后继续在37 ℃的避光环境中孵育4 h,最后添加150 μL DMSO,并振荡10 min,其目的是为了更好地溶解甲瓒,于设置波长为490 nm的酶标仪上,读取OD值。
1.5 AO/EB双荧光染色法检测细胞凋亡
将消化后的细胞接种于6孔板培养,48h后用PBS溶液洗涤一次,依照实验设计分别加入含不同药物浓度的EA,培养12h,然后将含有混匀的AO 染液(10 μg/mL)和EB染液(10 μg/mL)的1 mL PBS加入6孔板中,在避光环境中孵育5~15 min后,用倒置生物显微镜观察并拍照。
1.6 流式细胞学检测
将消化后的细胞接种于6孔板培养,48 h后用PBS溶液洗涤一次,依照试验设计分别加入含不同药物浓度的培养基,用不含EDTA的胰蛋白酶消化细胞6 min并收集细胞,2 000 rpm/min离心5 min,去除上清液,用PBS洗涤2次,每洗涤一次后2 000 rpm/min离心5 min,收集1×10个细胞;加入500 μg的Binding Buffer悬浮细胞;加入5 μg Annexin V-FITC混匀后,加入5 μg Propidium,混匀。将其放在室温避光的环境中,反应时间为5~15 min,最后放入流式细胞仪进行检测。
1.7 ELISA检测Bcl-2、Bax和cle-Caspase-3的表达
根据1.3处理细胞后,吸取上清液作为样品,4 ℃情况下短期保存待测,按照ELISA检测试剂盒的说明检测Bcl-2、Bax和cle-Caspase-3的含量。
1.8 统计学处理
应用NovoExpress软件对流式细胞仪检测结果进行分析,以SPSS17.0统计软件对数据进行方差分析,<0.05为差异显著、<0.01为差异极显著、>0.05为差异不显著。
2 结果与分析
2.1 EA对IPEC-J2生长作用的影响
与空白对照组相比,各浓度的EA作用IPEC-J2 12 h后,促生长作用有所不同(见图1);浓度为20 μg/mL的EA对IPEC-J2促生长效果不显著(>0.05);浓度为40 μg/mL、60 μg/mL、80 μg/mL时差异极显著(<0.01);浓度为80 μg/mL时,与其他作用浓度相比都具有显著性差异(<0.05)。上述结果表明,EA能够剂量依赖性地促进IPEC-J2的生长。

图1 EA对正常培养的IPEC-J2生长的作用小写字母不同表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。Fig. 1 Effects of EA on normal cultured IPEC-J2 proliferationDifferent lowercase letters indicate significant difference (P<0.05),the same letters indicate no significant difference (P>0.05).
2.2 EA对IPEC-J2细胞凋亡的影响
2.2.1 AO/EB双荧光染色法检测结果 在AO/EB双荧光染色下,核染色质呈绿色的是结构正常的细胞,核染色质呈橙红色的为凋亡细胞。由图2可见,空白对照组IPEC-J2 培养12 h后,视野中凋亡细胞数为12个,浓度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL的EA作用IPEC-J2 12 h后,视野中凋亡细胞数分别为6个、4个、1个和0个,呈现下降趋势。上述结果表明增加EA的浓度后,IPEC-J2的凋亡细胞减少,EA起到抑制细胞凋亡的作用。
2.2.2 流式细胞学检测结果 从图3可以看到,空白对照组中第2象限的细胞数量更多。但随着EA浓度的增加,发现第2象限细胞减少。流式细胞仪检测结果显示,不同浓度EA作用IPEC-J2 12 h,细胞的凋亡率逐渐降低(见图4);浓度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL时达到差异极显著(<0.01);浓度20 μg/mL与40 μg/mL、60 μg/mL、80 μg/mL的凋亡率抑制差异均显著(<0.05),60 μg/mL与80 μg/mL差异不显著(>0.05)。以上结果表明,随着EA浓度增加,IPEC-J2的凋亡率逐渐降低。

图2 倒置荧光显微镜下观察EA抑制IPEC-J2凋亡Fig. 2 EA inhibited apoptosis of IPEC-J2 under fluorescence microscope

图3 不同浓度EA对IEPC-J2 细胞凋亡率影响的流式细胞图Fig. 3 Effect of different concentration of EA on apoptosis rate of IEPC-J2 cells detected by flow cytometry

图4 EA对IPEC-J2凋亡的影响Fig. 4 `Effect of EA on apoptosis of IPEC-J2
2.3 EA对IPEC-J2 Bcl-2、Bax、cle-Caspase-3含量的影响
采用ELISA法测定Bcl-2、Bax、cle-Caspase-3的含量(见表1),与空白对照组相比,Bax、cle-Caspase-3均降低,差异显著(<0.05,或<0.01);Bcl-2/Bax上升,差异极显著(<0.01)。与空白对照组相比,EA作用IPEC-J2后,各加药组Bcl-2的含量略有降低,但差异不显著(>0.05),各加药组之间表现为差异不显著(>0.05)。各加药组Bax含量较空白对照组相比,差异显著(<0.05,或<0.01),20 μg/mL组与其他加药组之间,差异显著(<0.05);40 μg/mL、60 μg/mL、80 μg/mL加药组之间差异不显著(>0.05)。各加药组Bcl-2/Bax含量较空白对照组相比,差异显著(<0.05),但各加药组相互间差异并不显著(P>0.05)。各加药组cle-Caspase-3含量较空白对照组相比,差异显著(<0.05,或<0.01),20 μg/mL组与其他加药组之间,差异极显著(<0.01);40 μg/mL、60 μg/mL、80 μg/mL加药组之间差异不显著(>0.05)。
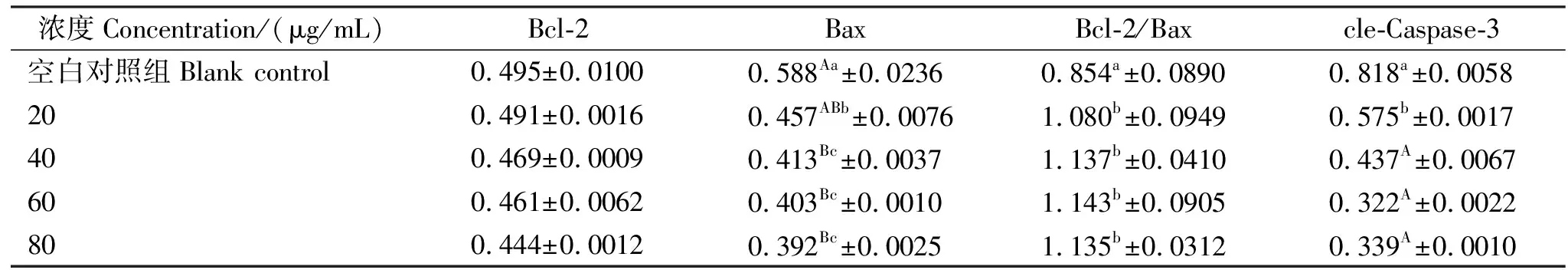
表1 鞣花酸对IPEC-J2 Bcl-2、Bax、cle-Caspase-3含量的影响(n=3)Table 1 The effect of ellagic acid on the content of Bcl-2, Bax, cle-Caspase-3 in IPEC-J2
3 讨 论
在细菌和哺乳动物系统中,鞣花酸具有抗诱变、抗氧化、抗炎活性以及抗细胞凋亡等多种生物活性功能。Galano等发现EA的抗氧化活性可抑制细胞凋亡。细胞凋亡在维持细胞总体数量上具有重要作用,而小肠上皮细胞,作为动物体内关键的吸收细胞,对肠道免疫调控以及营养吸收等方面起到关键的作用。本研究采用的IPEC-J2细胞系目前在筛选益生菌、研究肠道炎症和免疫以及霉菌毒素等领域有广泛应用,因此研究EA对IPEC-J2细胞系的作用具有重要意义。
细胞凋亡被视为是一系列高度调控Caspase级联反应事件的结果。在整个细胞凋亡的过程中,Caspase-3作为凋亡有序级联反应的下游因子,是最为关键的效应型Caspase。研究表明,当pro-Caspase-3激活成为cle-Caspase-3标志着细胞的凋亡进入到了不可逆转的阶段。被激活的cle-Caspase-3通过特异地水解细胞中的一系列底物而导致细胞解体。本试验研究结果显示,EA 对cle-Caspase-3表达量的降低效果与空白对照组相比具有显著差异,表明cle-Caspase-3在IPEC-J2中的表达降低,细胞凋亡受到抑制。
Bax受到凋亡信号刺激时便从细胞质转移至线粒体并与线粒体膜结合,再与位于线粒体膜上的Bcl-2作用从而发挥促凋亡作用。崔伟伦等通过设计 Bax 抑制因子,研究其对新生大鼠肠组织的保护作用,研究发现适量的Bax抑制肽可以通过降低Caspase-3的活性、保护细胞的线粒体膜,抑制细胞凋亡,对肠上皮细胞起到保护作用。而本研究结果同样显示,EA对 IPEC-J2 细胞Bax的表达具有明显的抑制作用,表明鞣花酸对 IPEC-J2 细胞的保护作用可能和Bax的下调存在一定的关联。
4 结 论
本试验通过不同剂量EA作用IPEC-J2 12h后,EA作用剂量越大,细胞的生长速度越快,且细胞的凋亡率明显下降,提示EA对IPEC-J2的凋亡具有一定的抑制效果。
