精原干细胞诱导方法与机理研究进展
2022-06-20朱大伟白延红郭家俊文成龙胡建宏
朱大伟,白延红,郭家俊,文成龙,杨 瑞,胡建宏*
(1. 西北农林科技大学 动物科技学院,陕西 杨凌712100;2. 杨凌职业技术学院,陕西 杨凌 712100)
雄性生殖干细胞,即精原干细胞(Spermatogenic stem cells, SSCs)是雄性哺乳动物体内仅有的一种能将遗传信息传递给后代的二倍体细胞,定位于曲细精管的基底膜部位。目前关于SSCs的研究已从啮齿类动物逐渐发展到牛、羊等大型家畜和灵长类动物,研究内容也涉及分离、纯化、体外培养、诱导分化等多个方面。本文参考目前对SSCs诱导分化的研究,对SSCs诱导分化的方法和机理进行综述,以期为雄性动物辅助生殖和畜牧业生产方面的研究提供参考。
1 SSCs的生物学特性
SSCs定植于曲细精管的基底部,为圆形或卵圆形,细胞器除核糖体和线粒体外都不发达。SSCs核内染色质含量丰富且均匀,胞质分裂不完全,经苏木精-伊红染色后,染色质呈深蓝或蓝紫色,胞质呈浅蓝色。SSCs生存所需的微环境主要由睾丸支持细胞、管周肌样细胞和间质细胞维持,若SSCs脱离该微环境将失去其生物学特性。SSCs拥有增殖、分化和自我更新的潜能。对小鼠而言,精原细胞可分为三类,即A型、中间型和B型,而A型精原细胞按照形态不同又可划分成Asingle(As)型、Apaired(Apr)型、Aaligned(Aal)型、以及A1~A4型,其中前三种属于未分化型,一般认为As型精原细胞是SSCs,在睾丸中仅占生殖细胞总数的0.02%~0.03%。然而随着组织移植技术的研究,发现As型精原细胞中真正具有增殖和分化潜能的只有10%左右,而Apr型和Aal型精原细胞中的一部分也具有自我更新的潜能。
2 SSCs的检测与鉴定
SSCs数量极少,仅占睾丸中生殖细胞总数的0.02%~0.03%左右,因此对SSCs的检测与鉴定成为影响SSCs分离与纯化效率的重要因素。目前已发现且较为公认的可作为SSCs特异性标志物的有GFRα1、PLZF、CDH1等。谢静静等使用差异贴壁纯化法对获得的绵羊生殖细胞进行培养,3 d后将未贴壁的细胞取出以PLZF作为SSCs特异性标记进行免疫荧光染色,结果显示存在PLZF阳性。陈鑫苹等采集年龄为2岁14 d的食蟹猴的单侧睾丸,经过三步酶消化法和差异贴壁法富集SSCs,经过20 d的培养后进行CDH1标记分子免疫荧光染色和RT-PCR检测,结果均显示为阳性。
3 SSCs的诱导分化方法
不同种类动物SSCs分化为精子所需的条件不尽相同,SSCs体外增殖所必要的因子及培养条件尚待完善,因此目前除了啮齿动物外,大多数哺乳动物并未建立长久的SSCs体外培养体系。现今SSCs主要有两种定向诱导分化的方法:一是试剂诱导,即在培养基中加入各种定向分化所需要的营养物质和激素等,人工创造SSCs分化条件,例如视黄酸(retinoic acid, RA)对于维持雄性个体精子发生具有重要作用,而维生素A的活性代谢产物就是RA,在培养液中添加维生素可起到促进精原细胞分化的作用。Wang等分别使用1 nM、10 nM、100 nM和1 uM的RA处理小鼠精原干细胞0、12、24、36 h并通过RNA测序技术检测参与精原细胞分化或减数分裂的相关基因8、-的mRNA表达水平,发现100 nM和24 h的处理效果最好,且诱导3 d后能渐进性的诱导出细线期的精母细胞;李金梅等发现在哺乳动物的精原干细胞中不存在雄激素受体(androgen receptor,AR),但是支持细胞中存在AR,通过向精原干细胞-支持细胞体外共培养体系中添加二氢睾酮或雄激素拮抗剂,16 h后进行蛋白质免疫印迹检测发现雄激素拮抗剂的处理组中AR和Wt-1表达明显降低而Plzf表达升高,而向6周龄的小鼠腹腔注射20 mg/kg剂量的雄激素拮抗剂后发现小鼠睾丸中精母细胞和精子的数量显著降低而Plzf阳性细胞数量增加,这些结果表明雄激素能够通过间接调控精原细胞的PLZF、Wt-1通路控制精原细胞的增殖、分化过程;Fahar等研究发现将从2~12岁的青春期前男孩体内获取的1 mm冻融睾丸碎片放在加入补充了5 IU/L FSH的KSR培养基中培养16 d后能得到圆形精子细胞,而当FSH浓度增加到50 IU/L时无法诱导生殖细胞的分化。二是通过移植或基因修饰诱导,将分离、纯化后的SSCs移植入受体动物的生精小管内,继续增殖分化,又包括同基因移植和异基因移植两种方式,同基因移植是指将自身的SSCs重新移植入自身睾丸内,异基因移植是指将SSCs在同种动物的不同个体间移植。Shetty等从3只青春期和一只青春期前的恒河猴的睾丸薄壁组织中回收到生殖细胞,经过特殊处理后,将从青春期恒河猴睾丸中获取的细胞混合后均匀分配给受体恒河猴,将从青春期前恒河猴睾丸中获得的生殖细胞分配给对照组恒河猴,采用超声引导法将生殖细胞注射入生殖干细胞功能受损的受体恒河猴睾丸网,移植后20~38周后,部分接受移植的恒河猴精液中有精子出现。田稼等将体外培养的小鼠SSCs进行GFP+慢病毒转染,待转染的细胞中表达GFP蛋白后将其移植入异体小鼠的曲细精管中,3周后对受体小鼠的睾丸组织切片进行免疫荧光染色,能观察到显示绿色荧光的GFPSSCs定植于曲细精管基底部,10周后在曲细精管腔内能观察到显示GFP的生精细胞和成熟精子。
4 SSCs的分化机理
SSCs的分化受多种细胞因子的协调作用,在SSCs的分化过程中有3个重要的过程:As型精原细胞分化为Apr型精原细胞、Aal型精原细胞分化为A1型精原细胞以及A1型精原细胞分化为B型精原细胞,之后B型精原细胞进入减数分裂最终形成成熟的精子细胞。
4.1 细胞因子调控机制
视黄酸(RA)是由支持细胞和生精细胞产生,能够在精原细胞的分化和减数分裂中起调控作用的细胞因子。RA通过与细胞核内不同的受体相结合,可导致转录变化,如减数分裂相关基因8和4的表达量增加。RA/Stra8通路在精子发生过程中起到两种不同的作用,一是促进精原细胞开始分化,二是促进细胞进入减数分裂状态。谢慧等研究表明,使用RA处理小鼠SSCs能够通过降低与甲基化相关基因1和3的表达量来促进SSCs进入分化过程;而来自精原细胞分泌的RA可通过自分泌方式调控Stra8直接介导减数分裂的开始。Busada等研究发现,RA能作用于PI3K/Akt/ mTOR 信号通路进而影响SSC分化中的关键基因-基因的mRNA的翻译水平;同时当使用雷帕霉素阻断该信号通路后,RA介导的基因mRNA的翻译受阻,可导致精原细胞分化障碍。Yang等研究表明,支持细胞还能通过分泌骨形成蛋白 4(BMP4)参与对精原细胞分化的调控过程,BMPR1A 和 BMP Ⅱ是苏氨酸/色氨酸激酶受体,主要在不同时期精原细胞上表达,BMP4通过与BMPR1A和BMP Ⅱ结合可参与精原细胞的分化调控过程。BMP4还能通过协同作用与RA一起影响8和的表达,进而促进精原细胞的分化。
此外,由支持细胞产生的干细胞因子(stem cell factor,SCF)也能与产生作用,共同控制精原细胞的分化和减数分裂过程。对小鼠而言,如果基因表达发生障碍,会引起精原细胞分化受阻,睾丸中仅含有As型、Apr型和Aal型等原始精原细胞,而重组SCF后可重新恢复正常的分化过程。
4.2 转录因子调控机制
Stat3是一种存在于精原细胞中的重要的调控自我更新和分化的因子,Stat3受到抑制后,SSCs的分化产生障碍,引起未分化SSCs堆积。目前关于Stat3的作用机理并不是很明确,仅有研究发现表达于精原细胞中的神经原素3(3)是它的一个重要靶点,在睾丸中Ngn3的表达水平随着精原细胞的分化而增加,Stat3通过与3基因的启动子和增强子相结合增强其表达,高度表达的Ngn3能增强Stra8和SSCs分化标志物CD117的表达量,而抑制促增殖因子-早幼粒锌指基因()的表达,从而加速精子发生和减数分裂过程;此外维持SSCs未分化状态的必需物GDNF能通过抑制3的磷酸化进而抑制3的表达水平,这可能意味着Stat3/Ngn3通路对SSCs的分化具有重要作用。
Sohlh1/2是特异性表达于生精细胞中的bHLH家族成员,Sohlh1和Sohlh2间既具有相互调节作用又有协同作用。Sohlh1和Sohlh2能够直接结合在精原细胞基因的启动子区并使其表达量上调,进而激活相关信号通路,促进SSCs的分化;12单敲除或双敲除的小鼠中,精原细胞形态出现异常,且未分化的A型精原细胞将不能分化为阳性精原细胞,但是一部分精原细胞可能会过早的进行减数分裂,这可能是因为12的缺失会导致部分细胞中Stra8表达量增加。
4.3 miRNA的调控机制
微小RNA(microRNA, miRNA)是一种对内源性基因具有调节作用的非编码小RNA,依靠降解靶基因或抑制靶基因的表达而发挥其调控功能,miRNA对正常精子的发生具有重要作用。miRNA-202高度表达于SSCs中,且接受RA和GDNF的反向调控。Chen等的研究发现,使用CRISPR-Cas9系统敲除miRNA-202后SSCs数量与对照组相比减少了60%,出现凋亡增加和过早分化现象,而miRNA-202的靶基因2对减数分裂的启动具有重要作用,说明miRNA-202对SSCs的分化具有重要调控作用。Niu等发现miRNA204在49阴性的细胞中表达量较高,能直接作用1基因且抑制其表达,而被抑制的Sirt1会导致与SSCs自我更新和增殖相关的基因如、4的表达量下降,最终促进SSCs的分化。Cui等通过RT-PCR技术分析发现,miRNA-224是一种高度表达于小鼠SSCs中的表观调控因子,当使用阴性对照小RNA、miRNA-224抑制剂和miRNA-224对照分别转染小鼠SSCs时发现miRNA-224对照能显著增加SSCs的数量以及SSCs中的1和的mRNA和蛋白水平,而miRNA-224抑制剂会减少SSCs的数量同时降低1和的表达;同时还发现miRNA-224能通过靶向其3'-UTR直接降低1的水平,而之后的1敲除实验显示β-catenin的表达水平会显著提高,这些结果表明miRNA-224对SSCs的增殖和分化具有重要调控作用且能够通过Wnt/β-catenin 通路来促进精原细胞分化。王银娟等发现miRNA-322在SSCs的表达量随着SSCs的发育而降低,体外增殖实验发现miRNA-322被抑制的SSCs中与分化有关的基因如8和等表达量上调,而SSCs本身的增殖能力受到抑制;当使用氯化锂处理SSCs后发现miRNA-322表达量被上调,同时Rassf8被下调,而miRNA-322的上调会导致Wnt通路中下游基因表达下调,之后用检测细胞周期时发现miRNA-322的表达会使增加S期和G2/M期的比例,说明miRNA-322对SSCs的增殖和分化具有重要调控作用。
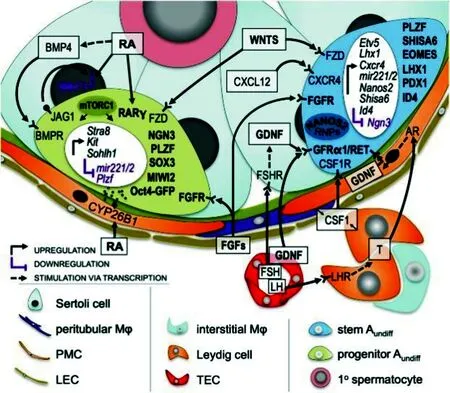
图1 成年小鼠SSCs的调控[18]Fig.1 Regulation of adult mouse SSCs[18]
5 SSCs的应用
SSCs作为雄性生殖干细胞能通过增殖、分化不断产生精子,对SSCs的研究能对精子发生机理、治疗雄性动物不育以及畜牧产业发展方面都具有重要作用。Zarandi等研究表明在癌症治疗前,对癌症患者的睾丸组织进行分离保存,等治愈后再将睾丸中的SSCs进行体外扩增并重新移植入患者体内,可以有效保存癌症患者的生育力。通过将优良种畜的SSCs移植入经济价值较低的公畜睾丸中,能有效提高优良品种的繁殖效率。此外SSCs还能通过去分化和转分化的作用生产其他类型的细胞,目前已有研究证明SSCs能直接转分化为功能性肝细胞。
6 小 结
随着精原干细胞深入研究,人们对精子发生过程的研究取得了一定的进展,对小鼠等小型动物SSCs的体外培养体系已经初步建立,但是对哺乳动物等大动物方面仍存在较多问题,如对SSCs分离纯化时样本获取困难同时缺乏特异性分子标记使分离纯化效率较低;对不同动物SSCs的分离纯化技术不同,但都操作复杂,成本较高;对SSCs体外培养体系中维持其增殖以及干细胞特性所需物质尚不明确,使SSCs难以在体外长期培养及传代,给研究增加了难度;对SSCs诱导分化的机理不是很清楚,因此在后续研究中建立各种动物高效且简便的SSCs分离、纯化方法;进一步探索体外培养体系中所需具体物质解决体外长期培养及传代的稳定性问题;探索SSCs体外诱导分化方法,为SSCs的移植提供材料,同时克服SSCs移植过程中免疫排斥问题,提高移植成功率将成为研究重点。
