多金属氧酸盐抗氧化特性及其在糖尿病治疗的研究进展
2022-06-19陈丙年张清稳
王 力,杨 晗,罗 丹,陈丙年,张清稳,倪 辉
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021 ;3.厦门大学医院外科,福建 厦门 361005)
0 引言
多金属氧酸盐(polyoxometalates,POMs)是一类多金属氧簇化合物,已有近200 a的研究历史[1]。随着技术的发展,POMs的合成与表征手段也在不断发展,合成过程中将POMs 中具有缺位结构的杂多酸离子与金属离子进行配位并修饰,或引入稀土离子形成稀土多金属氧酸盐。POMs的经典结构有Keggin、Dawson、Silverton、Anderson、Waugh、Lindqvist等[2]。POMs在生物[3]、光(电)催化[5]、医药[6]、纳米修饰电极[7]、氧化催化[8]等领域的研究日益增多。此外,POMs与多学科交叉融合,也为其他相关学科的科研工作者提供新的研究思路,在医药方面的抗癌[9]、抗病毒[10]、抑菌[11],以及糖尿病领域[12]展现出较好的应用前景。
近年来,POMs化合物在药物化学方面的研究进展引人注目[13],它在应用方面的价值及可开发前景引起了众多化学、生物、医药等领域研究者的关注[14-18]。相关研究[19]结果发现,POMs在糖尿病方面具有降血糖作用,但POMs对糖尿病的作用机制还不明确,有待进一步研究。越来越多的研究表明,氧化应激在糖尿病的发病机制中起主要作用[20],氧化应激中产生的自由基及几条主要通路会造成机体损伤,最终引起糖尿病并发症等疾病。抗氧化剂的作用是作为还原剂,给未配对的氧电子提供质子氢,而POMs可作为一种抗氧化剂,处于还原状态的POM簇可以作为良好的还原剂。本文对POMs在糖尿病治疗和抗氧化方面的应用进行综述,并对其在糖尿病方面的研究进行了展望。
1 糖尿病氧化应激机制
1.1 糖尿病
糖尿病是一种常见的代谢性疾病,主要由遗传、年龄、种族、环境等因素引起[21],它使机体内的糖、蛋白质、脂肪代谢紊乱,同时伴随水、电解质代谢紊乱,最终造成急性并发症[22]。糖尿病一般分为1型、2型、特殊类型和妊娠型4种类型[23],2型糖尿病外的类型仅占约5%~10%。在我国,近30 a来,糖尿病从少见病变成常见病,糖尿病在疾病中的比例已达到11.6%。由2019年国际糖尿病联盟公布的数据来看,中国、印度、美国糖尿病患者分别为1.164,0.77,0.31亿人,位居世界前三。全球48.1%的糖耐量受损人群的年龄在50岁以下,其中20~39岁的年轻人占28.3%,这类人群一旦最终发展为糖尿病,将意味着其一生将与糖尿病相伴[24]。迄今为止,有双胍类、苯甲酸衍生物类、二肽基肽酶- 4抑制剂和α-葡萄糖苷酶抑制剂等口服降血糖药可供患者使用[25]。
1.2 氧化应激产生机制
氧化应激是机体在不利环境因素中被刺激所产生的一种应激反应[26],糖尿病发生后氧化应激增加,最终将造成机体自身的细胞和组织损伤[27]。被刺激后的机体损伤主要是由于体内生产出超出自身清除程度、严重影响自身氧化平衡的自由基,主要是活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)产生较多,造成失衡。氧化应激的主要通路有葡萄糖氧化途径、多元醇通路、晚期糖基化终末产物途径、蛋白激酶通路、己糖氨途径等。
1.2.1 葡萄糖氧化途径
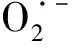
1.2.2 多元醇通路
多元醇通路是导致糖尿病患者氧化还原失衡的一个主要途径,烟酰胺腺嘌呤二核苷磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)对底物葡萄糖进行催化,最终将其还原为山梨醇,醛糖还原酶在多元醇通路中起到限制性作用[30]。山梨醇再通过山梨醇脱氢酶转化为果糖,并还原烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH),造成机体氧化还原失衡[31],使得ROS生成明显增加,氧化应激增强。多元醇通路还会导致NADPH酶和一氧化氮合酶(nitric oxide synthase,NOS)活性增强,氧化平衡失调,造成ROS明显增加。NADPH氧化酶和线粒体对糖尿病患者来说至关重要,它们不仅与ROS的生成密切相关,还与胰岛素有关,直接干扰胰岛素信号[32]。
1.2.3 晚期糖基化终末产物途径
据英国政府统计,现在的中小学生在未来有可能从事的工作有60%还没有被发明出来。老师与家长替孩子所做的职业选择和职业规划在未来极有可能失效,这其中的绝大部分是计算机科学领域的职业。随着计算机行业快速发展,行业版图拓展之快超乎人们想象,培养计算机领域的专业人才成为我国现代教育的重中之重,计算机信息化教育的加入将会弥补我国相关教育领域的技术空白。
糖尿病患者由于长时间血糖升高,大量葡萄糖堆积,其另一条氧化还原失衡的通路是细胞无氧糖酵解反应,胞内葡萄糖与DNA等分子发生一系列特殊反应,晚期糖基化终末产物(advanced glycation end products,AGEs)大量生成[33]。AGEs与其受体相结合,诱导细胞内信号相互传递,氧化应激增强[34],增加细胞内ROS的生成,从而导致慢性肌纤维损伤[35]。
1.2.4 蛋白激酶通路
蛋白激酶C(protein kinase C,PKC)通路也是造成糖代谢紊乱的通路之一[36]。PKC是一个蛋白质家族,它通过一系列反应中的磷酸化过程调节其他蛋白质的活性。在高血糖环境下,甘油醛-3-磷酸脱氢酶被抑制而导致甘油醛-3-磷酸的积累,在此情况下,二羟丙酮-3-磷酸(dihydroxyacetone-3-phosphate,DHA-3-P)水平升高,DHA-3-P随后被还原为甘油-3-磷酸,甘油-3-磷酸又与脂肪酸结合,通过1-酰基甘油-3-β-酰基转移酶和磷脂酸盐磷酸水解酶的作用推动二酰甘油(diacylglycerol,DAG)的合成。DAG含量升高使 PKC通路被激活,从而诱发ROS等高活性分子大量生成,通过诱导合成酶发生解偶联,引起内皮细胞的凋亡[37]。
1.2.5 己糖氨途径
己糖氨途径使糖尿病及其相关并发症(肾病)中的毒性和促氧化作用发生[38]。果糖-6-磷酸(F-6-P)被葡萄糖-果糖酰胺转移酶(glucose fructosamide transferase,GFAT)代谢为葡萄糖-6-磷酸(G-6-P),随后通过乙酰葡糖胺-1-磷酸尿苷转移酶(UDP-N)转化为尿苷二磷酸-乙酰葡糖胺(UDP-GlcNAc)[39]。在正常血糖水平下,极少量的F-6-P从糖酵解进入己糖氨途径;在高血糖条件下,过量的F-6-P被引导到己糖氨途径。因此,GFAT的活性被上调,UDP-GlcNAc水平升高,随后O-氨基葡萄糖-N-乙酰转移酶活性升高[40]。
氧化应激通路的具体机制如图1所示。

2 POMs在抗氧化中的应用
2017年,Reddy等[41]对[V6O19]8-家族进行研究,对多酸-有机杂化物TBA2[V6O13{(OCH2)3C-NH-CO-C11H9O}2]、TBA2[V6O13{(OCH2)3C-NH-CO-C10H8NO}2]和TBA2[V6O13{(OCH2)3C-NH-CO-C13H10N}2]进行合成、表征及体外抗氧化研究,标准抗氧化实验对3个杂化物的抗氧化性能进行评价,以TBA3[H3V10O28]为对照化合物,以抗坏血酸为标准。实验结果证明,杂化物优于未衍生化的化合物,杂化物表现出更好的抗氧化性能,为寻找出一种可靠的无机杂化合成抗氧化剂提供了可能。
2021年,Gong等[43]研究10核杂原子簇合物SbW8O30,通过蛋白质组学分析得出,SbW8O30通过影响蛋白质的表达来抑制ATP的产生,SbW8O30对体内代谢功能和活性氧应激引起的细胞增殖进行阻滞,SbW8O30的氧化还原机制使FAD/FMn结合酶低表达。SbW8O30保护过氧化氢酶和谷胱甘肽过氧化物酶,阻止ROS伤害细胞,表明POMs可能是特异的氧化、抗氧化调节剂。
2016年,Ueda等[44]用聚吡咯、聚3,4-乙二氧基噻吩和聚苯胺3种导电聚合物,研究了几种Keggin型POMs,还对POMs固定电极在不同条件下的伏安行为进行研究,最终选择最合适的PMo12O40-PPy电极作为氧化还原探针。同时,对几种典型的抗氧化剂的抗氧化活性进行电位法评价,POMs固定在电极上,评价食品的抗氧化能力,该方法显示出POMs用于检测抗氧化剂的抗氧化能力具有很高的潜力。
2021年,Yadav等[45]研究了POMs对氧化铈纳米颗粒(ceria nanoparticles,CeNPs)的模拟酶活性的影响,表明CeNPs具有生物酶模拟活性,可以清除细胞培养和动物模型中的活性氧和氮,保护机体免受亚硝化和氧化应激的有害影响。磷钼酸和磷钨酸都是电子密集型分子,表现出快速、可逆的多电子氧化还原反应,磷钨酸与CeNPs的相互作用提高了CeNPs(3+)的SOD活性和类过氧化氢酶活性, CeNPs(4+)表现出了很好的类过氧化氢酶活性,这种活性在与POMs相互作用后得到了增强。细胞研究表明,CeNPs-磷钨酸可以作为一种有效的抗氧化剂来降解细胞质中多余的H2O2。
3 POMs在糖尿病治疗中的应用
1985年,Heyliger等[46]报道,钒酸盐像胰岛素一样能刺激酪氨酸残基上的胰岛素受体磷酸化,证实钒酸盐类似于胰岛素在受体磷酸化上有相似的作用,在糖原合成酶和糖酵解等细胞实验上也有相似的作用。
1992年,Fillat等[47]对类似于钒酸盐的钼酸盐和钨酸盐在离体肝细胞中葡萄糖代谢应用进行了研究,结果表明,3个化合物均在糖酵解途径上具有胰岛素样作用。对于糖原磷酸化酶的激活,钒酸盐是这3种化合物中最有效的,但是否对糖尿病动物起到正常血糖胰岛素样作用还有待进一步研究。
1998年,Foster等[48]发现,钨(钒、钼、磷)酸盐具有共同的四面体结构,作为G-6-P酶水解抑制剂,它不仅催化单元的活性部位,还与酶的磷酸底物竞争。钨酸盐通过抑制肝脏葡萄糖输出来降低血糖水平,钨酸盐的急性胰岛素样作用可能包括对肝脏产生的关键酶G-6-P酶进行抑制。
2001年,Nomiya等[49]对糖尿病小鼠进行体内实验,研究了加钒和不加钒的POMs对全无机组成的金属氧化物簇的拟胰岛素效应,几种同源POMs和钒取代POMs均有降血糖作用。单体钨酸盐和钒酸盐,钨酸盐和钒酸盐簇合物的结构因素可能在它们的生物学作用中发挥重要作用。
2014年,Ilyas等[50]合成不同的多氧钨酸盐,并在体外/体内评价其对糖苷酶、醛糖还原酶和AGEs的作用,以寻找一种可能限制糖尿病相关并发症的新的治疗方法。体内外实验数据证实,[P6W18O79]20-和[H2W12O40]6-可作为糖尿病的一种新的治疗方法。
2015年,Balici等[51]使用POMs对糖尿病大鼠治疗3周后,与对照组相比,血糖水平有统计学意义的降低。经治疗的糖尿病大鼠胰腺β细胞的超微结构分析证实,多酸有助于抑制链脲佐菌素所致的细胞变性,胰岛素的囊泡数量有所增加。对实验组大鼠肝细胞超微结构的研究表明,化合物也有保肝作用。这两种化合物通过阻止链脲佐菌素诱导的胰腺β细胞凋亡和刺激胰岛素合成而达到降血糖作用。
2020年,户晶晶等[52]在轮型簇钼多金属氧酸盐研究中合成并表征4种化合物,通过酶动力学分析发现,4种化合物均有较好的抑制效果,4种化合物对α-葡萄糖苷酶的抑制机理为可逆性。
2020年,迟国祥[53]在关于多金属氧酸盐研究中,对Keggin型和Dawson型多酸在体外进行α-葡萄糖苷酶抑制效果和机理的研究,酶动力学研究确定化合物的IC50、抑制机理、抑制类型和抑制常数,分子对接实验确定化合物与α-葡萄糖苷酶的结合能力,验证酶动力学。与临床应用的α-葡萄糖苷酶抑制剂阿卡波糖进行对照,结果可知,磷钼酸的IC50是阿卡波糖的117倍;通过分子对接模拟研究证实多酸与底物结合位点相互作用的抑制类型,多酸主要通过氢键和范德华力相互作用力与α-葡萄糖苷酶位点氨基酸相结合。实验结果为设计具有良好抑制效果、较低毒性、较好生物活性的多酸以及治疗糖尿病的药物提供了可能。关于对α-葡萄糖苷酶的相关实验和酶动力学结果如表1所示,分子对接模拟研究结果如表2所示。

表1 合成化合物对α-葡萄糖苷酶的抑制效果
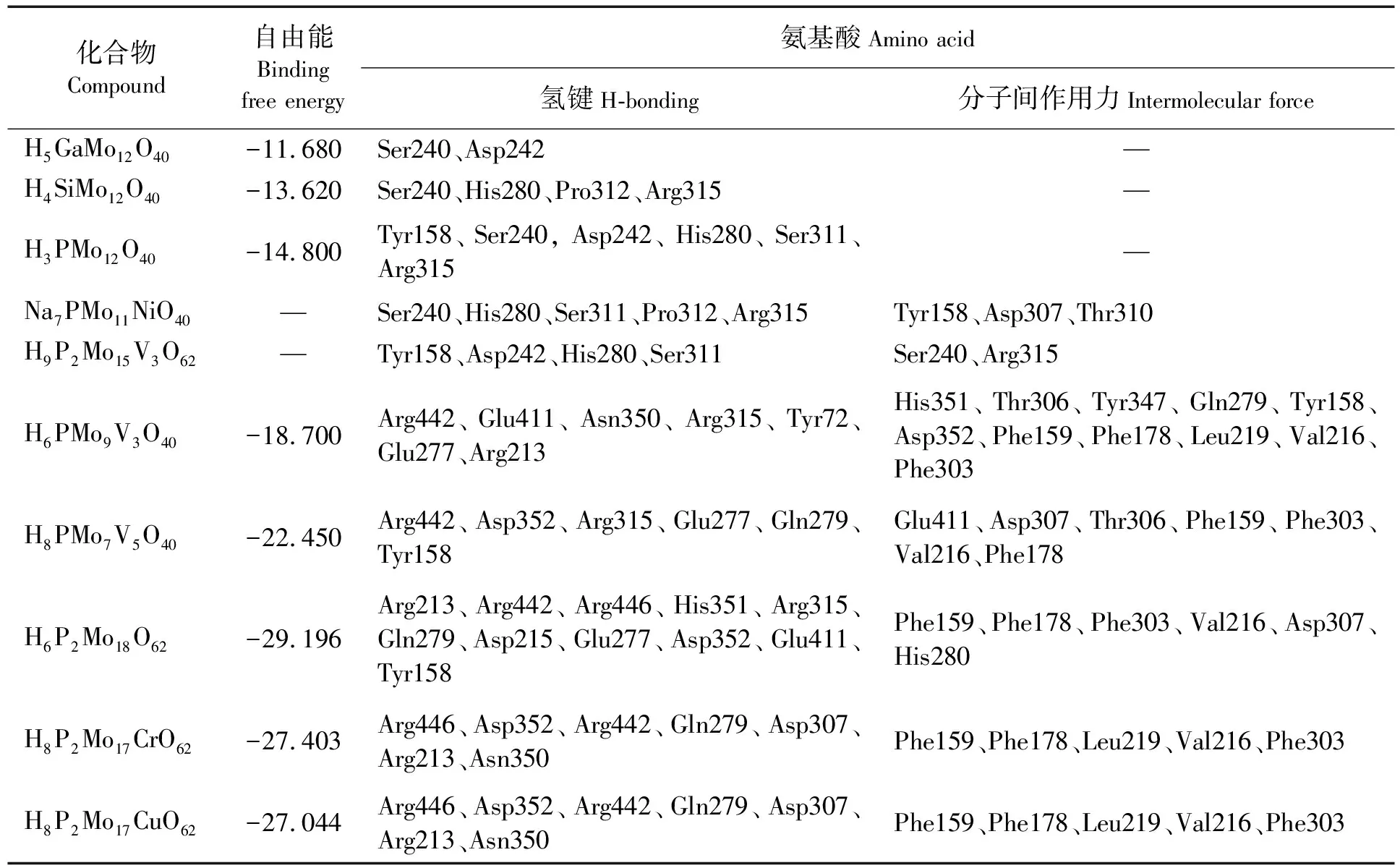
表2 分子模拟结果及配体周围重要氨基酸汇总
4 结论
自由基副产物ROS过度产生会引起氧化应激,引起有氧生命系统的细胞损伤。氧化应激与糖尿病等疾病的发病机制有关,是糖尿病及其并发症发病的关键因素。抗氧化剂是减慢、阻止或中和自由基对靶分子的氧化损伤的一类物质,抗氧化剂的摄入对糖尿病治疗的作用值得研究。目前,POMs在药物化学领域展现出较好的应用前景,一批以靶向药物为代表的新型的治疗糖尿病的方法也逐步出现,为研究多酸在糖尿病中的抗氧化作用机理研究提供了可能。期待未来会有更多、更安全、更有效的新型的治疗糖尿病的药物和治疗方法出现。
