旱半夏组培苗遗传稳定性ISSR分析
2022-06-16黄勇盛
喻 娜,黄勇盛,黄 旭
(广安职业技术学院,四川广安 638000)
旱半夏(Pinellia ternata)也称为半夏、三步跳、麻芋等,天南星科半夏属多年生草本植物[1]。旱半夏是一种重要的中药材,块茎入药,块茎的成分75%左右为淀粉,除此之外还含有β-谷甾醇-D-葡萄糖甙、半夏蛋白、鞣质、生物碱、多种氨基酸、原儿茶醛及18 种微量元素等药用成分[2-5]。旱半夏具有镇咳、祛痰、降压、健脾胃、止呕吐、降脂、抗心律失常、抗坏血栓、抗肿瘤、抗炎、抗菌、抗癫痫、减轻动脉粥样硬化等药理作用,在我国中医药史上有着广阔的前景[6-9]。
已有研究表明,在植物组织培养过程中,体细胞无性系在分子水平或染色体水平的变异是普遍存在的一种现象[10]。近年来,简单重复序列间区(inter simple sequence repeat,ISSR)标记技术常常应用于动植物的亲缘关系和遗传多样性进行分析,并在遗传学研究中发挥着重要的作用。ISSR技术已成为DNA分子标记技术中的一个热点,由Zietkeiwitcz 等[11]于1994年提出,它是在简单重复序列(simple sequence repeat,SSR)基础上发展起来的1 种新型分子标记技术。该技术结合了SSR 和RAPD 技术的优点,具有操作简单、试验稳定性好、多态性丰富、重复性强、DNA 模板用量少和实验成本低等优点[12-15],已广泛应用于种群间或种群内的遗传多样性、遗传差异性、遗传稳定性分析,对了解种群遗传变异的大小、时空分布及其与环境变化和人类活动的关系,了解药用植物种群起源、进化历程和现今分布格局,以及开展药用植物种质资源育种和采取科学有效的保护措施均具有指导意义[16-18]。
此前,已有将分子标记法应用到天南星科植物领域的遗传学分析中的研究,如邓瑞宁利用SRAP 技术对10种不同叶形荆半夏的遗传多样性及亲缘关系进行了分析[19],成玉等应用AFLP 技术探讨半夏属五个种的亲缘关系[20],但对旱半夏组培苗遗传稳定性的研究还未见报道,本项目采用ISSR分子标记法对旱半夏组培苗继代五代苗、八代苗、十一代苗、五十代混合组培苗、六十代混合组培苗进行遗传稳定性分析,以期进一步为旱半夏组培苗推广种植提供理论依据。
1 材料与方法
1.1 试验材料
本试验材料采自四川省武胜县万民村(经纬度:106.431 56,30.375 21)野生旱半夏,将野生旱半夏移栽至花盆,带回实验室,以野生旱半夏叶片为外植体,经组培室诱导愈伤再生并继代培养,将野生植株、继代五代、继代八代、继代十一代、继代五十代,继代六十代组培苗作为供试材料。
1.2 DNA的提取和检测
取旱半夏嫩叶和茎,利用《BioFastSpin 植物基因组DNA提取试剂盒》分别提取总DNA,电泳结果分析表明,电泳条带整齐、明亮清晰、无拖尾现象,无蛋白污染,提取的旱半夏基因组DNA 质量较好,样本适用于ISSR-PCR 检测(见图1)。将样品放置在-20 ℃冰箱保存。

图1 提取的旱半夏总DNA电泳检测
1.3 PCR扩增
实验用Biospin 全能型植物基因组DNA 提取试剂盒购买自杭州博日科技有限公司,其他普通化学试剂则购自南宁国拓生物科技有限公司,采用DL2000 Marker 作为分子量标准。引物是从加拿大哥伦比亚大学公布的100 条UBC-ISSR 引物中筛选出的6 条(见表1),筛选出来的引物由上海生工(San-gon)合成。在(Easy Cycler)梯度PCR 仪(德国,AnalytikJena)上进行PCR 反应,实验使用20 μL 体系,10 μL Mix,1 μL 引物,1 μL DNA 模板,8 μL ddH2O,94 ℃预变性5 min;94 ℃变性30 s;56 ℃复性45 s;72 ℃延伸90 s;40 个循环:72 ℃延伸10 min,4 ℃保存。通过PAGE 电泳及银染。在5200 Multi(上海天能)全自动化学发光/荧光图像分析系统中记录扩增结果。

表1 UBC引物系列
1.4 数据统计和分析
通过人工识别的方式统计旱半夏不同代数的凝胶电泳图谱条带数目。
2 结果与分析
2.1 ISSR-PCR扩增结果
图2 是利用筛选出来的6 条引物对旱半夏野生苗和组培第五代、第八代、第十一代组培苗进行ISSRPCR 扩增的图谱,野生型纸质同组培苗的带型和亮度基本一致,第46条引物扩增出来的条带中,组培苗出现了一条多态性条带,组培苗第五代、第八代和第十一代的带型和亮度完全一致,组培苗之间保持了一致(图2-A、图2-B)。ISSR 分子标记的分析结果表明,继代到第十一代的旱半夏组培苗与野生型旱半夏苗基本没有差异。
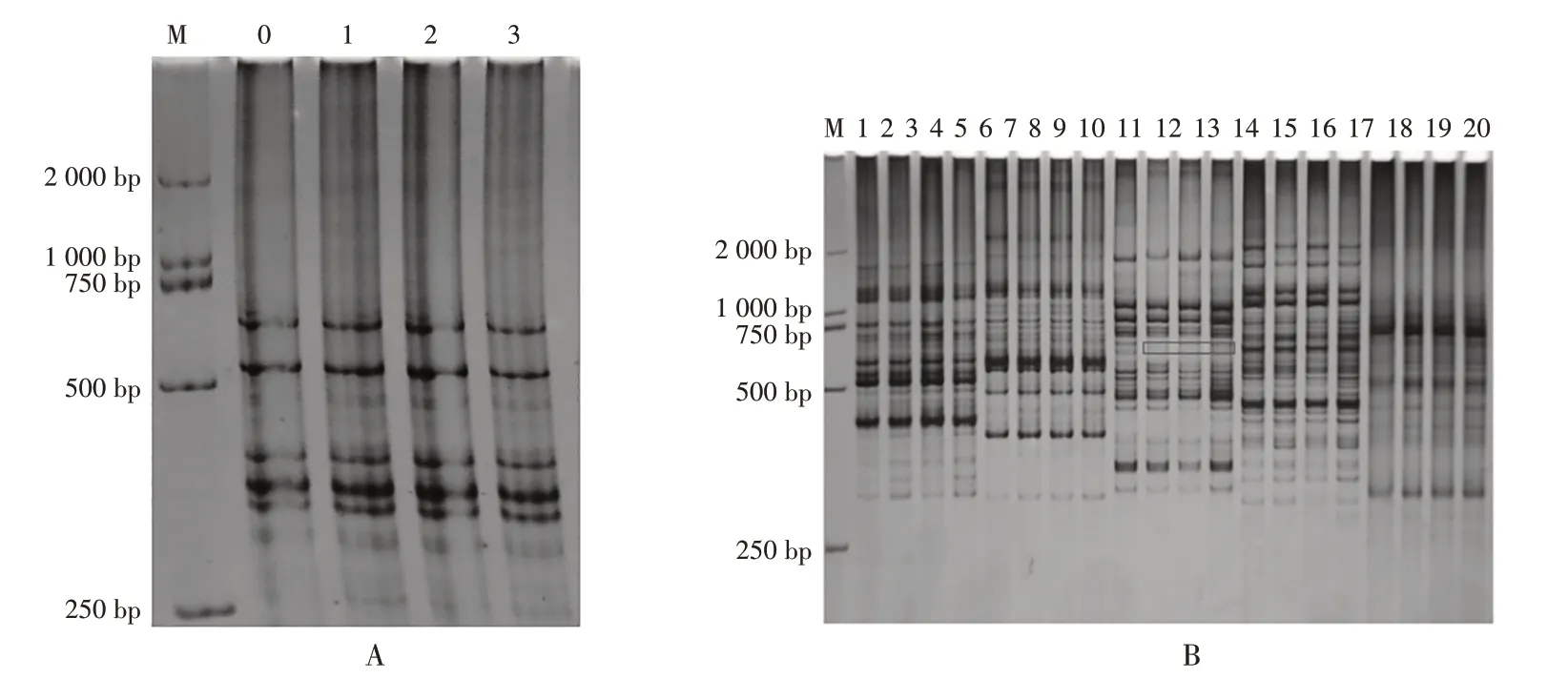
图2 引物18、25、26、46、55、62在野生植株、第五代、第八代、第十一代组培苗ISSR-PCR扩增的条带
图3 是利用筛选出来的6 条引物对旱半夏野生苗和组培第五十代、第六十代组培苗ISSR-PCR 扩增的电泳图谱。从图谱中看,在旱半夏继代的过程中,6条引物扩增出来的电泳图谱基本和野生苗的带型保持一致,没有发生明显变化。其中25 号引物和46 号引物扩增的第五十代和第六十代组培苗分别出现了一条特异性条带,第五十代和第六十代组培苗之间完全保持一致(见图3),因此可以认为旱半夏在六十代的继代过程中具有较高的遗传稳定性。

图3 引物18、25、26、46、55、62在野生植株、第五十代、第六十代组培苗ISSR-PCR扩增的条带
2.2 旱半夏野生植株与不同组培苗之间的遗传差异性分析
筛选的6 条引物对旱半夏野生苗和组培第五代、第八代、第十一代的组培苗进行ISSR-PCR 扩增,总共扩增出110 条条带,组培苗在扩增的几代过程中电泳条带带型基本一致,其中46号引物扩增的条带中发现,从组培苗第五代出现了一条多态性条带,多态性比例仅仅只有0.88%(见表2)。
筛选的6条引物对旱半夏野生苗和组培第五十代、第六十代的组培苗ISSR-PCR扩增,总共扩增出116条多态性条带,其中25 号引物和46 号引物扩增的第五十代和第六十代组培苗分别出现了一条特异性条带,多态性比例为1.42%(见表3)。

表3 野生植株与第五十代、第六十代组培苗遗传差异性
3 讨论
对于药用价值极高的旱半夏,采用组培技术进行快繁和生产,关键是保持其性状。旱半夏组培苗一般通过外植体叶片或者茎诱导愈伤组织,然后再从愈伤组织分化出再生植株,整个培养和继代的过程长期使用植物生长调节剂,使生长点分生组织长期处于活跃的状态,可能引起变异。
对品种遗传变异检测传统的方法主要是通过植物形态学进行鉴定和分析,但由于植株的很多基因水平的变异不一定表现出性状,因此仅仅依靠形态学观察很难准确的检测。而采用ISSR分子标记技术快速、准确、操作简单,可以从基因组DNA 的多态性信息分析,并直接从DNA 水平反映碱基序列片段的变化,因此,可以从分子水平上阐明组培苗遗传稳定性的分子机理。
本研究应用ISSR 分子标记技术对旱半夏组培苗第五代、第八代、第十一代进行DNA 检测,以及对在实验室继代了3 年的第五十代、第六十代苗分别混合批量进行ISSR 分析,得到的DNA 片段带型基本一致,扩繁到六十代多态性仅仅在1.42%,证明组培苗在DNA 水平上基本保持了遗传稳定性。这与前人关于草莓[21]、桉树[17]、叶艺春兰[22]等植物组培苗遗传稳定性的研究报道一致。由此可见,将组培技术用于中药材植物旱半夏的快速繁殖是可行的。
