类叶升麻苷对叠氮钠诱导的PC12细胞线粒体凋亡的保护作用
2022-06-15李建梅阿娜古丽马合木提
高 莉, 李建梅, 阿娜古丽·马合木提, 闫 明
(新疆维吾尔自治区维吾尔医药研究所,新疆维吾尔医方剂学重点实验室,新疆 乌鲁木齐 830011)
大多数神经退行性疾病都存在神经细胞线粒体功能异常、细胞骨架的破坏和神经细胞凋亡等与脑内线粒体功能障碍密切相关的重要病理生理改变[1-2],其中细胞色素C氧化酶(即线粒体呼吸链复合体Ⅳ,COX)作为线粒体的标志酶,是维持线粒体功能,进行细胞能量代谢的关键,它的缺陷被认为可能是神经退行性疾病的特异改变[3-4]。叠氮钠(NaN3)是COX的抑制剂,用NaN3损伤PC12细胞或神经母细胞瘤细胞,可剂量依赖性地使COX活性下降,造成细胞线粒体功能障碍,产生氧化应激,导致多种凋亡因子的释放和细胞膜的损伤,引起细胞死亡[5]。
类叶升麻苷是苯乙醇苷类化合物,在洋丁香、车前草、肉苁蓉等79种植物中广泛存在,资源丰富,具有抗氧化、抗炎、神经保护、改善认知障碍等多种功效[6-7]。前期研究发现,类叶升麻苷具有抗氧化、抗炎、调节ADP/ATP比值以及保护神经元的作用,但其是否通过线粒体保护途径[8-9]发挥作用尚不明确。因此,本实验以NaN3诱导PC12细胞建立线粒体损伤细胞模型,探讨类叶升麻苷对线粒体损伤的细胞线粒体凋亡途径的影响。
1 材料
1.1 试剂与药物 类叶升麻苷(新疆维吾尔自治区维吾尔医药研究所自制,批号20130401,纯度≥98%)。RPMI-1640培养基、胰蛋白酶(美国Gibco公司);胎牛血清(美国Thermo公司);氨苄青霉素钠、硫酸链霉素(北京索莱宝科技有限公司);MTT(美国Sigma公司);乳酸脱氢酶(LDH)测试盒(南京建成生物工程研究所);细胞色素C氧化酶(COX)活性检测试剂盒(上海杰美基因医药科技有限公司);细胞凋亡检测试剂盒(美国BD公司);anti-Bax抗体、anti-Bcl-2抗体、anti-caspase-3抗体、anti-caspase-9抗体、山羊抗兔IgG(北京中杉金桥生物技术有限公司)。叠氮钠(上海埃彼化学试剂有限公司,批号20120618,纯度≥99%);丙酮酸钠(天津市光复精细化工研究所);其他试剂均为分析纯。
1.2 仪器 YJ-875型超净工作台(上海苏净实业有限公司);37XB型倒置显微镜(上海光学仪器六厂);MCO-18AIC型CO2培养箱(北京索莱宝科技有限公司);Multiskan Go 1510型酶标仪、LEGEND MICRO 21R型台式高速冷冻离心机、Nanodrop little型核酸浓度检测仪(美国Thermo公司);FACS Aria Ⅱ型流式细胞仪(美国BD公司);GeneAmp PCR system 9700型PCR仪(美国Perkin Elmer公司);SDS-PAGE电泳系统(北京六一生物科技有限公司);125-BR垂直电泳仪、凝胶成像系统(美国Bio-Rad公司)。
1.3 细胞 鼠肾上腺嗜铬细胞瘤(PC12)细胞由中国科学院上海细胞库提供。
2 方法
2.1 细胞培养 将PC12细胞以5×104/mL密度接种于含10%胎牛血清、0.11 g/L丙酮酸钠、2.5 g/L葡萄糖、1.5 g/L NaHCO3、100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养基中,置于37 ℃、5% CO2培养箱中培养,每隔3 d换传代1次。
2.2 模型建立 以MTT值为指标,细胞存活率达到40%~60%作为评价指标。将细胞接种于96孔板,待70%~80%融合时加入NaN3,使其终浓度分别为0、50、100、200 mmol/L,在37 ℃、5% CO2恒温培养箱中继续培养4 h,采用MTT法计算细胞存活率,确定NaN3剂量。
2.3 类叶升麻苷与NaN3损伤PC12细胞共孵育 培养贴壁PC12细胞,吹打悬浮后以5×104/mL密度接种到96孔板或细胞瓶中(空白组不含细胞,加入等体积PBS溶液),培养过夜,待70%~80%融合时吸取原培养液,模型组、给药组加入150 μL含100 mmol/L NaN3的1640培养液(空白组加入等体积不含NaN3的PBS溶液,对照组加入等体积不含NaN3的培养液),在37 ℃下恒温孵育4 h后,吸取各组培养液,给药组再加入200 μL含有不同浓度(1、10、100 μmol/L)类叶升麻苷的培养液(空白组加入等体积PBS溶液,对照组及模型组加入等体积培养液)孵育24 h,显微镜下观察细胞形态并取样进行后续检测。
2.4 MTT法检测细胞存活率 取对数生长期PC12细胞,接种于96孔培养板培养48 h,空白组每孔加入20 μL PBS溶液,其余组每孔加入20 μL MTT(5 g/L),继续培养4 h,吸出培养液,空白组每孔加入150 μL PBS溶液,其余组每孔加入等体积DMSO,振荡溶解后,在490 nm波长处测定光密度(OD)值,计算细胞存活率。
2.5 细胞培养上清液中LDH酶活性检测 取对数生长期PC12细胞,接种于96孔培养板,按“2.3”项下方法分组给药,收集细胞培养上清液,每组10孔,按照试剂盒说明书检测LDH活性。
2.6 细胞线粒体COX活性检测 取对数生长期PC12细胞,培养于25 cm2细胞培养瓶,按“2.3”项下方法分组给药,收集细胞,按照试剂盒说明书检测COX活性,重复4次,检测总蛋白浓度后,待测样品以50 μg总蛋白为标准进行检测。
2.7 细胞凋亡率检测 采用Annexin V-FITC/PI双染色法,以RPMI 1640培养基调节细胞密度至5×104/mL,接种至25 cm2培养瓶培养中48 h,加入100 mmol/L NaN3损伤4 h,按“2.3”项下方法分组给药,将细胞自瓶壁上轻轻吹打下来,制成单细胞悬液后移入离心管中,1 000 r/min离心10 min,弃上清液,加入预冷PBS清洗3次,Binding Buffer重悬浮细胞,调整细胞密度为1.0×106/mL,取100 μL细胞悬液,加入FITC标记的Annexin V、PI溶液各5 μL,轻轻混匀,室温避光染色20 min,加入Binding Buffer 400 μL,混匀,采用流式细胞仪检测细胞凋亡率。
2.8 细胞Bax、Bcl-2、caspase-3、caspase-9蛋白表达检测 取对数生长期PC12细胞,接种于6孔细胞培养板,按“2.3”项下方法分组给药,收集细胞,提取总蛋白,BCA法检测蛋白浓度,采用5%浓缩胶、10%分离胶进行电泳,湿转至PVDF膜,脱脂奶粉溶液封闭2 h,一抗(1∶1 000)4 ℃孵育过夜,1×TBST洗涤,二抗(1∶3 000)孵育1 h,1×TBST洗涤,按1∶1比例避光加入发光液,立即用化学发光成像仪曝光,保存成像条带,进行定量分析,重复3次。
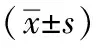
3 结果
3.1 NaN3对PC12细胞生长情况及细胞存活率的影响 与对照组比较,50、100、200 mmol/L NaN3作用4 h后,细胞形态均有不同程度的损伤,并随着剂量增加更明显,表现为细胞数目减少,轴突缩短、减少、消失,细胞变圆(图1A),其中100、200 mmol/L NaN3组细胞存活率降低(P<0.01),细胞线粒体还原MTT的能力分别为对照组的(62.76±2.38)%、(40.64±6.45)%(图1B)。根据损伤程度,后续实验选择造模条件为100 mmol/L NaN3作用PC12细胞4 h。
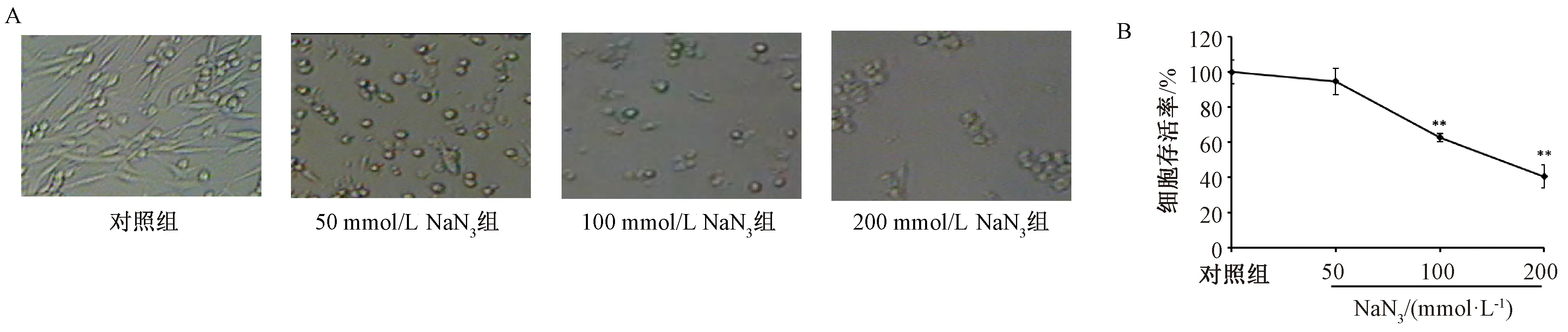
注:与对照组比较,**P<0.01。图1 NaN3对PC12细胞生长(A)及存活率(B)的影响
3.2 类叶升麻苷对NaN3损伤后PC12细胞存活率和细胞膜损伤的影响 如图2所示,与对照组比较,模型组细胞数减少,形态变圆变小,扁平,无光泽,轴突消失,细胞存活率降低(P<0.01),细胞培养上清液中LDH酶活性升高(P<0.01);与模型组比较,类叶升麻苷各剂量组细胞梭形、轴突、立体光泽等形态特征恢复,细胞存活率升高(P<0.01),细胞上清液中LDH释放量降低(P<0.01),并呈现剂量依赖性。

注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。图2 类叶升麻苷对NaN3损伤后PC12细胞形态(A)、细胞存活率(B)及细胞膜损伤(C)的影响
3.3 类叶升麻苷对NaN3损伤后PC12细胞线粒体COX活性的影响 图3显示,与对照组比较,细胞经NaN3损伤后线粒体COX活性受到抑制(P<0.01);与模型组比较,1、10、100 μmol/L类叶升麻苷组细胞COX活性升高(P<0.05,P<0.01),并且剂量越低,效果越明显。

注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图3 类叶升麻苷对NaN3损伤后PC12细胞线粒体COX活性的影响
3.4 类叶升麻苷对NaN3损伤后PC12细胞凋亡的影响 图4显示,对照组细胞早期凋亡率为(3.774±0.894)%,而模型组细胞与100 mmol/L NaN3共孵育4 h后增至(34.805±2.857)%(P<0.01);与模型组比较,类叶升麻苷各剂量组细胞早期凋亡率均降低(P<0.01),并呈现剂量依赖性。
3.5 类叶升麻苷对NaN3损伤后PC12细胞凋亡因子蛋白表达的影响 图5显示,与对照组比较,模型组细胞Bax、caspase-3、caspase-9蛋白表达升高(P<0.01),Bcl-2蛋白表达降低(P<0.01);与模型组比较,类叶升麻苷各剂量组细胞Bax、caspase-3、caspase-9蛋白表达降低(P<0.05,P<0.01),Bcl-2蛋白表达升高(P<0.01)。
4 讨论
神经退行性疾病,如阿尔茨海默病、帕金森氏病和亨廷顿病等的发生与脑内线粒体缺陷密切相关,其患者体内均存在线粒体功能和线粒体DNA的异常,这一观点已得到广泛认同[10-11]。目前研究发现COX活性在阿尔茨海默病患者中下降30%~40%[12],且有研究证实轻度认知障碍患者和阿尔茨海默病患者脑内葡萄糖代谢紊乱导致脑能量代谢降低,并由此影响脑功能正常发挥,造成学习记忆能力缺陷[13]。
COX的特异性抑制剂NaN3作为工具药已被广泛地应用于制备模拟阿尔茨海默病的细胞和动物模型。研究证明,它可以损伤神经细胞使动物产生学习记忆障碍,其作用机制可能包括神经细胞骨架损伤、氧化损伤、离子内稳态破坏、细胞膜损伤、细胞凋亡和坏死等[14-15]。本实验中选择不同剂量NaN3与PC12细胞共同孵育4 h,通过考察细胞存活率,确定了在本实验室环境下,采用100 mmol/L NaN3损伤PC12细胞4 h后PC12细胞存活率大约为60%的造模条件,确保了细胞模型既有损伤又能保证损伤不至于影响研究类叶升麻苷的药效作用。实验中建立的造模条件与文献[5,16]报道的作用剂量和作用时间基本相似。

注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图4 类叶升麻苷对NaN3损伤后PC12细胞凋亡的影响

注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图5 类叶升麻苷对NaN3损伤后PC12细胞凋亡因子蛋白表达的影响
本实验在建立NaN3造模条件的基础上,研究不同剂量类叶升麻苷对NaN3损伤PC12细胞的影响。结果发现,不同剂量类叶升麻苷呈剂量依赖性地恢复PC12细胞受到的NaN3损伤,不同程度恢复PC12细胞的梭形、轴突等特征,提高细胞的存活率,增加COX活性。类叶升麻苷对细胞COX活性的影响呈现随剂量降低效果增强的趋势,一方面表明类叶升麻苷在改善NaN3抑制COX活性作用方面起效剂量低;另一方面也表现出类叶升麻苷抑制COX活性的作用时效可能较快,在较高剂量下也许可以快速调节细胞中COX活性抑制的状态,并在作用24 h检测之前,已经快速解除了COX活性抑制的状态,激发了机体自我平衡的反馈抑制机制的反应。鉴于类叶升麻苷对于COX活性调节的敏感性,在今后的研究中,不仅应对其量效关系进行研究,更应开展其时效关系的深入研究。
线粒体可以介导细胞内凋亡通路的发生,当线粒体功能受到损伤时,其膜通透性改变,释放细胞色素C,导致csapase-9活化,引起caspase通路级联反应,通过线粒体凋亡途径诱发细胞凋亡[17-18]。NaN3制备PC12线粒体损伤模型可以较好地模拟这一病理变化[19]。LDH是反映细胞损伤的重要指标,可以直接反应细胞膜的完整性和通透性,检测细胞培养液中LDH活性,可以间接反应细胞的受损情况。流式细胞技术是目前研究细胞凋亡较灵敏和全面的实验方法。因此,实验中采用流式细胞技术检测类叶升麻苷对NaN3损伤PC12细胞凋亡的作用,并采用Western blot方法对线粒体凋亡途径相关凋亡蛋白表达进行检测。研究结果发现,PC12细胞经NaN3损伤后,LDH的释放量增加,细胞早期凋亡和晚期凋亡,凋亡因子Bax、caspase-3、caspase-9蛋白表达升高以及抗凋亡因子Bcl-2蛋白表达降低,然而将1、10、100 μmol/L类叶升麻苷与模型细胞共孵育24 h后,类叶升麻苷能降低PC12细胞的LDH释放量,提高正常细胞比例和降低细胞早期凋亡率,降低细胞Bax、caspase-3、caspase-9蛋白表达以及升高Bcl-2蛋白表达,且呈剂量依赖性。提示,类叶升麻苷对NaN3损伤PC12细胞的细胞膜完整性和通透性具有保护作用,对线粒体受损PC12细胞的晚期凋亡无作用,但对细胞早期凋亡有抑制作用,能够通过介入线粒体凋亡途径改善模型细胞的早期凋亡增加的现象。
综上所述,类叶升麻苷拮抗NaN3损伤细胞的机制可能为NaN3通过抑制COX活性导致线粒体跨膜电位降低,能量供应不足,引起细胞骨架的损伤,导致细胞膜通透性增加,继而引发细胞凋亡,从而保护细胞的存活和增殖。类叶升麻苷能够通过改善和保护线粒体功能起到防治线粒体功能障碍的神经退行性等疾病的作用,对此类疾病治疗具有一定的应用前景。
