胃癌根治术后淋巴结阳性患者的复发转移分析及Nomogram预测模型的建立
2022-06-14洪晴荆明林姗秦艳茹
洪晴,荆明,林姗,秦艳茹
(郑州大学第一附属医院 肿瘤科,河南 郑州 450000)
胃癌是中国最常见的肿瘤之一,发病率和死亡率均在中国所有癌症中位居第3位[1]。胃癌预后较差,多数患者诊断时已是中晚期,常伴有局部转移或全身转移。既往研究已经证实淋巴结转移是患者复发和预后相关的一个重要因素[2-5]。一般胃癌患者经过胃镜检查及病理学诊断可以确诊,并提供一定的临床分期,但常规检查如胃镜超声、多排螺旋CT、磁共振成像(magnetic resonance imaging,MRI)等在判断淋巴结转移方面仍存在一定局限性,目前仍以淋巴结病理活检作为淋巴结转移及术后病理分期的金标准[6-7]。胃癌根治术是临床治疗的有效手段,但仍有部分患者出现了术后复发或转移,从而导致疾病进展,无论是早期胃癌还是进展期胃癌[4],预后一般较差[8-9]。为进一步探讨疾病不同特征群体,细化疾病不同时期的特点,对于已经接受胃癌根治术的初治患者,在无远处转移的情况下,通过术中淋巴结清扫明确存在淋巴结转移并达到R0切除后,基于对当前根治性手术的认可和发展,术后初期的治疗和复查多是积极的,但随着时间推移仍会出现不同的结局。本研究筛选出胃癌根治术后仅伴有淋巴结阳性患者,以术前实验室指标、临床病理特征、复发转移时间等为基础,分析术后复发转移的相关危险因素,同时构建复发转移的Nomogram预测模型,从而促使该群体获得更为积极的个体化多学科综合治疗,在临床决策及医患沟通上也具有指导性意义。
1 材料与方法
1.1 一般资料通过收集郑州大学第一附属医院的2015年5月至2018年5月的胃癌患者病例进行回顾性分析。根据纳入排除标准后,纳入有效病例310例,其中出现术后复发转移患者125例(40.3%,复发组),未出现复发转移患者185例(59.7%,无复发组)。无复发生存时间(recurrence-free survival,RFS)定义为患者施行手术日期至术后复查时首次出现复发转移的时间。总生存时间(overall survival,OS)定义为疾病确诊日期至出现死亡结局(包括任何原因所导致的死亡)或随访截止(研究结束时仍存活的个体)的时间。术后首次复发转移可通过病理学、CT、MRI及正电子发射型计算机断层显像进行评估和诊断。所有实验室指标均为术前检验。术中药物植入为氟尿嘧啶缓释植入剂。肿瘤浸润深度、淋巴结转移分期及病理分期均按美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版TNM分期系统进行。
1.2 纳入排除标准纳入标准:(1)胃的原发性肿瘤,术后经病理证实主要为腺癌,且存在区域淋巴结转移;(2)未行新辅助化疗,术后所行辅助化疗以氟尿嘧啶类药物为基础;(3)术前检查时未发生远处转移;(4)所接受的手术为规范胃癌根治术,且为R0切除;(5)患者病历资料完善。排除标准:(1)术前行辅助放化疗;(2)接受姑息性手术及治疗;(3)既往有其他肿瘤病史;(4)重要病历资料缺如;(5)有感染性疾病、血液系统疾病等可能影响血液指标数值的相关疾病。
1.3 随访本研究随访时间截止至2021年5月,总随访时间为2.52~71.87个月,中位随访时间为43个月,主要研究终点为疾病复发或出现新的转移病灶等,次要研究终点为任何原因所导致的死亡结局。对于术后1~2 a患者每3~6个月随访1次,术后3~5 a患者6~12个月随访1次,随访内容包括肿瘤标志物、胃镜、CT、MRI等检查结果,期间通过电话随访、门诊随访或者网络随访。
1.4 统计学方法应用SPSS 24.0和R version x64 3.6.3处理数据。分类变量采用χ2检验或Kruskalwallis U秩和检验。其中以是否发生复发转移为参考标准,对数值变量如年龄、D-二聚体-白蛋白比值(D-dimer-albumin ratio,DA)、纤维蛋白原-D-二聚体比值(fibrinogen-D-dimer ratio,FA)、血小板-淋巴细胞比值(platelet-lymphocyte ratio,PLR)等进行绘制ROC曲线,分别得出最佳截断值62.5、0.002 64、0.081、84.286(AUC>0.5)后转换成二分类变量。随后纳入P<0.1或者临床上有意义且不存在共线性的自变量进行多因素非条件logistic回归分析,通过向前向后逐步回归法确立拟合优度最优模型选择变量,探究与该群体复发转移相关的危险因素。同时对所有自变量进行单因素Cox回归分析,纳入P<0.1的指标,通过向前向后逐步回归法进行多因素Cox比例风险模型选择,构建复发转移的Nomogram预测模型。P<0.05为差异有统计学意义。
2 结果
2.1 时间资料及复发转移的单因素分析共收集310例患者资料,总体患者平均RFS为(48.78±1.63)个月,中位RFS为36.74个月,1、2、3 a的累积无复发生存率分别为80.6%、69.9%、61.4%。其中复发患者平均OS为(21.40±1.50)个月,中位OS为12.49个月,未复发患者平均OS为(69.90±1.35)个月,中位OS为45.08个月,复发患者的1、2、3 a的累积生存率分别为64.8%、43.7%、13.1%。经过对310例资料的初步分析,年龄、肿瘤最大直径、T分期、N分期、AJCC病理分期、辅助化疗、脉管侵犯、CA125、CA199、DA、FA、PLR与复发转移相关(P<0.05)。见表1。
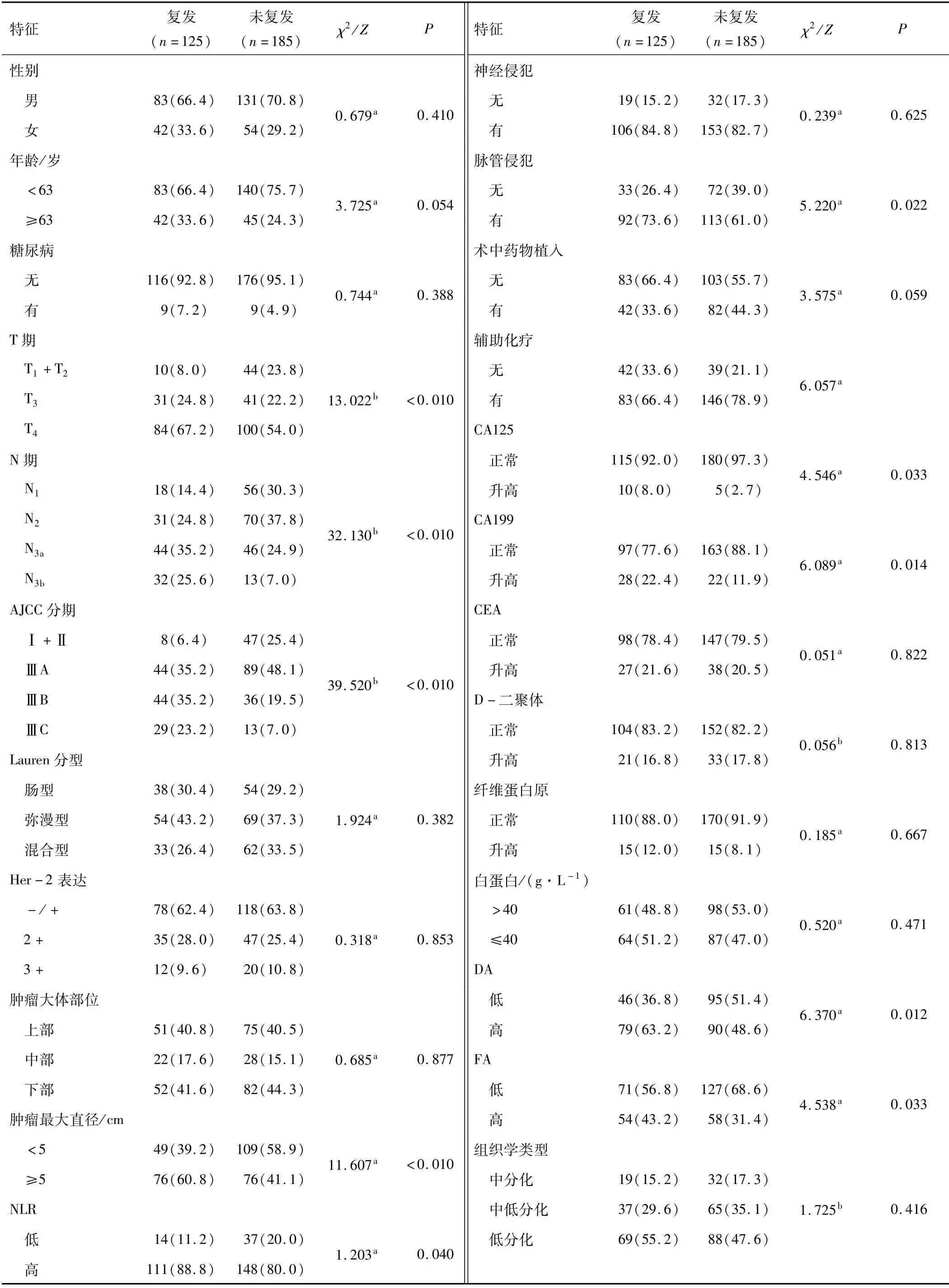
表1 临床病理特征[n(%)]
2.2 复发转移的多因素logistic回归分析把单因素分析中P<0.1的因素纳入多因素非条件logistic回归分析中去(考虑AJCC病理分期与T分期、N分期存在共线性后未纳入该因素),经过向前向后逐步回归法,显示年龄、肿瘤最大直径、T分期、N分期、辅助化疗、脉管侵犯、术中药物植入、CA199、DA、PLR与复发转移存在相关性,其中肿瘤最大直径5 cm及以上、较高的T分期和N分期、脉管侵犯、CA199升高是该人群复发转移的独立危险因素,辅助化疗是其独立保护因素。见表2。
2.3 多因素Cox回归分析先对所有因素进行单因素Cox分析,把其中有意义的因素纳入多因素分析中,同样经向前向后逐步回归法,表示年龄、肿瘤最大直径、T分期、N分期、辅助化疗、脉管侵犯、CA199与复发转移生存时间存在相关性。其中肿瘤最大直径5 cm及以上、T4期、N3a、N3b、脉管侵犯、CA199升高是该人群无复发转移生存时间的独立危险因素,辅助化疗是其独立保护因素。见表2。

表2 复发转移相关多因素logistic及Cox回归分析
2.4 按N分期进行分组分析各亚组复发率分别为24.3%、30.7%、48.9%、71.1%,随着N分期的上升呈升高趋势。在N1分组中,年龄、肿瘤最大直径、辅助化疗与无复发转移时间存在相关性。在N2组中,脉管侵犯、辅助化疗、CA199值、DA及FA比值是相关风险因素。在N3a组中,T4期、较高的分化程度、辅助化疗、肿瘤大小与无复发转移生存时间密切相关。是否辅助化疗及术中化疗药物植入、CA199值在N3b人群中可作为结局事件发生时间的独立风险因素。见表3。

表3 按N期分组的多因素Cox回归分析
2.5 Nomogram模型(列线图)的构建和评价通过多因素Cox回归模型中的危险因素构建列线图(图1),量化其对胃癌根治术后淋巴结阳性患者出现复发转移结局所占权重。通过一致性指数(C-index)进行评估模型,C-index为0.734(95% CI:0.687~0.773),显示良好的区分度和实际临床意义。应用Bootstrap法对该模型进行(b=1 000)内部检验,进一步绘制1、2、3 a的预测无复发生存率和实际无复发生存率的校准曲线(图2、3、4),以45°斜线表示预测效果最佳,分析Cox回归模型重采样前后性能,结果显示预测准确度良好,其中以2、3 a的RFS拟合更优。
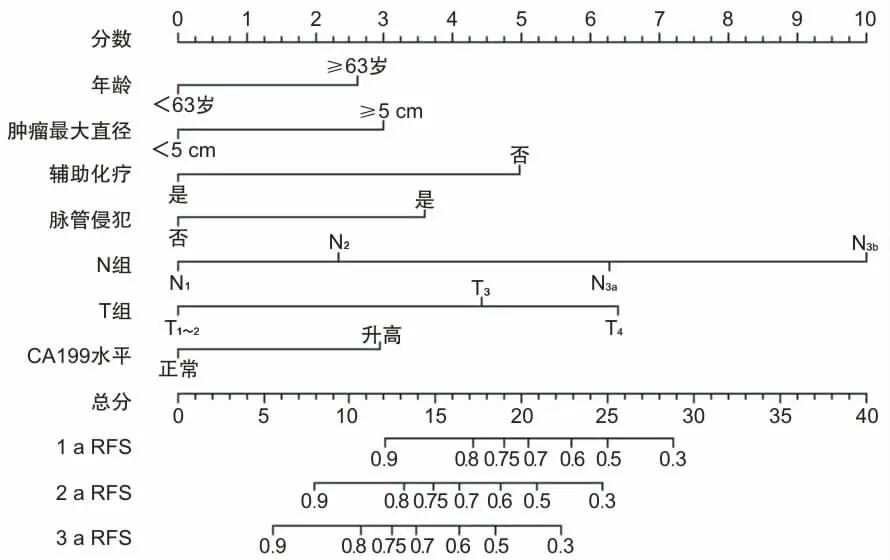
图1 复发转移的Nomogram预测模型
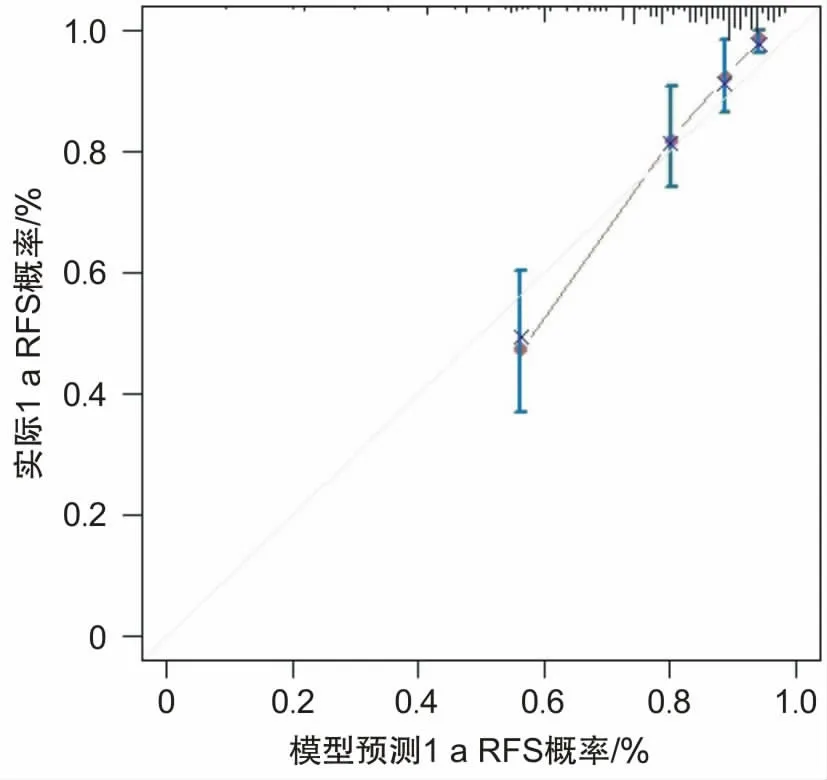
图2 预测1 a RFS与实际1 a RFS的校准图

图3 预测2 a RFS与实际2 a RFS的校准图
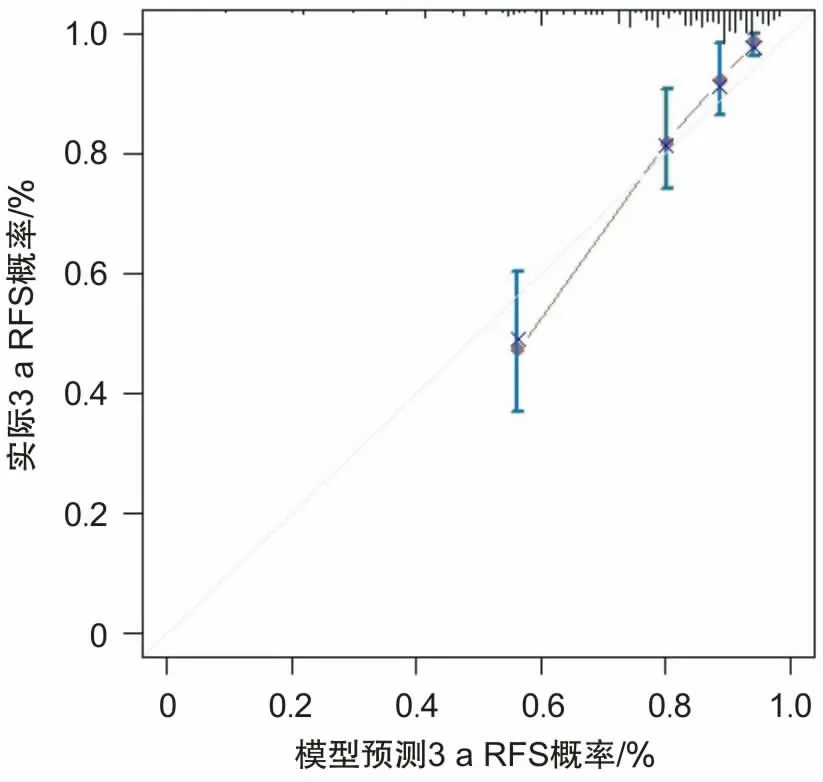
图4 预测3 a RFS与实际3 a RFS的校准图
3 讨论
本研究中所纳入人群均为胃癌根治术后病理示存在区域淋巴结转移的患者,其中肿瘤浸润深度(T期)、淋巴结转移个数(N期)、肿瘤最大直径、脉管侵犯、辅助化疗、术前CA199值与该人群复发转移及时间密切相关,将上述因素纳入构建列线图,使预测模型更为直观化,为临床医生评估病情和个体化方案的定制提供指导。此外,实际临床工作中该人群往往对自身疾病的期望值更高,尽早与患者沟通规范治疗所能得到的收益,使其更加积极治疗,从而延长生存时间。
胃癌术后发生复发或转移往往是导致治疗失败的重要原因,术后监测并及时地积极治疗对改善生存质量、延长生存时间具有重大临床意义。目前手术联合辅助化疗是胃癌规范诊疗体系中的重要环节[9]。即使在早期胃癌中,淋巴结转移阳性患者较未转移者相比,复发率更高,预后较差[4]。既往研究示淋巴结比和检查淋巴结数是胃癌预后的因素,且淋巴结比可能改善单纯数目分类所造成的分期迁移[5,10]。目前D2淋巴结清扫术成为可手术的进展期胃癌或伴淋巴结转移的早期胃癌的规范推荐术式。Songun等[11]研究示延长淋巴结切除术在降低局部区域复发率和预后方面有显著优势。在早期实际临床工作中,淋巴结比值预测生存期的益处在淋巴结检查有限的患者中实现最为客观[12]。也有研究显示一定的阴性淋巴结数目可能降低淋巴结微转移的风险[5],基于种种原因最终数目在规范的基础上存在数值差异,可能对淋巴结比值产生误差,所以继续采用淋巴结转移数目作为术后复发转移的因素研究也具有一定实际意义[12-13]。
本研究中有73.9%的患者接受了术后辅助化疗,以氟尿嘧啶类药物为基础的辅助化疗是复发转移的独立保护因素。一项大型随机开放试验CLASSIC表明在Ⅱ~ⅢB期胃癌术后患者中,奥沙利铂联合卡培他滨较对照组提高了无进展生存率[14]。Kim等[15]研究表明S-1单药与XELOX方案相比,后者在分期较高的胃癌患者中疗效优于前者,但二者在早期生存率方面无差异。Shitara等[16]研究示奥沙利铂联合替吉奥在术后辅助中也显示出较好的安全性和耐受性。新辅助化疗能降低肿瘤负荷和分期,提高机体对药物的敏感性和耐受性,增加R0切除率,为后续手术创造条件,并最终减缓复发并延长生存周期。虽然本研究中所有患者均未行新辅助治疗,但近些年新辅助治疗在消化道肿瘤中已经开展诸多临床试验,验证了其改善复发和生存的能力。MAGIC、COMPASS等几项研究均显示在可切除胃癌患者中新辅助方案的应用可显著改善预后,同时未增加术后并发症的发生[17-19]。在所有研究中,不同国家地区之间在胃癌手术的辅助治疗方面略有差异,可能与地区间标准治疗及淋巴结清扫方面不同有关。同样分子靶向药物(抗Her-2及VEGF通路)及免疫检查点抑制剂在胃癌治疗领域的应用日益更新。已有研究验证在晚期或转移性胃癌治疗中的实际临床效能[20],探究二者之间存在的潜在协同性,在肿瘤异质性、耐药性突变、免疫微环境、免疫原性等多方面各个击破,对胃癌根治术后复发患者提供更积极有效的方案。此外,未来需要更多结合靶向治疗或免疫治疗的大型随机队列继续进行研究分析,利于个体化选择药物,使患者得到更多的安全性和生存受益。
既往研究表示在胃癌的lauren分型中弥漫型在总体中具有较高特异性死亡风险,预后不良[21]。本研究显示该因素与总体的复发转移及预后无关,仅在分组分析时显示在N3a组人群中,肠型是该组复发转移的独立保护因素,发生风险比是弥漫型的0.10倍左右(95% CI:0.03~0.29)。原因可能是本研究总体样本量小,存在混杂偏倚、选择偏倚等,未来需要更大样本量的前瞻性研究再次进行验证分析。
本研究尚存在一定局限性,本研究属于单个中心回顾性研究,并且进行了一定的人群筛选,不可避免存在选择偏倚,可能对列线图的稳定性和预测效能产生一定影响,仍需要外部数据集进行验证。此外,本研究在辅助化疗因素中未按周期分组和方案具体分组,未能探讨该因素对结局的影响。
总之,胃癌根治术后淋巴结阳性患者存在较高复发风险,本研究所构建的复发转移Nomogram预测模型可能成为便捷方便的临床应用工具,其中多项指标容易获取,有助于快速筛查高危患者,从而采取个体化治疗及复查随访制度。
