陕西秦冠苹果苹果锤头类病毒分离物的分子特性研究*
2022-06-09袁彧伟孙平平付崇毅李正男
张 磊,袁彧伟,孙平平,付崇毅,马 强,李正男
(1 内蒙古农业大学园艺与植物保护学院,呼和浩特 010018)(2 内蒙古农牧业科学院蔬菜花卉研究所)
苹果是国际贸易中最重要的水果作物之一[1],在世界范围内广泛种植。我国的苹果种植面积和产量均是世界第一[2]。陕西省的关中和陕北部分地区是苹果的适栽区,目前已经发展成为我国最大的苹果生产区[3]。在陕西,苹果园多为农民自主经营的小型果园,农民为了降低生产成本,常常采用互换接穗的方式进行品种更新。随着种植年限增长、种植规模扩大,病毒、植原体、类病毒等嫁接传播病害在苹果上的积累也越来越多,给苹果产业的发展带来严重影响,造成了巨大的经济损失。
苹果锈果病在陕西省各苹果种植区均有发生,严重影响苹果的商品性,给苹果产业造成了巨大的经济损失。据报道,苹果锈果类病毒(apple scar skin viroid,ASSVd)是引起苹果锈果病的主要病原之一。ASSVd 属于马铃薯纺锤形块茎类病毒科(Pospiviroidae)苹果锈果类病毒属(Apscaviroid)[4],在世界范围内广泛发生。另外,2014 年在我国山东省表现锈果症状的富士苹果上检测到1 种类似于类病毒的RNA 分子,将其命名为似苹果锤头类病毒RNA(apple hammerhead viroid-like RNA,AHVd-like RNA)[5]。随后在加拿大的太平洋嘎拉(Pacific Gala)苹果上也发现了这个类病毒,并明确其为苹果锤头类病毒(apple hammerhead viroid,AHVd),是桃潜隐花叶类病毒属(Pelamoviroid)的新成员[6-7]。2018年,Szostek 等[8]对不同国家的苹果样品进行检测,在来自美国、日本、西班牙、新西兰、意大利的样品中均发现了AHVd,证明AHVd 在全球广泛分布。2019 年Sanderson 等[9]、Chiumenti 等[10]对加拿大和意大利不同品种的苹果样品进行检测,并分析了AHVd 的分子多样性,发现AHVd 的分子变异较大,但是其二级结构相对稳定。
本研究对采自陕西省的秦冠锈果样品进行类病毒诊断,明确引起陕西秦冠锈果病的病原种类及其分子特征,为预警和防控该病害提供依据。

苹果锈果病病果The fruits of apple scar skin symptom
1 材料与方法
1.1 试验材料
2019 年9 月,在陕西省渭南市潼关县秦东镇十里铺村的1 个苹果园内观察到了严重的锈果病,锈果病发病率为100%,并严重落果,落地果实也均表现为锈果(图版1)。为明确病原,随机选取10株发病的苹果树进行取样,各采集20 片叶片用于检测。采集的叶片用锡箔纸包裹,液氮速冻后,干冰快递至实验室,保存于-86 ℃冰箱中备用。以实验室保存的ASSVd 阳性金红苹果叶片作为阳性对照。
试验中使用的DH5α感受态细胞购自宝生物工程(大连)有限公司。KAPA Hifi HotStart Ready Mix PCR Kit 购自北京普凯瑞生物科技有限公司。克隆载体Zero Background pTOPO-TA Cloning Kit、琼脂糖凝胶回收试剂盒、高纯度质粒小量快速提取试剂盒均购自艾德莱生物技术有限公司。DL2000 Plus DNA Marker 购自近岸蛋白质科技有限公司。QIAGEN 无核糖核酸酶水购自上海慧颖生物科技有限 公 司 。Invitrogen SuperScript III Reverse Transcriptase Kit 购自Invitrogen 公司,内含5×First Strand Buffer、SuperSciptIII 反转录酶、0.1 mol/L DTT、10 mmol/L dNTPs 和RNA Inhibitor。引物由上海生工生物技术有限公司合成。
1.2 RNA 提取及反转录
参照Li 等[11]的方法,提取采集的苹果叶片样品和阳性对照样品总RNA,提取的总RNA 溶解于50 μL 无核糖核酸酶水中,测定浓度并检测完整性后保存于-86 ℃冰箱中备用。以提取的总RNA 为模板进行反转录:总RNA 1 μg 作为模板,随机引物(2 μmol/L)1 μL,无核糖核酸酶水补齐至13 μL,65 ℃5 min;再加入M-MLV 5×Reaction Buffer 4 μL、RNA Inhibitor 1 μL、dNTPs(10 mmol/L)1 μL、M-MLV反转录酶(200 U/μL)1 μL,总体积20 μL,42 ℃70 min,70 ℃15 min,所得cDNA 保存于-20 ℃备用。
1.3 类病毒全基因扩增
参照NCBI GenBank 数据库中ASSVd 和AHVd基因组序列,设计ASSVd 的检测引物对ASSVd-F(5′-GGTAAACACCGTGCGGTTC-3′)、ASSVd-R(5′-GGGAAACACCTATTGTGTTT-3′)和AHVd 的检测引物对AHVd-F(5′-GGAGTCTATTAGGCTCCC TGATG-3′)/AHVd-R(5′-GACCGTCACGGGGGTGT TAAAAC-3′)。以cDNA 为模板进行PCR 扩增,扩增程序为:94 ℃3 min 预变性;94 ℃30 s,56 ℃30 s,72 ℃30 s,共35 个循环;72 ℃2 min。PCR产物经1.2%琼脂糖凝胶电泳分离。
1.4 类病毒全基因克隆
使用DNA 凝胶回收试剂盒纯化回收目标基因组片段,将目标片段与pMD 18-T 载体连接后转化大肠杆菌DH5α感受态细胞。筛选阳性克隆提取质粒送至上海生工生物技术有限公司进行测序。
1.5 序列分析、系统发育分析、重组分析及二级结构预测
本试验获取了AHVd 陕西秦冠分离物全长序列,通过NCBI BLASTn(https://blast.ncbi.nlm.nih.g ov/Blast.cgi)进行同源序列检索。使用SDTv1.2 软件的MUSCLE 序列比对程序[12]将AHVd 基因序列与NCBI GenBank 中公布的其他71 个AHVd 全基因序列进行两两比对。利用MEGA 6.0 软件[13]构建系统发育进化树,建树方法为比邻法(neighbor-joining,NJ),自展校正值设定为1 000,阈值为50%。利用RDP 软件[14]的RDP、GENECONV、Bootscan、MaxC hi、Chimaera、SiScan 和3Seq 方法检测72 个AHVd全长基因组序列中的重组事件;各个检测方法的参数都设为默认值,勾选“线性序列”和“绝对复制”选项,同时P值设为P<10-5。有至少5 种方法检测到的重组事件被认定为显著重组事件。基于AHVd陕西秦冠分离物的基因组序列,利用RNA 二级结构在线预测工具RNA Folding Form(http://www.una fold.org/mfold/applications/rna-folding-form.php)[15]对其二级结构进行预测;RNA 序列选择环形,其他参数默认。
2 材料与方法
2.1 AHVd 全长序列扩增及序列分析
对采集的陕西秦冠锈果叶片样品进行ASSVd 和AHVd 检测。利用引物对ASSVd-F/-R 没有扩增到预期片段,但阳性对照获得了预期片段;利用引物对AHVd-F/-R 从2 份叶片样品中均扩增到了大小约430 bp 的预期片段。测序结果显示,从10 株发病秦冠苹果树采集的叶片样品中扩增到的片段序列一致性为100%,该序列在NCBI GenBank 的登录号为MT127883。NCBI BLASTn 检索到了71 个同源序列(表1),均为AHVd 基因组序列。AHVd 秦冠分离物基因组序列与该71 个序列的一致性为85.6%~95.6%,其中,与AHVd 中国富士分离物(GenBank 登录号为KR605506)的序列一致性最高,为95.6%;与意大利‘Agostinella’分离物(MH643697)和加拿大旭苹果分离物(MK188699)的一致性最低,为85.6%。以上结果表明采集的陕西秦冠锈果病与AHVd 侵染相关。

表1 72 个AHVd 分离物基因组序列及其相关信息
2.2 AHVd 系统发育及重组分析
根据现有的72 个AHVd 全基因组序列构建进化树,结果显示,现有的AHVd 株系可以被分为2 个组群(图1),其中,来源于意大利‘Agostinella’(MH643696~MH643711)与粉苹果(MH643712~MH643727)的分离物以及来源于加拿大的J-52分离物(MK188695)聚集在同一个组群;Szostek等[8]检测的西班牙、日本、意大利、美国等不同地区的分离物(MG662372~MG662376、MH049330~MH049331),Sanderson 等[9]从加拿大多个苹果品种上得到的分离物、Zhang 等[5]以及本研究获得的秦冠分离物聚集在另一个组群。这些AHVd 株系的聚类与其地理来源相关性不大,但是在同一苹果品种上获得的分离物亲缘关系较近。重组分析结果显示在72 个AHVd 分离物中并没有显著的重组事件发生。
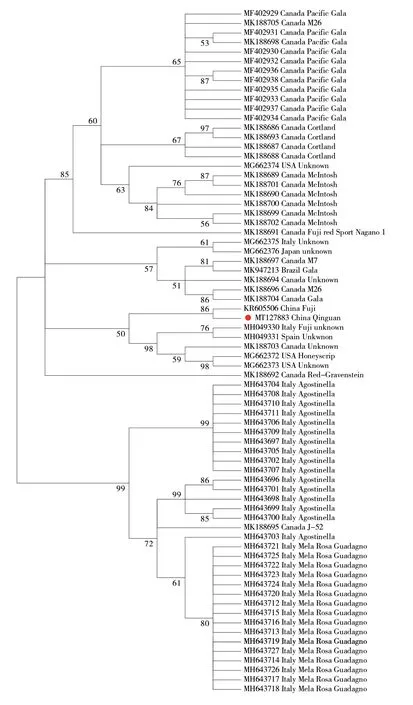
图1 基于72 个AHVd 分离物全长基因组序列构建的系统发育树
2.3 AHVd 二级结构预测
利用在线工具RNA Folding Form 对二级结构进行预测,AHVd 秦冠分离物为环形分子,一端为杆状,另一端包含多个分枝(图2-A);2 条极性链上都能形成锤头状核酶,并含有已知的13 个核苷酸残基保守区(图2-B)。另外,与AHVd 代表株系(KR605506)相比,AHVd 秦冠分离物(+)和(-)极性链上的核酶共有5 个碱基突变,但并未对核酶的二级结构产生影响。
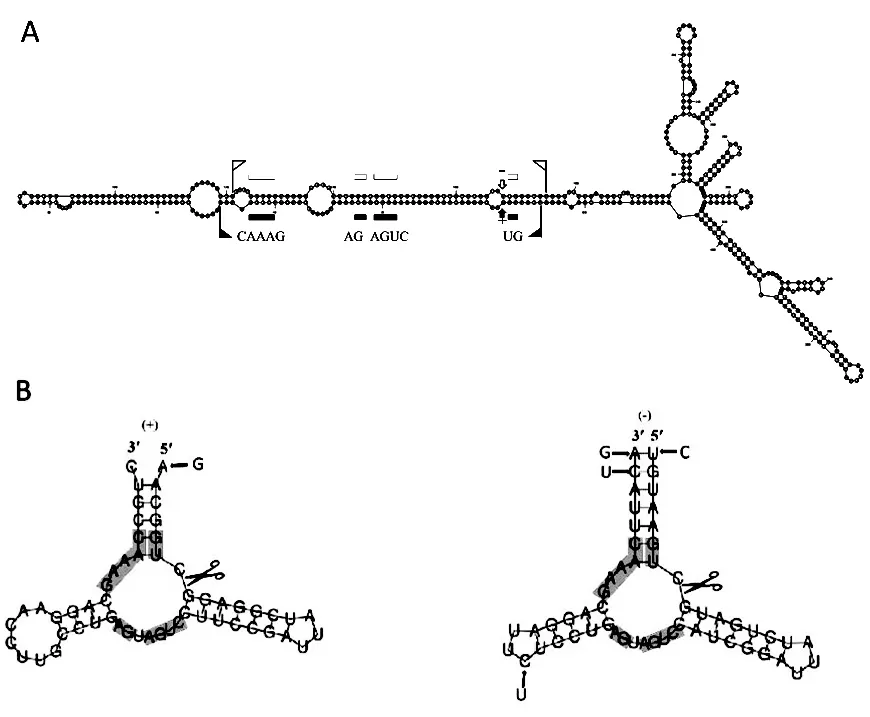
图2 预测的AHVd 秦冠分离物二级结构
3 讨论与结论
AHVd 秦冠分离物与中国富士上首次发现的AHVd(KR605506)一致性最高,表明在中国苹果种植区传播的AHVd 可能具有相近的来源,对此应当引起重视,这可能是国内苹果繁殖材料运输、交换等导致了AHVd 的传播。国外研究者发现AHVd和苹果茎沟病毒(ASGV)、苹果茎痘病毒(ASPV)、苹果褪绿叶斑病毒(ACLSV)、苹果绿皱果相关病毒(AGCaV)等复合侵染苹果,而且与其他病毒复合侵染时,可能会加速AHVd 的重组与分子进化[8]。考虑到ASGV 等病毒拥有广泛的蔷薇科寄主植物,应当警惕AHVd 寄主植物范围的扩大。
类病毒根据是否有中心保守区以及核酶活性分为鳄梨日斑类病毒科(Avsunviroidae)和马铃薯纺锤块茎类病毒科(Pospiviroidae)。而鳄梨日斑类病毒科成员的一个典型特征就是顺式作用的核酶自切割,通过对称的滚圈机制在叶绿体中复制,形成2 个极性的寡聚链[16]。AHVd 为鳄梨日斑类病毒科成员,其核酶由中心的保守区域和两侧被小环包被的短螺旋构成,当相应的茎环结构不被破坏时,即使发生碱基突变,也不会影响核酶的活性[7]。这一点,通过对AHVd 秦冠分离物的二级结构预测,也有体现。
AHVd 与陕西秦冠的锈果症状相关,并可能引起严重落果。本试验是继Zhang 等[5]首次发现AHVd之后,再次在中国苹果上检测到AHVd,为防控AHVd 引起的苹果病害奠定了理论基础。
