Nrf2在缺血性脑损伤中的关键性作用
2022-06-06朱健平李运曼
朱健平,李运曼
(中国药科大学基础医学与临床药学学院,江苏 南京 210009)
卒中是全球第二大死亡原因和第三大残疾原因,所带来的负担不断增长,形成了巨大的挑战,成为一个日益重要的公共卫生问题[1]。卒中伴随有复杂的病理生理过程:氧化应激、细胞凋亡、血-脑脊液屏障破坏和炎症。然而,有效的临床治疗方法仍然有限。临床上,缺血性脑卒中常见的治疗手段包括重组人组织纤溶酶原激活剂(recombinant human tissue plasminogen activator,rtPA)及机械取栓,通过快速恢复急性期缺血性脑卒中的血流,挽救受损脑组织,促进脑部功能恢复。然而,由于适应证和治疗窗狭窄(<4.5 h)及出血性转化的不良反应,超过 95% 患者无法从 rtPA 中获益[2-3]。此外,在脑卒中慢性期的恢复过程中仍缺乏有效的治疗手段。因此迫切需要靶向缺血性脑损伤中关键因子来开发新的治疗策略。核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是参与细胞和生物体防御过程的主要调节因子之一,通过协调多种细胞因子的表达对抗内源性和外源性应激。Nrf2被认为是氧化还原稳态的主要调节器,通过控制抗氧化响应元件(antioxidant response element,ARE)介导抗氧化反应。此外,Nrf2还有助于调节许多初级和次级代谢过程,因此,靶向 Nrf2 已成为预防和逆转缺血性脑卒中有吸引力的治疗策略。
1 Nrf2信号通路概述
1.1 Nrf2结构特征
Nrf2属于Cnc碱性亮氨酸拉链亚家族成员之一,由七个功能域组成,分别为Nrf2-ECH 同源域(Nrf2-ECH homology,Neh)1-7,具有不同的功能[4]。Neh1负责与肌肉腱膜纤维肉瘤癌基因(musculoaponeurotic fibrosarcoma oncogene,Maf)形成二聚体并结合到DNA的ARE序列。Neh2负责与Kelch 样 ECH 相关蛋白 1(Kelch-like ECH-associated protein 1,Keap1)结合,介导Nrf2的泛素化降解。Neh3 可能充当反式激活域。Neh5在Neh4的辅助下激活 Nrf2 靶基因转录。Neh6结构域独立于 Keap1,通过另一种负调节因子二聚体 β-转导重复相容蛋白(β-transducin repeat-containing protein,β-TrCP)介导Nrf2的抑制作用。β-TrCP 是一种支架蛋白,可将 Nrf2 与Cullin 1-ring-box1(Cul1-Rbx1)复合物结合以进行泛素化。Neh7 结构域通过促进 Nrf2与视黄酸 X 受体α(Retinoic X receptor α,RXRα)结合抑制Nrf2/ARE信号通路[5]。
1.2 Keap1/Nrf2/ARE 通路
Keap1是典型的Nrf2负调控因子。Keap1分为3个主要结构域,包括1个 Kelch 域、1个BTB域和1个IVR域。在静息状态下,Keap1 的两个分子形成同型二聚体,每个二聚体通过其 Kelch 结构域与Nrf2 结合[6]。Keap1的N端片段通过Cullin 3(Cul3)与E3泛素蛋白连接酶 ring-box1(Rbx1)结合。Nrf2 随后发生多聚泛素化及快速蛋白酶体降解[7]。相反,在应激状态下,暴露于氧化剂或亲电子试剂中,Keap1 发生构象变化并释放 Nrf2,当Nrf2 在细胞质中积聚与稳定后转移到细胞核中,通过Neh1 结构域与Maf 蛋白异二聚化后与 ARE 结合[8]。随后编码多种蛋白,参与机体的调节,包括解毒、抗氧化、抗感染、还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)再生和中间代谢。
Nrf2下游的细胞保护途径包括氧化还原平衡因子、解毒酶、应激反应蛋白和代谢酶,如血红素加氧酶-1(heme oxygenase-1,HO-1)、SOD、NADPH醌还原酶-1(NADPH quinone oxidoreductase-1,NQO-1)、NADPH、谷胱甘肽S-转移酶(Glutathione S-transferase,GST)、谷胱甘肽还原酶(Glutathione reductase,GSR)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)等[8-10]。其中,HO-1 催化血红素氧化为胆绿素、游离铁和一氧化碳[11],SOD 催化两个超氧阴离子自由基歧化为O2和H2O2,随后被过氧化氢酶、GSH-Px 和过氧化物还原酶(Peroxiredoxins,Prdxs)去除[12]。NQO-1利用 NADPH 作为电子供体催化各种醌和芳香族化合物的双电子还原[13]。
2 Nrf2在缺血性脑卒中后的关键作用
2.1 缺血性脑卒中期间Nrf2信号通路的动态表达
通常情况下,Nrf2 主要位于细胞质中,与 Keap1结合保持在较低的基础水平。然而,当细胞在缺血性脑卒中期间受到过度氧化刺激时,Nrf2 从 Keap1 中释放出来,转移到细胞核中,并与 ARE 序列结合,从而上调其靶基因表达(图1)。在永久性脑缺血(permanent middle cerebral artery occlusion,pMCAO)模型中,多项研究表明,响应于缺血的刺激,Nrf2信号通路在pMCAO后表达上升。Nrf2 mRNA 和蛋白质在缺血后 3 h开始上调,并在24 h于细胞核内达到峰值[14-15]。与Nrf2表达类似,Nrf2 下游抗氧化蛋白如 HO-1、NQO-1、SOD 和 GSH-Px1在pMCAO后24 h同样显著升高[16]。在脑缺血再灌注(cerebral ischemia/reperfusion,CI/R)发生后6~8 h即可检测到Nrf2蛋白表达升高[14,17-18],并且可以维持1~14 d[19-20]。此外,Nrf2下游抗氧化蛋白如HO-1、NQO-1等均表达上升[21-22]。
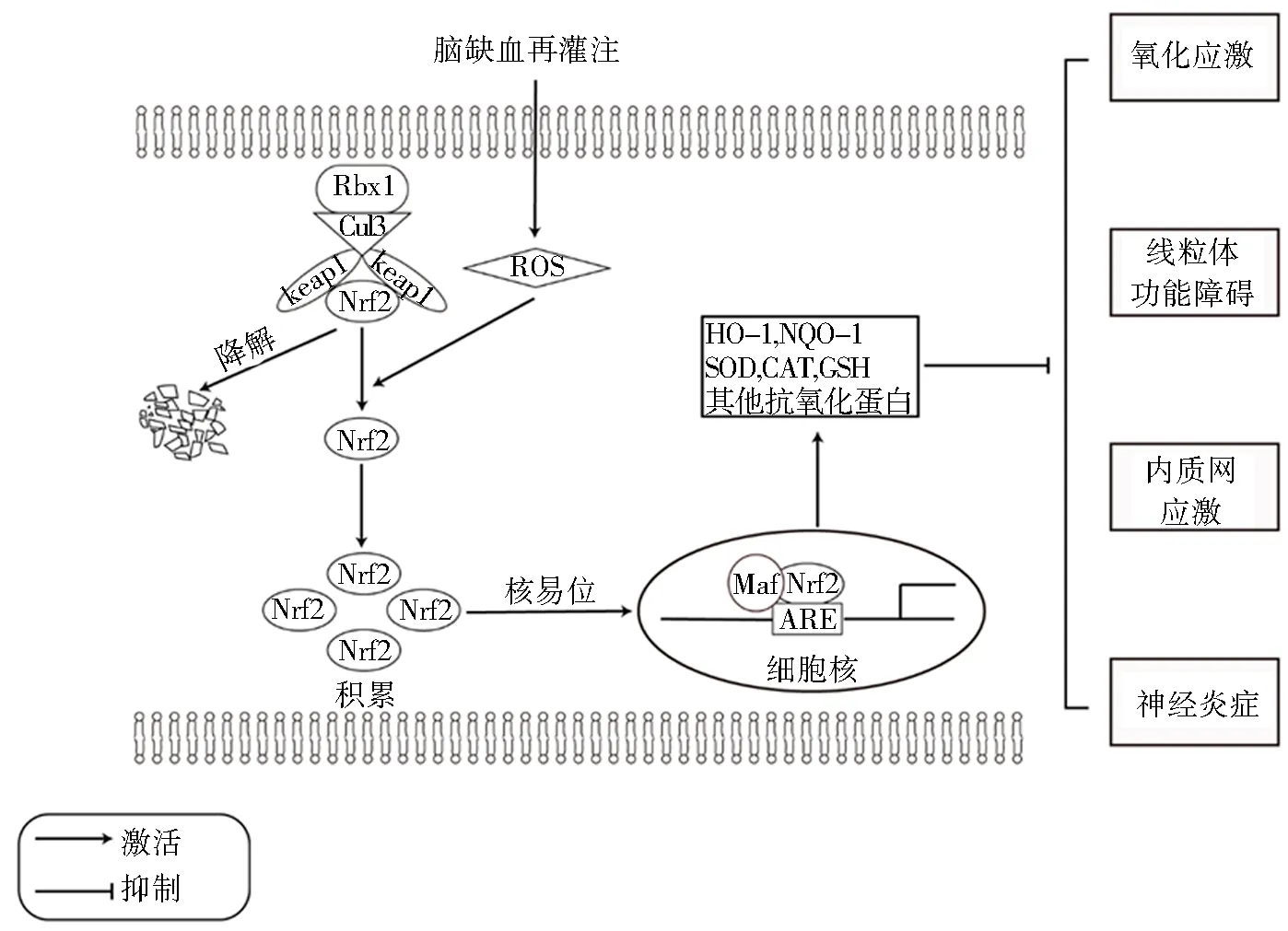
图1 Nrf2 在缺血性脑损伤中的病理生理作用
2.2 Nrf2 在缺血性脑损伤中的病理生理作用
Nrf2 信号通路通过调控广泛的细胞保护蛋白,抵抗不同的内源性和外源性损伤,为脑部疾病在内的各种疾病提供有希望的治疗靶点。大量临床前实验揭示了 Nrf2 通路在缺血性脑卒中的保护机制,包括针对缺血后的氧化应激、线粒体功能障碍、内质网应激和炎症反应等(图1)。
2.2.1 氧化应激
氧化应激是一种病理过程,当暴露于各种有害刺激时,活性氧(reactive oxygen species,ROS)的产生超过内源性抗氧化防御系统的清除能力。这种不平衡会导致氧化损伤的积累,包括脂质、蛋白质和核酸翻译后的错误修饰。由于富含脂质并且耗氧量高,大脑特别容易受到氧化损伤。CI/R引发一系列分子事件,其中涉及过量的 ROS 生成、线粒体功能障碍、NADPH 氧化酶(NADPH oxidases,Nox)激活和黄嘌呤氧化酶(xanthine oxidase,XO)激活。Nox促进电子从 NADPH 传输到 O2,从而产生超氧自由基阴离子。CI/R中的几种病理过程会促进 Nox 激活,例如兴奋性毒性、缓激肽释放、中性粒细胞募集、巨噬细胞/小胶质细胞激活和炎性转录因子的释放[23-24]。CI/R后细胞内 Ca2+积累促进XO激活,将次黄嘌呤氧化产生超氧自由基阴离子和过氧化氢。除了过量ROS生成外,缺血性脑卒中后 ROS 清除能力受到干扰,SODs、过氧化氢酶(catalases,CATs)、GSH-Px 和 GSH 在缺血性脑卒中动物模型中的表达显著降低。因此靶向Nrf2,激活下游抗氧化酶及相关细胞保护蛋白,是对抗CI/R后氧化应激损伤的关键。
Nrf2 充当多种基因的关键调节剂,例如 HO-1、NQO-1 和 GST,这些基因都参与对大脑中各种氧化损伤的细胞保护。Nrf2 破坏会抑制细胞抗氧化系统的能力,Nrf2 激动剂诱导的 NQO-1 升高在 Nrf2-/-小鼠中被消除[25]。同样Nrf2 的基因缺失消除了 HO-1 的上调并增加氧化应激损伤[26]。当 HO-1 表达受到抑制时,Nrf2 激动剂的保护作用减弱[27]。在细胞水平上,现有研究[28]表明,Nrf2 激活可能有益于神经元、星形胶质细胞、少突胶质细胞和小胶质细胞对氧化损伤的敏感性,推测这种治疗方法可能改善整个神经血管单元。
2.2.2 线粒体功能障碍
线粒体功能障碍作为缺血损伤的关键因素,受到相当多关注。炎症反应伴随代谢紊乱及线粒体形态变化,产生大量ROS,该过程主要由线粒体电子传递链的复合物Ⅰ和Ⅲ产生[29]。脑线粒体正常功能的破坏可能会导致严重的能量不足,引发神经元中 ROS 的产生并最终导致细胞死亡。Nrf2的激活可维持氧糖剥夺(oxygen and glucose deprivation,OGD)后线粒体超微结构的完整性,逆转了由 OGD 引起的神经元能量损失[30]。此外,Nrf2的诱导会抑制细胞内钙超载和线粒体膜电位的崩溃,增加抗凋亡蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的水平,并抑制Bcl-2 相关蛋白 X(Bcl-2 associated protein X,Bax)向线粒体易位,从而减弱线粒体中细胞色素 c 释放和下游 caspase 激活[31-32]。Akt/Nrf2 通路的雌激素受体依赖性激活在体外显示出对抗氧化应激的神经保护作用,其潜在机制可能是抑制线粒体膜电位破坏、caspase-3 激活和DNA断裂抑制缺血后的原代皮层神经元的细胞凋亡[33]。总之,Nrf2 是一种有效的途径,可通过脑缺血的多种机制解决线粒体功能障碍。
2.2.3 内质网应激
ROS 可能会减慢蛋白质的折叠速度,从而导致错误折叠和未折叠蛋白质在内质网腔内积累,这种情况称为内质网应激。在哺乳动物中,未折叠蛋白反应的信号传导由三个内质网跨膜蛋白传感器介导:激活转录因子6(activating transcription factor 6,ATF6)、肌醇需求酶1(inositol-requiring enzyme 1,IRE1)和蛋白激酶 R 样内质网激酶(protein kinase RNA-like ER kinase,PERK)[34]。此外,内质网应激调节促凋亡蛋白 C/EBP同源蛋白(C/EBP homologous protein,CHOP)和 抗凋亡蛋白Bcl-2 的表达。诱导Nrf2信号通路显著改善了 MCAO 后Bcl-2 表达,抑制p-PERK/PERK、p-IRE1α/IRE1α 和 CHOP 表达。这些结果表明,促进Nrf2表达减轻了CI/R后内质网应激[35-36]。自噬受体p62/ZIP 可以将错误折叠的蛋白质运输到自噬-溶酶体系统进行降解,并且 p62/ZIP 和 Nrf2 之间存在正反馈回路。在CI/R损伤过程中,p62/ZIP 不仅在自噬过程中清除蛋白质聚集体,而且可能通过 Keap1/Nrf2/ARE 信号通路参与自噬调节及ROS清除,发挥预防氧化损伤和减轻内质网应激的作用[37]。这些发现表明内质网应激与Keap1/Nrf2 通路之间可能存在联系。靶向内质网相关蛋白是探索未来脑缺血临床治疗策略或新药的潜在有价值的方法。
2.2.4 神经炎症
炎症是脑血管疾病,尤其是缺血性卒中的病理生理学的关键步骤。许多研究表明,缺血后神经炎症是影响缺血长期预后的重要因素。CI/R后,炎症反应是由多种因素引发的,例如 ROS 形成、坏死细胞和受损组织。这些因素会引起炎症细胞激活。小胶质细胞介导的神经炎症在缺血性卒中等多种神经系统疾病的病理生理过程中起至关重要的作用。与野生型小鼠相比,Nrf2 敲除小鼠梗死体积、炎症损伤和神经功能缺损均有所增加[38]。通过增加小胶质细胞的 Nrf2信号通路表达来减弱细胞炎症可能在脑缺血的神经保护中发挥作用,Nrf2激活会促进CI/R后小胶质细胞向抗感染的M2型极化[39]。核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)是最具代表性的炎症小体,已成为CI/R后备受关注的研究方向。细胞焦亡是一种不同于坏死和凋亡的程序性细胞死亡,NLRP3的活化会引发CI/R后的细胞焦亡,促进脑组织内IL-1β及IL-18的表达。Keap1/Nrf2通路通过抑制 ROS/TXNIP/NLRP3轴,防止CI/R 诱导的神经元焦亡[40]。此外,Nrf2通过抑制脑内小胶质细胞中的 NLRP3 炎性小体的激活减轻脑缺血后的炎性损伤[41]。近些年来,大量实验正在评估生理和病理生理条件背后 Nrf2 和 NF-κB 之间的相互作用,以更好地了解靶向治疗的方法。值得注意的是,Nrf2 激活通过抑制 NOX4/ROS/NF-κB 通路,在体外和体内减弱了氧化应激、神经元凋亡和神经炎症对CI/R 损伤的影响[42]。
3 Nrf2调节剂对缺血性脑卒中的作用
鉴于 Nrf2 在氧化还原平衡中的关键作用,一些研究报告了其在生理或病理条件下参与调节细胞稳态。在缺血性脑卒中的背景下,除了CI/R后 Nrf2 的内源性激活所表现出的保护作用,外源诱导的 Nrf2 激活产生的保护作用也有报道(表1)。

表1 治疗缺血性脑卒中的化合物及机制
3.1 姜黄素对Nrf2的调节作用
姜黄素是一种从姜黄根茎中提取的化学物质,具有多种生物活性,包括抗氧化和抗感染特性。姜黄素通过烷基化Keap1/Nrf2 结合复合物上的蛋白质硫醇,使 Nrf2 易位至细胞核以启动抗氧化基因表达变化。体内和体外证据[43]表明,姜黄素是 Nrf2 在CI/R 损伤中的有效激活剂,其保护作用是由于 NF-κB 表达降低和 Nrf2 上调。此外,姜黄素主要代谢产物六氢姜黄素,可减少神经功能缺损、神经元变性和梗死体积。与之前对姜黄素的研究一致,六氢姜黄素也发挥抗氧化和抗感染作用,六氢姜黄素还显著增加了细胞核内 Nrf2蛋白表达、HO-1表达、SOD 活性[44]。
3.2 白藜芦醇对Nrf2的调节作用
白藜芦醇(3,4,5-三羟基芪)是一种多酚化合物,大量存在于葡萄和红酒中,具有抗氧化、抗感染和抗细胞凋亡特性。体外和体内证据表明,白藜芦醇的神经保护作用部分是由于其能够激活 Keap1/Nrf2 通路,进而调节炎症介质和抗氧化酶表达。体外实验表明,白藜芦醇对 Nrf2/ARE 通路的激活促进了 HO-1 活性以及谷胱甘肽和 SOD 水平增加,增强细胞抗氧化防御能力,从而保护 PC12 细胞免受氧化应激[45]。体内实验表明,白藜芦醇预处理在CI/R后上调 Nrf2 表达并增加 HO-1 水平,在Nrf2-/-小鼠中,白藜芦醇介导的神经保护作用被抑制,表明白藜芦醇的神经保护及抗氧化活性至少部分是由 Nrf2/ARE 通路激活介导的[46]。
3.3 萝卜硫素对Nrf2的调节作用
萝卜硫素是一种天然异硫氰酸酯,广泛存在于甘蓝、西兰花和其他十字花科蔬菜中。有证据表明它也具有神经保护作用。萝卜硫素介导的 Nrf2 通路激活诱导抗氧化和解毒酶表达,如GST、HO-1 和 NQO-1,进而在神经保护中发挥关键作用。暴露于OGD后,萝卜硫素通过激活 Nrf2 通路提高星形胶质细胞存活率[47]。在大鼠MCAO模型中,萝卜硫素处理显著升高星形胶质细胞及血管内皮细胞内的Nrf2/HO-1的表达,进而保护血-脑脊液屏障的完整性[48]。
3.4 富马酸二甲酯对Nrf2的调节作用
富马酸二甲酯是富马酸的二甲酯衍生物,被美国食品药品监督管理局批准用于治疗多发性硬化症及银屑病。富马酸二甲酯具有多种生物效应,包括抗氧化应激、抗凋亡和免疫调节特性,并在各种组织中提供微血管功能保护。富马酸二甲酯治疗给药或预处理后可诱导Nrf2 的激活和抗氧化活性,减少CI/R后梗死体积,减轻海马 CA1 区神经元损失,但在Nrf2-/-小鼠中,DMF预处理无法改善加剧的缺血性损伤和恶化的反应性神经胶质增生[49-50]。
4 结语与展望
总之,本综述明确阐述了外源性诱导的 Nrf2 激活在缺血性脑卒中后的神经保护作用,通过激活Nrf2,引发一系列靶基因转录,包括 HO-1、NQO-1 和 GST。此后,这些细胞保护蛋白减轻脑缺血后氧化应激,改善线粒体功能障碍,减轻内质网应激,并拮抗中枢神经系统的神经炎症。Nrf2 调节剂可能代表在不久的将来治疗缺血性脑卒中患者有希望的药理学策略。
