重组Bt伴胞晶体蛋白Cry5B对大熊猫西氏贝蛔虫的离体杀灭活性观察
2022-06-06黄文俊罗娌陈欣刘礼廖礼慧王小兰李碧李明喜陈敏易得娇李翰张皓卓贵富刘云健李莹馨陈奕君周璇谢跃
黄文俊 罗娌 陈欣 刘礼 廖礼慧 王小兰李碧 李明喜 陈敏 易得娇 李翰 张皓卓贵富 刘云健 李莹馨 陈奕君 周璇 谢跃*
(1 成都大熊猫繁育研究基地兽医院,成都 610081)(2 四川农业大学动物医学院,温江 611130)
大熊猫(Ailuropoda melanoleuca) 是中国特有的珍稀濒危物种,西氏贝蛔虫(Baylisascaris schroederi) 是大熊猫体内最为常见的一种肠道寄生线虫,可引起大熊猫营养不良、消瘦、贫血,甚至死亡(Zhanget al.,2008;杨光友和张志和,2013;Wanget al.,2018;Qinet al.,2021)。虫卵经口感染大熊猫后,幼虫在肠道孵出,经血液循环移行于肝、肺、胰腺等脏器,诱发“内脏幼虫移行症(VLM)”,造成严重的肠损伤及蠕虫型肝炎、肺炎及胰腺炎。成虫寄生于大熊猫的小肠内,可引起肠道炎症、肠堵塞,甚至发生致死性肠破裂,对野生和圈养大熊猫的生存和健康影响极大(杨光友和张志和,2013;Wanget al., 2018)。2020 年最新流行病学调查结果显示,野生大熊猫的西氏贝蛔虫感染率为100%;甚至在人工圈养条件下,蛔虫感染率也可达25%以上,且难以根除。目前几乎所有大熊猫和小熊猫的圈养保护中心或动物园均有西氏贝蛔虫感染的记录或报道(Liet al., 2020;Zhuet al.,2020)。药物驱虫是控制圈养大熊猫西氏贝蛔虫病的主要措施(杨光友和张志和,2013;Xieet al., 2013;熊浪等,2019)。然而由于缺乏对大熊猫西氏贝蛔虫的足够认识,药物治疗往往出现两个极端:一是用药过量,即在日常饲喂中反复添加驱虫药;二是用药不足,即很多保护中心或动物园忽视对大熊猫西氏贝蛔虫病这种隐性消耗性疾病的控制,只是机械地套用陈旧的驱虫方案,致使药效不足,驱虫效果不佳。加之,蛔虫繁殖力强、产卵数量多,虫卵在外界环境长期存活,造成宿主重新感染(Wanget al., 2018)。现有的对策就是进一步加大投药密度,这无疑加快了耐药蛔虫株的出现,同时也造成了驱虫药环境残留和生态污染等问题。在这样背景下,我们亟待寻求新的大熊猫西氏贝蛔虫病治疗和防控方法。
苏力菌(Bacillus thuringiensis, Bt) 晶体蛋白是菌体孢子生殖所产生的一种伴孢子蛋白,对脊椎动物无毒,而对昆虫等无脊椎动物却具有高效的杀虫活性(Hu and Aroian, 2012; Sanderet al.,2020)。重要的是,该蛋白易被环境降解,绿色环保,因此是一种理想的新型驱虫药物候选。目前有关Bt晶体蛋白的杀虫研究多限于农业植物害虫,相比Bt 晶体蛋白在动物疾病如寄生虫病防控方面则研究较少。新近,国外学者研究发现,Bt 晶体蛋白对动物寄生虫病也颇具治疗效果(Huet al.,2013; Durmazet al., 2015; Dementievet al., 2016)。大量研究证实,Bt 晶体蛋白(如Cry5B 和Cry21A)可有效抑制或杀灭动物肠道线虫如锡兰钩虫(Ancylostoma ceylanicum) (Huet al., 2012, 2018b)、粪类圆线虫(Strongyloides stercoralis) (Charuchaibovornet al., 2019)、多形螺旋线虫(Heligmosomoides polygyrus) (Durmazet al., 2015) 和捻转血矛线虫(Haemonchus contortus) (Sanderet al., 2020)。大熊猫西氏贝蛔虫亦属肠道线虫,且与锡兰钩虫和捻转血矛线虫类似,寄生于宿主小肠内。有研究证实Bt晶体蛋白Cry5B 对猪蛔虫(Ascaris suum)表现致死(Urbanet al.,2013,2021),揭示Cry5B 可能是一种潜在的防控蛔虫病药物候选。鉴于大熊猫西氏贝蛔虫与猪蛔虫同为蛔科种类,且二者无论在生活史还是宿主危害上均存在一致性;同时Bt天然Cry5B蛋白产量有限,无法满足后续生产需要,本研究拟采用基因克隆和原核表达方式产生重组Cry5B 蛋白,并检测其对大熊猫西氏贝蛔虫的离体杀灭活性,为论证该重组蛋白可以作为一种新型、环保的抗大熊猫西氏贝蛔虫病药物提供了数据参考。
1 研究方法
1.1 实验材料
新鲜大熊猫西氏贝蛔虫成虫及肠道L4 期幼虫活体由成都大熊猫繁育研究基地提供。虫体取自2021 年10 月基地野外救助的1 只雌性大熊猫个体,年龄约17 岁,体重70 kg。虫体经温生理盐水洗涤后,37℃过夜培养于含青霉素—链霉素—两性霉素B (三抗) 的Hanks 平衡盐溶液(HBSS) (Solarbio)。感受态细胞Escherichia coli DH5α 和BL21 (DE3) 菌株购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 BtCry5B基因序列的合成、克隆与序列分析
根据GenBank 公布的Bt YBT-1518Cry5B基因序列(GenBank Accesion no. EU121521.1),运用在线工具GENSCAN (https://www.genes.mit.edu/GENSCAN.html)获取其完整开放阅读框(ORF),然后分别在5′和3′端加入含BamHI和HindIII酶切位点及其保护性碱基,得到的嵌合序列提交生工生物工程(上海) 股份有限公司进行合成。合成序列插入pMD19-T (Promega) 进行TA 克隆和测序分析。序列经SignalP (https://services.healthtech.dtu.dk/service.php?SignalP-5.0) 信号肽预测以及TMHMM(https://services. healthtech. dtu. dk/service. php?TMHMM-2.0) 跨膜结构域分析后,使用BLAST P(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM =blastp&PAGE_TYPE = BlastSearch&LINK_LOC = blasthome) 预测Cry5B 蛋白保守结构域,使用DNAStar 对不同Bt 株源Cry5B基因编码核酸区序列进行一致性评估;MEGA 进行多序列比对,构建基因系统进化树,并计算序列遗传距离。
1.2.2 BtCry5B基因的原核表达与纯化
提取克隆质粒,BamHI和HindIII(TaKaRa) 双酶切,连入pET-32a(+)(Promega),构建pET-32a-Cry5B 原核表达载体。表达载体经双酶切鉴定阳性重组质粒送上海Invitrogen 公司进行再次测序,验证其读码框的正确性。将正确表达质粒转入原核表达BL21 (DE3),接种于含Amp 的LB 平板,37℃过夜培养16 h,挑取单个阳性菌落,接种于含Amp LB 液体培养基中,37℃振摇培养2 ~3 h,在菌液浓度到达OD450 = 0.5 时,加入IPTG (Promega) 至终浓度分别为0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L、1.4 mmol/L、1.6 mmol/L、1.8 mmol/L、2.0 mmol/L 后继续振摇培养6 h。分别吸取1 mL 培养液,10 000 r/min 离心10 min,收获菌体沉淀,用PBS 洗3 次,用1 × 上样buffer 处理,100℃水浴10 min,SDS-PAGE 检测Cry5B 蛋白表达。按最佳条件大量诱导表达重组蛋白,经超声裂解后,离心取上清和沉淀进行蛋白可溶性分析,Cry5B 主要表达于上清。使用BioRad 公司5 mL Ni 离子亲和层析柱,进行上清重组Cry5B 蛋白亲和纯化,BSA 法测定纯化蛋白浓度。
1.2.3 重组Bt Cry5B蛋白的离体杀虫活性评价
将纯化重组Cry5B 蛋白进行倍比稀释,以pET-32a 空载表达菌纯化产物为对照,分别评价不同浓度Cry5B 蛋白对大熊猫蛔虫成虫和L4 期幼虫的杀灭活性,并测定其半数致死有效剂量(Median effective dose, ED50)。具体操作:大熊猫蛔虫L4期幼虫按照每孔6条的比例培养,在24孔细胞板中分别加入浓度为0 µg/mL (对照组)、1 µg/mL、10 µg/mL 和100 µg/mL 的Cry5B 蛋白,37℃培 养7 d,计算各浓度处理下的Cry5B ED50,每个浓度设3 次重复。大熊猫成虫按照每瓶3 条的比例培养,在500 mL 烧瓶中分别加入浓度为0 µg/mL(对 照 组)、10 µg/mL 和100 µg/mL 的Cry5B 蛋白,37℃培养7 d,计算不同浓度处理下的Cry5B ED50,每个浓度设3 次重复。期间每天更换培养液。虫体活力评分标准(Urbanet al.,2013):与对照组虫体活力相似,3 分;与对照组比,虫体活力降低,2 分;需要刺激虫体才表现运动,1 分;刺激虫体仍无任何运动,0分。
1.2.4 数据分析
重组Bt Cry5B 蛋白离体杀虫活性评价数据均以平均值±标准差(mean±SD)表示。数据分析使用SPSS 22.0 统计软件,采用单因素方差分析(One-way ANOVA) 检验组间差异,使用最小显著差数法(LSD)作两两比较分析。P<0.05 即判断为组间差异显著,置信区间设为95%。
2 结果
2.1 Bt Cry5B基因生物信息学分析
合成的Bt YBT-1518Cry5B基因完整ORF 长度为3 738 bp,编码1 246 个氨基酸,分子量(MW)为139.889 kD,理论等电点(pI)为5.18(图1)。信号肽和跨膜结构预测显示,Cry5B蛋白不含信号肽和跨膜区。BLAST P 检索Cry5B 蛋白保守结构域,结果表明:Cry5B 蛋白包含Endotoxin_N 结构域(91-327aa, E-value = 4.73e-11)、δ-Endotoxin_C 结构域(554-695aa, E-value = 2.04e-23)、Endotoxin_C 结构域(562-695aa,E-value=1.68e-28)、Endotoxin_C2 结 构 域 (758-827aa, E-value = 3.25e-04)、Cry1Ac_D5结构域(827-986aa,E-value=8.87e-21)。DNAStar 序列一致分析显示,Bt YBT-1518 与Bt PS86Q3 (U19725.1)、Bt zjfc85 (JQ821366.1)、Bt Sbt003(HM461869.1)、Bt DB27(KF771886.1)、Bt LBIT-107 (MF893204.1)、Bt DB27 (KF771886.1)、Bt ARP258(KC156687.1)和Bt Sbt072(JF521578.1)晶体蛋白的序列一致性分别为99.84%、99.76%、88.66%、68.39%、67.65% 和66.85%。Bt YBT-1518 Cry5B 与其他31 种株源的晶体蛋白系统进化分析如图2 所示,结果表明,32 种晶体蛋白同系物聚为3 大类,其中Bt YBT-1518 Cry5B 与Bt PS86Q3、Bt zjfc85 和Bt Sbt003 同系物聚为一类,且与Bt PS86Q3同系物关系最近。
2.2 重组Bt Cry5B蛋白的表达与纯化
将重组阳性质粒pET-32a-Cry5B转入E. coliBL21,在不同IPTG浓度(0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L、1.4 mmol/L、1.6 mmol/L、1.8 mmol/L、2.0 mmol/L) 诱 导6 h 后, SDSPAGE 电泳检测目的蛋白表达(图3)。与空载和未诱导组相比,不同浓度组的IPTG 均可诱导重组pET-32a-Cry5B表达菌产生与预期大小一致的目的蛋白条带(约159 kDa,含标签蛋白~20 kDa;图3),证实Bt YBT-1518Cry5B基因可在BL21中成功表达。同时显示,在IPTG 浓度为1.4 mmol/L 时,重组Cry5B蛋白的表达量达到最大。按照该最佳条件大量诱导表达目的蛋白,并做超声裂解处理,重组Cry5B 蛋白主要表达于上清(图3)。使用Ni离子亲和层析柱对上清中的重组Cry5B 蛋白进行纯化,BSA法测定其浓度为5 mg/L。
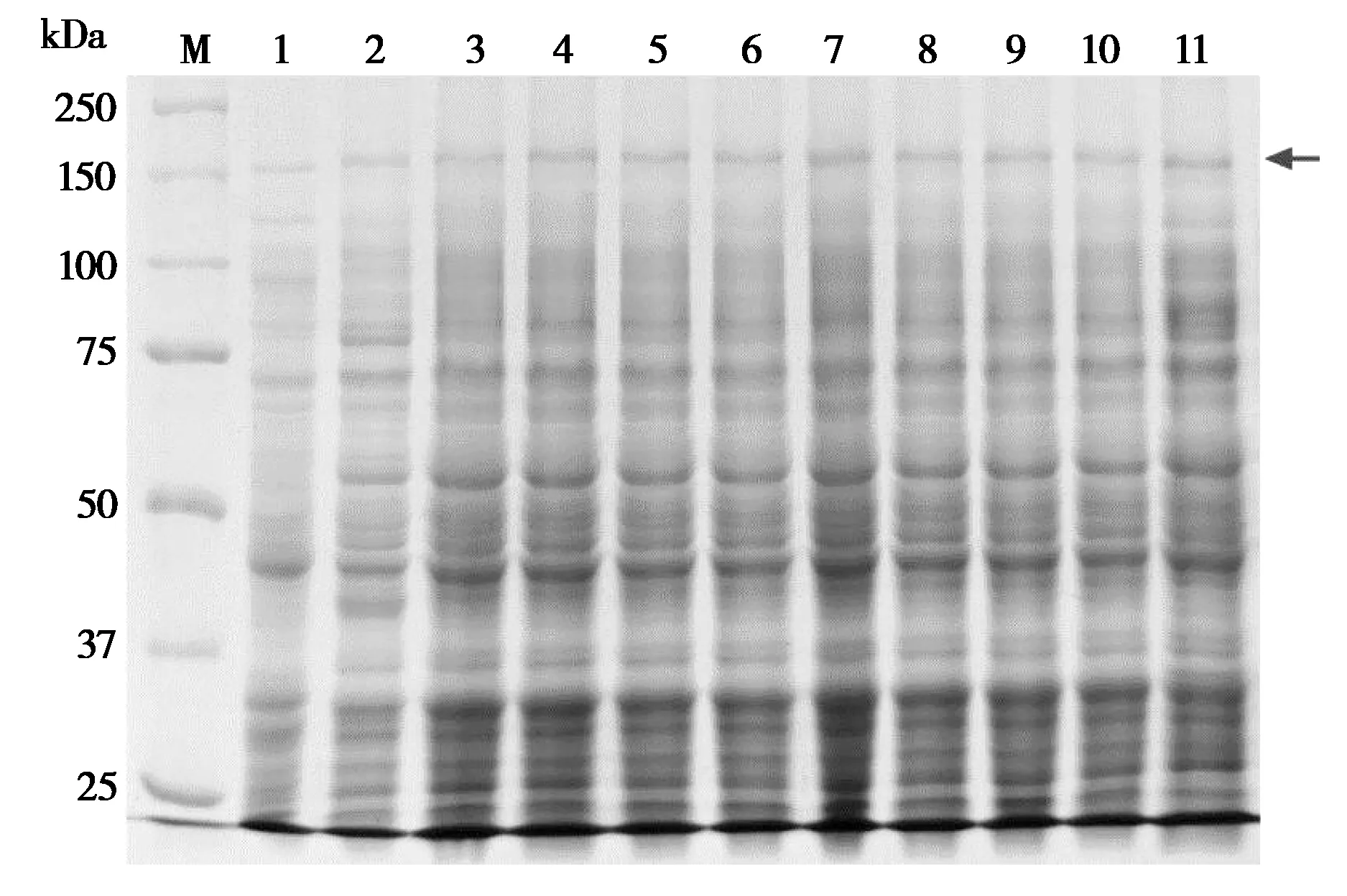
图3 重组Bt YBT-1518 Cry5B 蛋白的SDS-PAGE 分析. M:蛋白Marker;1:IPTG 诱导pET-32a (+) 空载组;2:未经IPTG诱导pET-32a-Cry5B 组;3 ~10:不同IPTG 浓度(0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L、1.4 mmol/L、1.6 mmol/L、1.8 mmol/L、2.0 mmol/L)诱导pET-32a-Cry5B 组;11:IPTG 诱导pET-32a-Cry5B表达菌的裂解上清液. 箭头标识目的蛋白Fig. 3 SDS-PAGE analysis of the recombinant Cry5B of the Bt YBT-1518. M: protein marker; lane 1: IPTG-induced pET-32a (+) group;lane 2: IPTG negative pET-32a-Cry5B group; lanes 3-10: IPTG-induced pET-32a-Cry5B groups under different concentrations including 0.6 mmol/L, 0.8 mmol/L, 1.0 mmol/L, 1.2 mmol/L, 1.4 mmol/L,1.6 mmol/L, 1.8 mmol/L and 2.0 mmol/L; lane 11: the supernatant sample of the IPTG-induced pET-32a-Cry5B group. The red arrow indicates the location of the recombinant Cry5B-specific band
2.3 重组Bt Cry5B对大熊猫蛔虫的离体毒力评价
不同浓度重组Cry5B蛋白在相同时间条件下对大熊猫蛔虫L4 期幼虫的毒力如图4 所示。随着培养时间的推移,大熊猫蛔虫L4 期幼虫中毒反应表现出对重组Cry5B 蛋白显著的剂量依赖性,其第3天的ED50值为14.5µg/mL(95%置信区间0.57 ~1.23),第5天的ED50值为1.3µg/mL(95%置信区间0.05 ~0.78),第7天的ED50值为0.16µg/mL(95%置信区间0.05 ~0.78)(图4A)。处理组与对照组从第2 天开始,差异显著(P<0.05)。相较L4 期幼虫,成虫对重组Cry5B蛋白似乎更敏感,更易出现中毒症状(图4B)。在接触重组Cry5B蛋白第2天,实验组虫体活力就显著下降,具体体现为100 µg/mL 浓度组虫体基本不动(指数评分1),10 µg/mL 浓度组虫体活动减慢(指数评分2),而对照组虫体却充满活力(指数评分3)(图4B)。在接触重组Cry5B蛋白的第5 天,100 µg/mL 浓度组虫体全部死亡(多次触摸均未移动);10µg/mL 浓度组中2 条虫体死亡(多次触摸均未移动),1 条虫体仅在触摸时移动(指数评分1);对照组虫体仍较健康,2 条虫体与先前活性相似(指数评分3),1 条虫体活力降低(指数评分2),处理组与对照组差异极显著(P<0.01)。这些结果表明,重组Cry5B 蛋白对大熊猫蛔虫L4期幼虫和成虫均具有较强的毒杀作用。
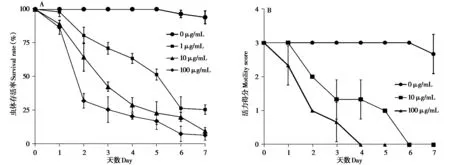
图4 重组Bt Cry5B对大熊猫蛔虫L4期幼虫(A)和成虫(B)的离体毒力评价.A:在不同重组Cry5B蛋白浓度(0µg/mL、1µg/mL、10µg/mL和100µg/mL)作用下每日对大熊猫蛔虫L4期幼虫(每组n=6)的存活率百分比进行评分.B:在不同重组Cry5B蛋白浓度(0µg/mL、10µg/mL和100µg/mL)作用下每日对大熊猫蛔虫成虫(每组n=3)的平均活力进行评分. 运动指数如方法中所定义. 数据为3次重复试验结果,以平均值±标准差表示Fig. 4 Intoxication evaluation of the recombinant Cry5B against fourth-stage larvae (A) and adults (B) of the panda Baylisascaris schroederi in vitro. A: The % alive (motile) of fourth-stage larvae (n = 6) of the panda B. schroederi scored on a daily basis at various doses of Cry5B (0 µg/mL, 1 µg/mL, 10 µg/mL and 100 µg/mL). B:Average motility index score of adults (n = 3) of the panda B. schroederi exposed various doses of Cry5B (0 µg/mL, 10 µg/mL and 100 µg/mL) scored on a daily basis. Motility index is as defined in Methods. Pooled data from three repeated experiments are presented as mean ± SD
3 讨论
西氏贝蛔虫病是危害野生和圈养大熊猫最为严重的一种肠道寄生虫病,可引起大熊猫出现营养不良、消瘦,甚至死亡(Zhanget al., 2008;杨光友和张志和,2013;Wanget al.,2018;Qinet al.,2021)。临床上常用的驱虫药物包括伊维菌素和双羟萘酸噻嘧啶(杨光友和张志和,2013;Xieet al.,2013;熊浪等,2019)。李德生等(2015)对上述两种驱虫药物的临床治愈效果评价结果显示,伊维菌素处理的大熊猫西氏贝蛔虫虫卵转阴率为0 ~44%,双羟萘酸噻嘧啶处理的虫卵转阴率为80%,均低于“兽药注册技术要求国际协调合作组织(VICH)”标准(≥90%) (Vercruysse and Claerebout,2001),证实大熊猫蛔虫对两种驱虫药物,尤其是对伊维菌素具有明显的耐药性。因此研发一种更为可靠、有效且环保的新型驱虫方法十分必要和迫切。Bt 伴胞晶体蛋白对多种昆虫及动植物寄生线虫具有专性的杀灭活性,对人畜无毒、环境无害,可用于各类农林害虫和动物寄生线虫病防控。本研究运用克隆与原核表达技术产生Bt YBT-1518重组晶体蛋白Cry5B,并首次证明了该重组蛋白对大熊猫西氏贝蛔虫L4 期幼虫和成虫均具有毒杀作用。
Urban等(2013)证实Bt天然Cry5B蛋白可以有效抑杀猪蛔虫L4 期幼虫和成虫,并促进虫体的排出。同时,研究人员还从猪蛔虫体内鉴定出Cry5B的作用靶点,即糖脂受体(Huiet al., 2012; Huet al.,2018a)。相比Bt 天然Cry5B 蛋白,本研究获得的重组蛋白表现出类似蛔虫毒杀作用,在一定程度上证实了重组蛋白具有与天然蛋白相似的结构,且大熊猫西氏贝蛔虫与猪蛔虫可能存在相似的Cry5B 作用受体。研究表明,Cry5B 结合受体主要为 磷 酸 胆 碱 糖 脂Gal(β1-3)Gal(α1-3)GalNAc(β1-4)[PC-6]GlcNAc(β1-3)Man(β1-4)Glc(β1-1),该蛋白在线虫中十分保守,且已在自由生秀丽隐杆线虫(Caenorhabditis eleqans) 和寄生线虫如锡兰钩口线虫(Ancylostoma ceylanicus)、猪蛔虫(Ascaris suum) 和人蛔虫(Ascaris umbricoides) 中被证实(Friealet al., 2003; Griffittset al., 2005; Rietet al.,2006; Urbanet al., 2013)。然而大熊猫西氏贝蛔虫是否也是这样,仍待后续研究确证。另外,我们发现大熊猫西氏贝蛔虫对重组Cry5B蛋白的毒性具有明显的剂量依赖性,随着作用剂量的增大,无论成虫还是幼虫的死亡率均相应增加,但成虫似乎更敏感。如在浓度10 µg/mL 处理的第2 天,所有成虫均出现显著的活动降低现象,相反却仅约50%的幼虫呈现中毒现象。我们推测这可能与不同发育阶段虫体本身含Cry5B 结合受体的数量有关;同时我们也怀疑重组Cry5B蛋白的毒性作用可能是在蛔虫食入该蛋白之后产生。正如昆虫等无脊椎动物的研究表明,Bt 晶体蛋白被虫体吞食后,其可在虫体肠道被酶解消化形成活性片段,这些活性片段将与肠道上高丰度分布的碱性磷酸酶(ALP)和氨肽酶N(APN)结合,进行富集,富集的活性片段进一步与钙粘蛋白(CAD)结合,引发Bt晶体蛋白结构域Domain I中α-1 螺旋的剪切,剪切后的Bt 晶体蛋白将增强与ALP 和APN 受体的结合,进而插入胞膜形成孔洞,致使细胞代谢失衡、裂解,虫体死亡(王莉等,2006)。因此,相比大熊猫蛔虫肠道L4 期幼虫,在相同处理时间,成虫可能食入的重组Cry5B蛋白数量更多,因而其展现的中毒症状更明显。
鉴于大熊猫本身的物种特殊性,本文未能进行重组Cry5B 蛋白体内治疗大熊猫蛔虫病的研究。在天然Bt Cry5B 蛋白作用猪蛔虫的在体试验中,研究人员发现,患病猪在口服一定剂量的Cry5B蛋白(20 mg/kg BW,两次) 之后,其肠道L4 期幼虫的驱杀率可高达97% (Urbanet al., 2013)。同时由于蛔虫L4 期幼虫在营养代谢上与成虫相似,因此Cry5B 蛋白理应对蛔虫成虫具有类似的驱杀效果,可能存在的唯一差异就是Cry5B蛋白的使用剂量及给药频率。总之,考虑到Bt 晶体蛋白对脊椎动物无毒,仅对无脊椎动物具有高效的杀虫活性,且易被环境降解,绿色环保,因此在获得相关伦理和试验许可的前提下,结合重组Cry5B蛋白在其他动物(包括熊) 体内试验的剂量和疗程优化,我们进行该重组蛋白的大熊猫蛔虫病在体治疗试验指日可待。综上所述,本研究证实重组Cry5B蛋白对大熊猫西氏贝蛔虫具有较强的毒杀作用,该结果为后续论证Bt YBT-1518 重组Cry5B 蛋白可以作为一种新型、环保的抗大熊猫西氏贝蛔虫病药物提供了数据参考,并在一定程度上为将来应用重组Cry5B蛋白防控大熊猫蛔虫病奠定了基础,丰富了大熊猫保护生物学的内容。
