花生对非繁殖期雌性黑线仓鼠细胞免疫和血液指标的影响
2022-06-06于祎赵明星王玉辉张学英徐德立王德华
于祎 赵明星 王玉辉 张学英 徐德立* 王德华,3*
(1 曲阜师范大学生命科学学院,曲阜 273165)(2 中国科学院动物研究所,农业虫害鼠害综合治理研究国家重点实验室,北京 100101)(3 山东大学生命科学学院,青岛 266237)
免疫系统能防御环境中病原体如病毒、细菌、真菌等对动物的攻击,对动物的生存发挥重要作用,是适合度的重要组分(Sheldon and Verhulst, 1996;徐德立和王德华,2012)。动物的免疫能力受多种因素如季节(张志强和王德华,2006;Xuet al.,2018;徐德立等,2021)、光周期(Nelson and Demas,1996)、温度(Xuet al.,2017)、食物(Xu and Wang,2010,2011)等的影响,其中食物的数量和质量是影响动物免疫功能的重要因素之一(陈竞峰等,2007;徐德立和王德华,2015)。
营养不良会损害人和动物的免疫能力,这可能是由于能量和(或)营养成分摄入不足引起(Calder and Kew, 2002; Kaminogawa and Nanno, 2004),例如能量缺乏如禁食(Lordet al., 1998; Nakamuraet al., 2001, 2004) 或限食(Demas and Nelson, 1998;Bilbo and Nelson, 2004;徐德立和徐来祥,2015)都会抑制动物的免疫功能。同样营养过剩和(或)能量摄入过多会抑制免疫能力(Calder and Kew,2002;Amaret al., 2007),例如高脂和(或) 高糖食物会抑制大鼠的天然免疫和体液免疫(陈轶楠等,2020;葛林等,2020;徐肖元等,2020)。有关食物质量对野生动物免疫功能影响的研究较少,例如高蛋白食物不影响长爪沙鼠(Meriones unguiculatus)胸腺、脾脏湿重以及体液免疫能力(陈竞峰等,2007)。因此,有必要在更多野生物种中开展食物质量或种类在其免疫功能中作用的研究,以深化对动物食物选择生理机制的认识。
植物血球凝集素(Phytohaemagglutinin, PHA)反应常用来评估哺乳动物的细胞免疫能力,主要负责控制细胞内病原体(de Bellocqet al., 2006;Zhang and Zhao, 2015)。血液中细胞种类、数量和成分的变化可用来检测动物的免疫功能和健康状况(张志强,2015;Xuet al.,2017),例如白细胞和淋巴细胞能直接参与机体的免疫反应,可指示动物的健康状况(Calder and Kew, 2002; Xu and Hu,2020),红细胞、血红蛋白浓度和红细胞压积能反映动物的输氧能力(Harikrishnanet al., 2011; Kim and Kang,2016;Fazioet al.,2016)。
黑线仓鼠(Cricetulus barabensis) 主要分布于中国北方,在蒙古国、俄罗斯和朝鲜也有分布(张知彬和王祖望,1998),食性杂,独居,不冬眠,具有贮食行为(赵志军,2012; Zhaoet al., 2014)。黑线仓鼠的天然免疫、细胞和体液免疫能力与血液指标均存在季节变化(Xuet al., 2018; Xu and Hu, 2020;徐德立等,2021),并且与季节相关的光周期、温度和食物数量均会影响其免疫功能(徐德立和徐来祥,2015; Xuet al., 2017; Xu and Hu,2017),而不同繁殖状态包括非繁殖期、妊娠期、哺乳期和断乳期的雌性黑线仓鼠,其细胞免疫能力无差异(张志强等,2015)。食物的种类和数量会随季节而变化,秋季黑线仓鼠常以农田里的花生为食,这是因为该物种对食物的选择偏好明显,尤其喜食花生(王淑卿等,1992;杨玉平等,2002)。作为黑线仓鼠的喜食食物,除了适口性和味道外,是否有其他因素影响其食物选择?在野外条件下,黑线仓鼠是否会优先选择有利于自身健康的食物?为探讨这一问题,我们用花生饲喂黑线仓鼠,然后检测反映健康状况的免疫学指标和血液指标,并预测饲喂花生会增强黑线仓鼠的免疫能力。
1 研究方法
1.1 实验设计
实验动物为野生非繁殖期雌性黑线仓鼠,秋季捕获于山东省曲阜市九仙山,单笼(30 cm ×15 cm×20 cm)饲养于光周期为12 L∶12 D、温度为(21±1)℃的环境,自由取食和饮水,饲养大约2个月后体重稳定,将30只雌鼠随机分为正常饲料组(normal fodder group,NF,n=10)、花生加饲料组(normal fodder plus peanuts group,NP,n=10)和花生组(Peanut,n=10)。正常饲料(北京科澳协力饲料有限公司)主要含有粗脂肪4.0%、粗蛋白18.0%、粗纤维5.0%、水分10.0%、氨基酸7.7%、维生素0.01%、金属离子4.0%,能值为14.4 kJ/g;花生主要含有脂肪44.3%、蛋白质24.8%、碳水化合物21.7%、粗纤维5.5%、水分9.0%、氨基酸7.1%、维生素3.9%、金属离子1.3%、多不饱和脂肪酸16.3%,能值为24.03 kJ/g。花生加饲料组为正常饲料和花生按1∶1(W∶W)比例投喂,处理时间为39 d。Day 0和Dayn分别代表处理第0天和第n天,每3 d于09:00—10:00测量体重和摄食量,电子天平精确度为0.1 g,每只动物每3 d投喂30 g食物,每日摄食量为(30 g-3 d后剩余食物)/3。
1.2 细胞免疫功能的测定
将植物血球凝集素(Phytohaemagglutinin,PHA)注射到动物足垫中部,可诱导T 淋巴细胞的增殖反应并引起足垫肿胀,肿胀程度越大,即PHA反应越大,表明T细胞增殖能力越强,因此,PHA反应可反映哺乳动物细胞免疫功能(de Bellocqet al., 2006; Xu and Wang, 2010)。在Day 35,用数显电子测微尺(Mitutoyo Absolute cod. 547-301,日本) 测量3 组黑线仓鼠左后足足垫的厚度(精确至± 0.01 mm),后用75%的酒精对左后足足垫进行消毒,在足垫中心处注射30 μL 含0.1 mg PHA(PHA-P,Sigma L-8754)的无菌PBS缓冲液(pH值7.4),分别在6 h、12 h、24 h和48 h 后测量左后足足垫厚度,每只动物测量6次,平均值即为足垫厚度,为减少误差,测量时由同一个人操作。PHA反应=(注射后足垫厚度-注射前足垫厚度)/注射前足垫厚度(Xu and Wang,2010;Xu and Hu,2017)。
1.3 血液指标
血液指标同样能反映动物的健康状况(Harikrishnanet al., 2011; Fazioet al., 2016; Kim and Kang,2016;Xu and Hu,2020)。在Day 34 用异氟烷(山东利诺制药有限公司) 轻度麻醉,眼眶后窦取血(约100 μL),迅速取20 µL 血液,用4 mL 血细胞分析稀释液(含氯化钠、硫酸钠、缓冲剂、抗菌剂、防腐剂) 进行稀释,全自动血液细胞分析仪(DYMIND UN73) 检测红细胞数、血红蛋白浓度、白细胞数、淋巴细胞数、血小板数等血液指标(Xuet al.,2018;Xu and Hu,2020)。
1.4 统计分析方法
用SPSS 18.0软件包对所有数据进行统计分析,数据分析前,用Kolmogorov-Smirnov进行正态性检验,所有数据均符合正态分布。PHA反应用反正弦转化后进行分析,采用重复测量(Repeated measures)的方差方法分析体重、摄食量和PHA反应的时间变化及组间差异,每个时间点的体重、摄食量、PHA 反应以及所有血液指标均采用单因素方差(One-way ANOVA)和Tukey’s post hoc 检验进行分析,利用皮尔逊相关分析(Pearson correlation analysis)检测PHA反应与血液指标之间的相关关系。统计结果用平均值±标准误(mean±SE)表示,其中P<0.05表示统计学差异显著,P<0.01表示统计学差异极显著,P<0.001表示统计学差异极其显著。
2 结果
2.1 体重
实验开始前,NP、NF 和Peanut 组黑线仓鼠的体重没有显著差异(Day 0:F2,27= 0.005,P=0.995),但 在Day 15 (F2,27= 3.437,P= 0.047)、Day 18 (F2,27= 4.529,P= 0.020)、Day 24 (F2,27=3.547,P= 0.043)、Day 27 (F2,27= 3.546,P=0.043) 和Day 30 (F2,27= 4.246,P= 0.025) 的体重组间差异显著,其他时间点则没有显著差异(图1)。

图1 饲喂花生对雌性黑线仓鼠体重的影响. NF:正常饲料组;NP:花生加饲料组;Peanut:花生组. *表示组间差异显著Fig. 1 Effect of feeding peanut on body mass in female striped hamsters. NF: normal fodder group; NP: normal fodder plus peanuts group; Peanut: peanut group. * indicates significant differences between groups
2.2 摄食量
黑线仓鼠摄食量在Day 3 (F2,27= 0.579,P=0.567)和Day 39(F2,27=1.852,P=0.176)3组间没有显著性差异,但Peanut组和NP组的摄食量从Day 6 (F2,27= 13.436,P<0.001) 至Day 36 (F2,27=11.108,P<0.001),均显著低于NF组(图2)。
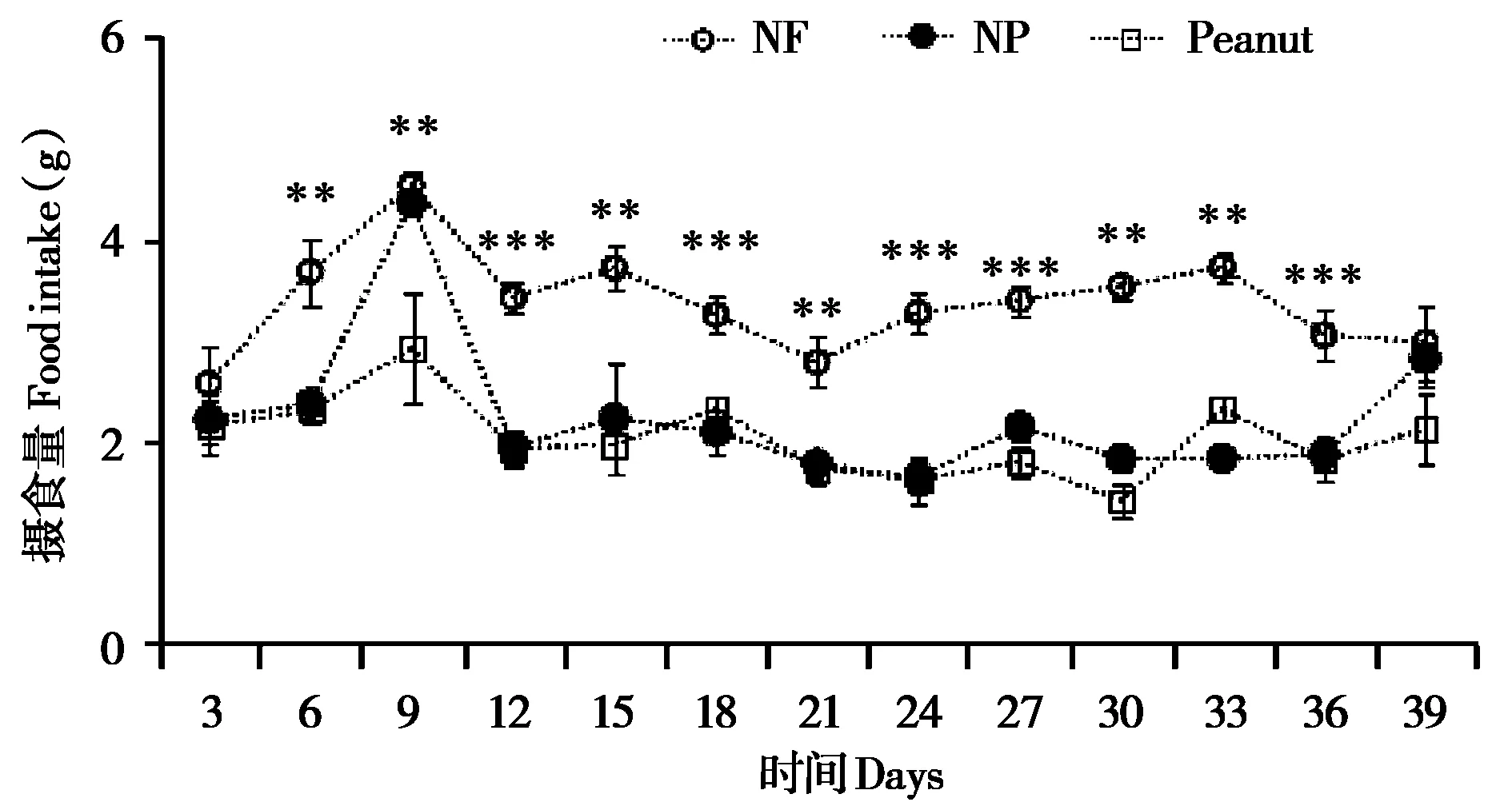
图2 饲喂花生对雌性黑线仓鼠摄食量的影响. NF:正常饲料组;NP:花生加饲料组;Peanut:花生组. **P <0.01,***P <0.001Fig. 2 Effect of feeding peanut on food intake in female striped hamsters. NF: normal fodder group; NP: normal fodder plus peanuts group;Peanut:peanut group. **P <0.01,***P <0.001
2.3 细胞免疫反应
PHA 反应随注射PHA 溶液后的时间延长而降低(F1,27=472.636,P<0.001),但不受时间与分组之间交互作用的影响(F2,27= 1.307,P= 0.287);NF 组(F1,9= 100.447,P<0.001)、NP 组(F1,9=239.215,P<0.001) 和Peanut 组(F1,9= 181.001,P<0.001)最大PHA 反应为注射PHA 后6 h(图3)。NP 组PHA 注 射 后12 h 高 于NF 组(F2,27= 3.372,P= 0.049),而PHA 注射后6 h (F2,27= 1.379,P=0.269)、PHA 注射后24 h (F2,27= 1.782,P= 0.187)以及PHA注射后48 h(F2,27=0.373,P=0.692)在3组间均无显著差异(图3)。

图3 饲喂花生对雌性黑线仓鼠PHA反应的影响. 柱子上方不同字母代表组间差异显著. NF:正常饲料组;NP:花生加饲料组;Peanut:花生组Fig. 3 Effect of feeding peanut on PHA response in female striped hamsters. Different letters above the columns indicate significant differences at the level of P <0.05. NF: normal fodder group; NP: normal fodder plus peanuts group;Peanut:peanut group
2.4 血液指标
与NF组相比,NP组和Peanut组红细胞(RBC)和红细胞压积(PCV) 显著增加,Peanut 组的血小板(PLT)高于NF与NP组(表1);白细胞(WBC)和淋巴细胞(LYMF) 在3 组间没有显著差异,但NP组 和Peanut 组WBC 比NF 组 分 别 高22.9% 和25.0%,LYMF 分别高15.0%和22.5% (表1)。其他血液指标包括红细胞平均体积(MCV)、红细胞分布宽度(RDW)、血红蛋白浓度(HGB)、平均血红蛋白量(MCH)、平均血红蛋白浓度(MCHC) 和淋巴细胞比率(LYMF%)在3 组之间均无显著差异(表1)。相关性分析表明,PHA注射6 h与PLT数和LYMF%呈负相关,PHA 注射24 h 与LYMF%呈负相关,而PHA 注射12 h和24 h与RBC数和PCV呈正相关(表2)。

表1 饲喂花生对雌性黑线仓鼠血液指标的影响Table 1 Effect of feeding peanut on hematological indices in female striped hamsters

?
3 讨论
饲喂花生增加了黑线仓鼠的体重,但降低了摄食量,这可能与花生脂肪含量和能值比正常饲料高有关。许多研究发现,高脂食物能增加人和动物的体重(Conway and Rene, 2004; Lamaset al.,2004;Amaret al., 2007),也有研究发现高脂食物不影响动物体重,但降低了摄食量(毕中强等,2018)。本研究的不足在于没有区分花生加饲料组中黑线仓鼠摄入的花生与正常饲料的量,因而无法确定其能量摄入。
与预测一致,花生加饲料组注射PHA 12 h 反应显著高于正常饲料组,而单纯饲喂花生组与正常饲料组PHA 反应无差异,这些结果表明在正常饲料的基础上添加饲喂花生能提高黑线仓鼠的细胞免疫能力,这可能与花生含有丰富的维生素、必需氨基酸、必需脂肪酸以及多种微量元素等有关(李立等,2013;张慧文等,2015;刘宝军等,2019)。食物中的营养成分是影响人和动物免疫能力的重要因素,营养不良会损害免疫系统,从而导致宿主感染风险增加,这可能是由于能量摄入和食物营养成分(包括糖、脂肪和蛋白质) 以及某些特定的微量营养成分摄入不足引起(Calder and Kew, 2002; Kaminogawa and Nanno, 2004; Westerterp-Plantengaet al., 2012)。例如禁食会抑制实验室小鼠和大鼠(Lordet al., 1998; Nakamuraet al.,2001, 2004) 以及野生长爪沙鼠(Xu and Wang,2010;徐德立和王德华,2015) 的细胞免疫能力,限食同样会抑制动物如黑线仓鼠的体液免疫(徐德立和徐来祥,2015)、拉布拉多白足鼠(Peromyscus maniculatus) (Demas and Nelson, 1998) 和黑线毛足鼠(Phodopus sungorus) (Bilbo and Nelson, 2004) 的细胞免疫能力。许多研究发现营养成分包括必需氨基酸、必需脂肪酸、维生素(Vitamin,V)(如VA、VB6、VC和VE) 和微量元素(如Zn、Cu、Fe 和Se)对于维持免疫系统的正常功能至关重要(Calder and Kew, 2002; Kaminogawa and Nanno, 2004)。VE可通过抗氧化和清除自由基的作用增强免疫功能,例如衰老小鼠食物中添加VE后细胞免疫功能增加(Meydaniet al.,1986;Meydaniet al.,1997),Zn 缺乏会损害多种免疫反应(Fraker and King, 1998),而补充Zn 能增强小鼠的细胞免疫能力(Shankar and Prasad, 1998)。本研究中,单独饲喂花生组与正常饲料组的细胞免疫功能没有差异,与正常饲料相比,花生含有较多的脂肪、蛋白质以及维生素,这一结果表明不同营养成分按不同比例混合的食物可能对免疫反应的作用相似。综上可见,多种营养成分均会影响动物的免疫能力,但究竟花生中的哪些营养成分或者不同营养成分按什么比例混合增加了黑线仓鼠的细胞免疫能力,还需要进一步的研究。
与预测不同的是,WBC、LYMF 和LYMF%在正常饲料组、花生加饲料组和花生组之间差异不显著,但花生加饲料组和花生组WBC 比正常饲料组分别高22.9%和25.0%,LYMF分别高15.0%和22.5%,这些结果暗示饲喂花生可能促进了白细胞以及淋巴细胞的增殖。注射PHA 6 h、PHA 12 h、PHA 24 h、PHA 48 h 与血液中WBC 以及LYMF不存在相关性,但LYMF%与注射PHA 6 h和PHA 24 h呈显著负相关,这些结果表明在黑线仓鼠左后足足垫中心部位注射PHA 溶液后,作为抗原,PHA一方面可能刺激了T淋巴细胞的增殖反应,另一方面也可能会诱导血液中的淋巴细胞迁移到PHA 注射部位,从而导致足垫肿胀。Zhang 和Zhao(2015)的研究发现黑线仓鼠左后足足垫中心部位注射PHA 发生的肿胀反应主要与T 淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞增殖或聚集有关。
花生加饲料组和花生组的RBC 和PCV 均高于正常饲料组,表明饲喂花生增加了黑线仓鼠运输氧气的能力,这可能是因为花生比正常饲料含有更高蛋白质、维生素和微量元素等营养成分(孙中瑞和封海胜,1986;刘丽娜等,2009),它们可能更有利于红细胞的产生。此外,注射PHA 12 h 与RBC 和PCV 呈正相关,暗示动物具有较强输氧能力,可能有助于提高其细胞免疫功能。Peanut 组PLT显著高于NF组和NP组,表明花生具有增强凝血的作用,这可能与摄入的花生种皮有关。许多研究发现,花生种皮能增加血小板数目(刘宝军等,2019;高雅婷和张永军,2020)。花生种皮中含有白藜芦醇、单宁酸、原花色素等成分(Udenigweet al., 2008),至于哪种成分促进了血小板增殖,还需要进一步的研究。
总之,饲喂花生增加了黑线仓鼠的体重,但其摄食量降低。正常饲料中添加花生能增强黑线仓鼠的细胞免疫功能,暗示其清除细胞内病原体的能力可能增加。饲喂花生增加了黑线仓鼠RBC和PCV,表明花生具有增强动物输氧能力的作用。虽然饲喂花生不影响黑线仓鼠WBC 和LYMF,但花生加饲料组和花生组的WBC 和LYMF 比正常饲料组高,暗示花生可能具有促进WBC 和LYMF 增殖的作用。花生组PLT高于正常饲料组,说明花生可能具有增强凝血的作用。以上这些结果表明,饲喂花生能提高黑线仓鼠的健康水平。可见,在选择食物时,除适口性和味道外,黑线仓鼠会选择有利于健康的食物——花生,由于花生营养成分复杂多样,至于哪种营养成分能增加免疫功能,还需要深入研究。
