牦牛DBI基因的分子特征及其在乳腺组织中的表达与定位
2022-06-06王强龙张同享高泽川王立斌余四九潘阳阳
王强龙 张同享 高泽川 王立斌 余四九 潘阳阳
(甘肃农业大学动物医学院,甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
地西泮结合抑制因子(Diazepam binding inhibitor,DBI)在细胞内负责酰基辅酶A 的转运和储存,进而调节脂肪酸的合成与代谢,因此又称为酰基辅酶A 结合蛋白(Acyl-CoA binding protain, ACBP)(Rosendalet al., 1993)。在人体中,DBI 是Acyl-CoA 结合结构域(acyl-CoA-binding domain-containing, ACBD) 家族中6 个成员之一(Augoffet al.,2010)。研究发现,脂肪酸的生物合成过程中形成的许多信号分子参与乳腺发育调控(Menget al.,2017)。该蛋白在细胞质和细胞核均可表达,广泛发挥生物学作用。目前发现,DBI的同源基因广泛存在于动物界、植物界、真菌界和原生物界(Burtonet al.,2005)。其作为高度保守蛋白,是由87个氨基酸残基组成的多肽,存在于真核生物和原核生物中,主要参与脂肪酸代谢(Faergemanet al.,1996),为细胞的生命活动提供重要的能源物质,保障细胞的正常生长。研究发现,DBI在中枢神经系统、垂体前叶、肾上腺皮质、甲状腺、肝脏、胸腺和睾丸中高表达(Bürgiet al., 1999),但关于牦牛乳腺DBI基因的研究未见报道。牦牛(Bos grunniens) 是分布于青藏高原及其毗邻地区的特有种,能够适应高寒低氧的恶劣环境(Yuet al.,2010),是当地牧民重要的生活保障和经济来源。乳腺被认为是一个“脂类合成机器”,其发育受到遗传、激素和环境的多重影响,营养物质对乳腺发育也具有调控作用(Farmer,2013;Wooet al.,2016)。本文以牦牛不同发育时期的乳腺组织为研究对象,对DBI基因编码区进行克隆和生物信息学分析,采用qPCR、WB 和IHC 等实验技术检测DBI的表达情况,确定其是否参与牦牛的乳腺发育过程,研究结果为进一步了解DBI基因功能提供相应的理论基础。
1 研究方法
1.1 实验方法
在甘肃省临夏市定点屠宰场采集3头健康牦牛不同时期(泌乳前期、泌乳期、干乳期) 的乳腺组织,乳腺组织分期参考崔英俊和李庆章(2014)。置于含双抗(青霉素、链霉素)的37℃无菌生理盐水中,经过清洗,选择组织,部分置于液氮罐中,部分用4%的多聚甲醛固定,带回实验室。
参照动物组织RNA 提取试剂盒提取牦牛不同时期乳腺组织的总RNA,通过Go ScriptTMReverse Transcription System (Promega) 合成cDNA,利用普通PCR 仪(艾本德公司,德国) 验证长链DBI克隆引物和短链qPCR 引物,使用pMDTM18-T Vector Cloning Kit 试剂盒构建载体,导入DH5α 感受态细胞,通过氨苄青霉素(ampicillin,Amp)抗性的固体培养基进行蓝白斑筛选阳性菌,送生物公司测序,并使用在线软件分析DBI 的结构特征、理化性质。借助荧光定量PCR 仪检测DBImRNA 的相对表达差异;乳腺组织蛋白样品与4×蛋白上样Buffe混合后做变性处理,对样品进行电泳、转膜、孵育一抗(DBI: ab232760),普通二抗(bs-0294D)孵育,ECL 化学发光液在暗室处理2 min,进行曝光检测DBI 蛋白的表达情况。其他试剂均为国产分析纯生化试剂。
1.2 引物设计与验证
参照GenBank 中牛的DBI基因序列,应用Primer premier5 分别设计克隆引物(DBI-F1/R1) 和qPCR验证引物(DBI-F2/R2)(黄成渝,2020),引物由上海生工生物公司合成(表1)。以牦牛不同发育时期乳腺cDNA 为模板进行引物验证,体系为20 μL:cDNA 1μL,上、下游引物各0.5 μL,Taq PCR mix 10 μL,free water 8 μL;反应条件:95℃3 min,95℃30 s,52.5℃30 s,72℃16 s,35 个循 环,72℃5 min,4℃保存;反应结束,用1%琼脂糖凝胶电泳检测PCR产物验证。

表1 引物信息Table 1 Primer information
1.3 乳腺总RNA的提取和cDNA的合成
按照TransZol 操作说明提取牦牛乳腺组织总RNA(表2),通过1%琼脂糖凝胶电泳进行检测,用紫外分光光度计检测RNA 提取质量及完整性,OD260 nm/ OD280 nm 值控制在1.8 ~2.0。再参照两步法反转录试剂盒PrimeTMRT Reagent Kit说明反转录合成cDNA,-20℃保存备用。
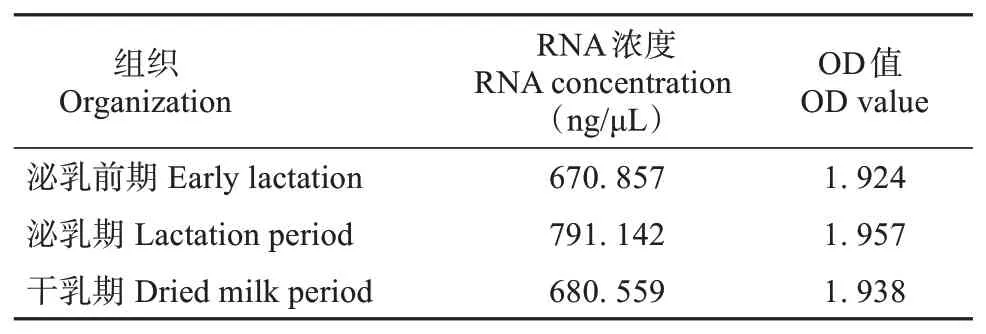
表2 乳腺组织RNA的质量Table 2 RNA quality in mammary tissue
1.4 牦牛DBI基因的克隆和测序
以牦牛乳腺cDNA 为模板进行DBI基因的扩增,体系为20 μL:cDNA 1μL,上、下游引物各0.5 μL,Taq PCR mix 10 μL,free water 8 μL;PCR反应条件:95℃3 min,95℃30 s,52.5℃30 s,72℃16 s,35 个循环,72℃10 min,4℃保存;反应结束后,用1%琼脂糖凝胶电泳检测PCR 产物,用胶回收试剂盒对目的条带回收纯化,并用分光光度计测定回收产物的浓度。将胶回收产物与pMD-19T 载体成功连接之后,转化DH5α 感受态细胞,于37℃恒温箱震荡培养2 h,吸取150 μL涂于LB固体培养基(氨苄抗性),经37℃恒温箱过夜培养蓝白斑筛选,挑取白斑阳性克隆菌落,迅速接种于LB液体培养基(氨苄抗性),置于37℃恒温箱震荡培养12 h,吸取100 μL菌液送上海生工公司进行测序。
1.5 DBI基因生物信息学分析
利用在线软件ORF finder 进行开放阅读框分析;利用在线软件BLAST 进行不同物种间DBI基因比对,分析同源性,并通过MEGA 7.0根据氨基酸序列的统计学特征构建系统进化树;利用Ex-PASy-Protparam、Protscale、IBCP、Phyre2 分别分析牦牛DBI基因所编码蛋白的理化性质、疏水性、二级结构、三级结构。
1.6 qPCR检测DBI基因的相对表达量
qPCR 反应体系为20 μL:cDNA 1 μL,上、下游 引 物 各0.5 μL,SYBR Premix Dimer EraserTM(2×)10 μL,Free water 8 μL。程序为:95℃预变性30 s,95℃变性5 s,52.5℃退火30 s,72℃延伸16 s,35个循环,样品重复4次。每个模板以β-actin为内参作为对照。程序运行结束后,保存循环阈值(Ct),采用2-ΔΔCt方法进行相对表达量分析。
1.7 Western-blot检测DBI分子在乳腺中的表达
将不同时期牦牛乳腺组织进行快速冷冻研磨,取110 mg组织样加入1 mL RIPA蛋白裂解液(PMSF终浓度1 mmol/L),置于冰盒内充分反应3 h,放入超速离心机,4℃12 000 r/min离心10 min。蛋白上样缓冲液与蛋白上清液按1∶3混合,变性(100℃,10 min),冷却5 min,操作完成后,样品置于-20℃保存。
分别制备蛋白分离胶(15%)、浓缩胶(5%),进行SDS-PAGE检测,电泳结束后,再通过转膜仪完成转膜操作,用PBST 洗去膜上残留的转膜液,5%的脱脂牛奶进行封闭,室温封闭3 h ,加入DBI抗体(1∶3 000稀释)4℃孵育过夜,再用PBST清洗5 次,每次5 min,加入二抗Goat Anti-rabbit IgG (1∶5 000 稀释),37℃摇床孵育50 min,完成之后用PBST 冲洗6 次,每次10 min。之后在PVDF 膜上滴加电化学发光液,避光孵育2 min,使用化学发光仪进行检测,最后利用软件Image J对目的条带灰度值进行分析。
1.8 IHC检测DBI分子在乳腺的分布情况
将固定于福尔马林溶液的乳腺样品制作成石蜡切片,按组织化学染色方法进行抗原修复,一抗、二抗孵育,滴加DAB 染色剂显色,蒸馏水终止,苏木精复染,梯度酒精脱水,二甲苯透明,中性树脂封片,最后镜检拍照。
1.9 数据处理与图像分析
数据用SPSS 21.0 软件进行单因素方差分析和显著性分析,数据用平均值±标准误表示。Graphpad prism 8 绘制数据图,P>0.05 表示差异不显著,P<0.05表示差异显著。
2 结果
2.1 牦牛DBI基因的扩增、测序
对提取的不同时期乳腺组织RNA 进行1%琼脂糖凝胶电泳验证(图1),以DBI-F1、DBI-R1为引物对DBI基因进行扩增,得到516 bp 的基因片段(图2),大小符合预期,对其进行克隆,送上海生工生物公司测序。
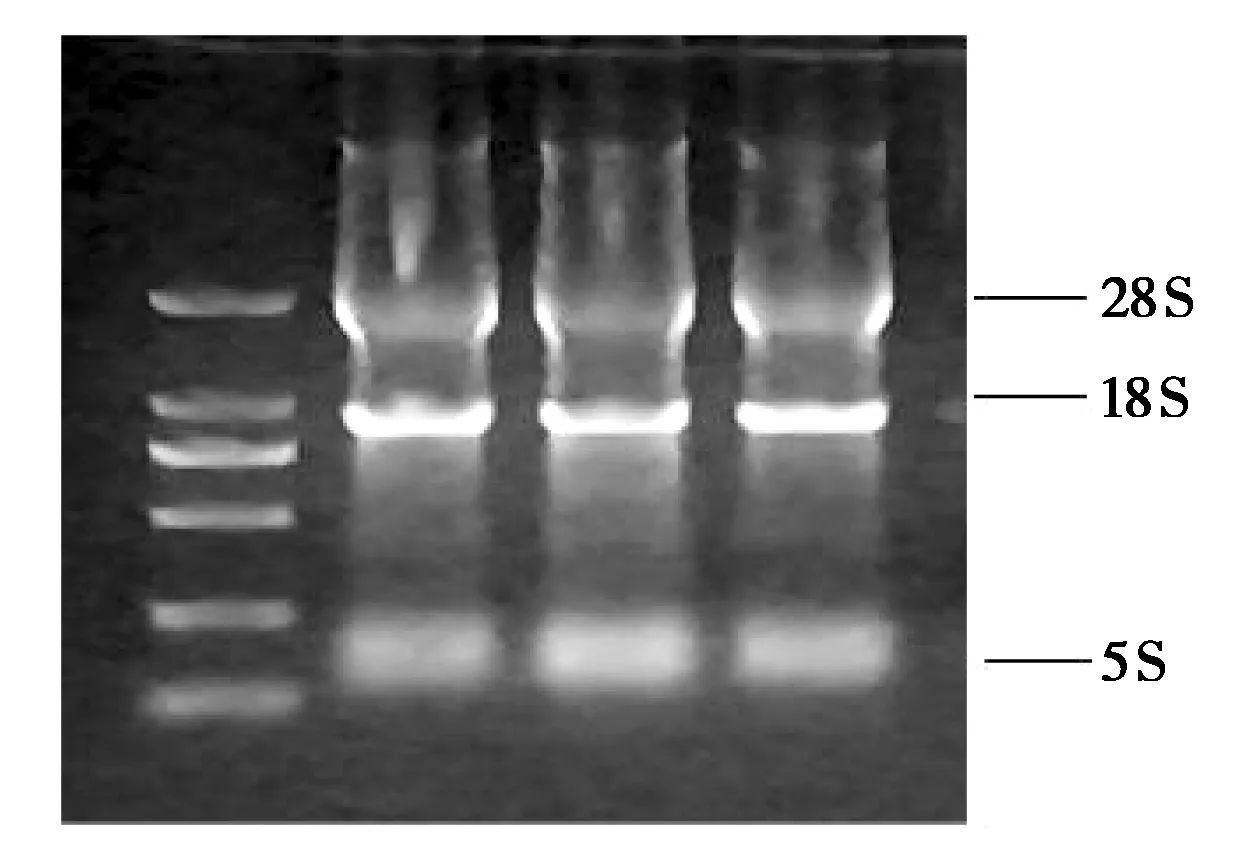
图1 不同时期牦牛乳腺组织RNA提取胶图Fig. 1 Gel image of RNA extraction from yak mammary gland tissue in different periods

图2 牦牛DBI 基因克隆结果. M:2 000 bp marker;1:DBI 基因扩增片段Fig. 2 Cloning results of yak DBI gene. M:2 000 bp marker;1:DBI gene amplified fragment
2.2 DBI生物信息学分析
将DBI基因序列提交到GenBank (登陆号:MW086940),与其他物种进行比较,发现牦牛DBI 氨基酸序列与牛(Bos taurus)、绵羊(Ovis aries)、狷羚(Bubalus bubalis)、火狐(Chlorocebus sabaeus)、人(Homo sapiens)、家犬(Canis lupus familiaris)、野猪(Sus scrofa) 和雪貂(Mustela putori-us furo) 的一致性分别为99.62%、98.48%、98.86%、90.84%、93.94%、90.91%、92.80%和90.53%。
基于同源性分析对DBI基因构建系统进化树(图3),发现牦牛DBI氨基酸序列在生物进化过程中比较保守,与之前的研究结果基本一致(盛丹等,2018),其与普通牛、绵羊和狷羚之间同源性较高,与火狐、人、家犬、野猪和雪貂同源性较低。
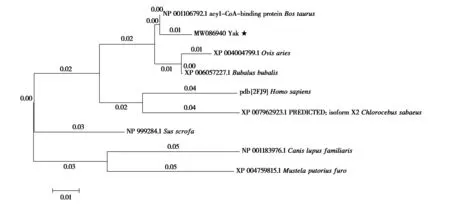
图3 牦牛DBI基因的进化树Fig. 3 Evolution tree of DBI gene of yak
2.3 牦牛DBI基因理化性质分析
DBI蛋白分子式为C447H699N115O135S4,原子总数1 400,分子量为10 kD,理论等电点为6.73。在编码蛋白质的87 个氨基酸中,Lys 含量最高为17.2%,且该蛋白不含Cys、吡咯赖氨酸(Pyl) 和硒半胱氨酸(Sec),其中带负电荷的残基总数(Asp + Glu) 为16,带正电荷的残基总数(Arg +Lys) 为16。在280 nm 的水中,DBI 的消光系数为16 960 L/mol·cm(在假设所有半胱氨酸残基对形成胱氨酸的条件下)。DBI 蛋白在酵母和大肠杆菌中的半衰期分别为大于20 h和10 h。DBI蛋白不稳定指数为24.81,属于稳定蛋白。脂肪族指数60.69,亲水性(肉汁)的总平均值为-0.867。
2.4 DBI的二级、三级结构特征
应用在线软件IBCP 预测DBI 蛋白二级结构(图4),结果表明:该蛋白主要由3 种折叠方式构成,44 个α-螺旋占比50.57%,6 个延伸链占比6.90%,37 个无规卷曲占比42.53%。由此可以推测,α-螺旋、无规卷曲及延伸链3种结构是DBI蛋白二级结构的主体。应用在线软件Phyre2 预测DBI 蛋白三级结构,4 个α-螺旋结构围成酰基辅酶A 结合口袋(图5),包括1 个DBI 结构域,该结构为DBI超家族成员特有。
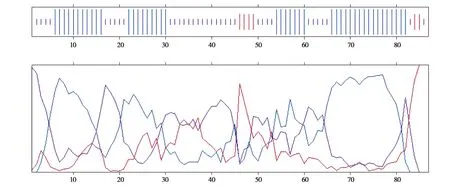
图4 牦牛DBI蛋白二级结构Fig. 4 Secondary structure of yak DBI protein
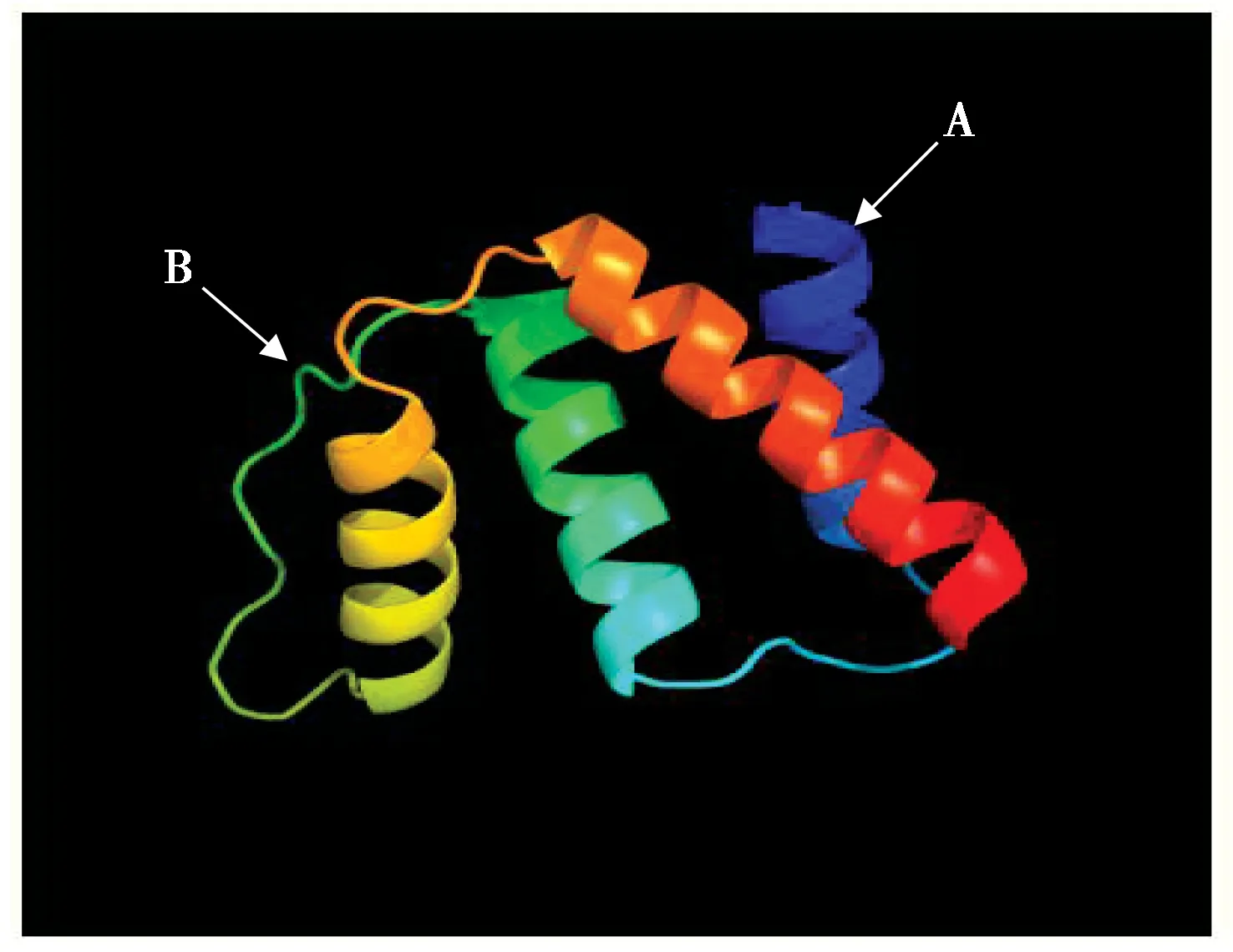
图5 牦牛DBI蛋白三级结构. A:α-螺旋;B:无规卷曲Fig. 5 Tertiary structure of yak DBI protein. A: alpha helix; B: random coil
2.5 qPCR短链引物的验证
普通PCR短链扩增产物大小符合预期,DBI为124 bp,β-actin为129 bp(图6),且条带特异性良好,可用于后续DBIqPCR实验。
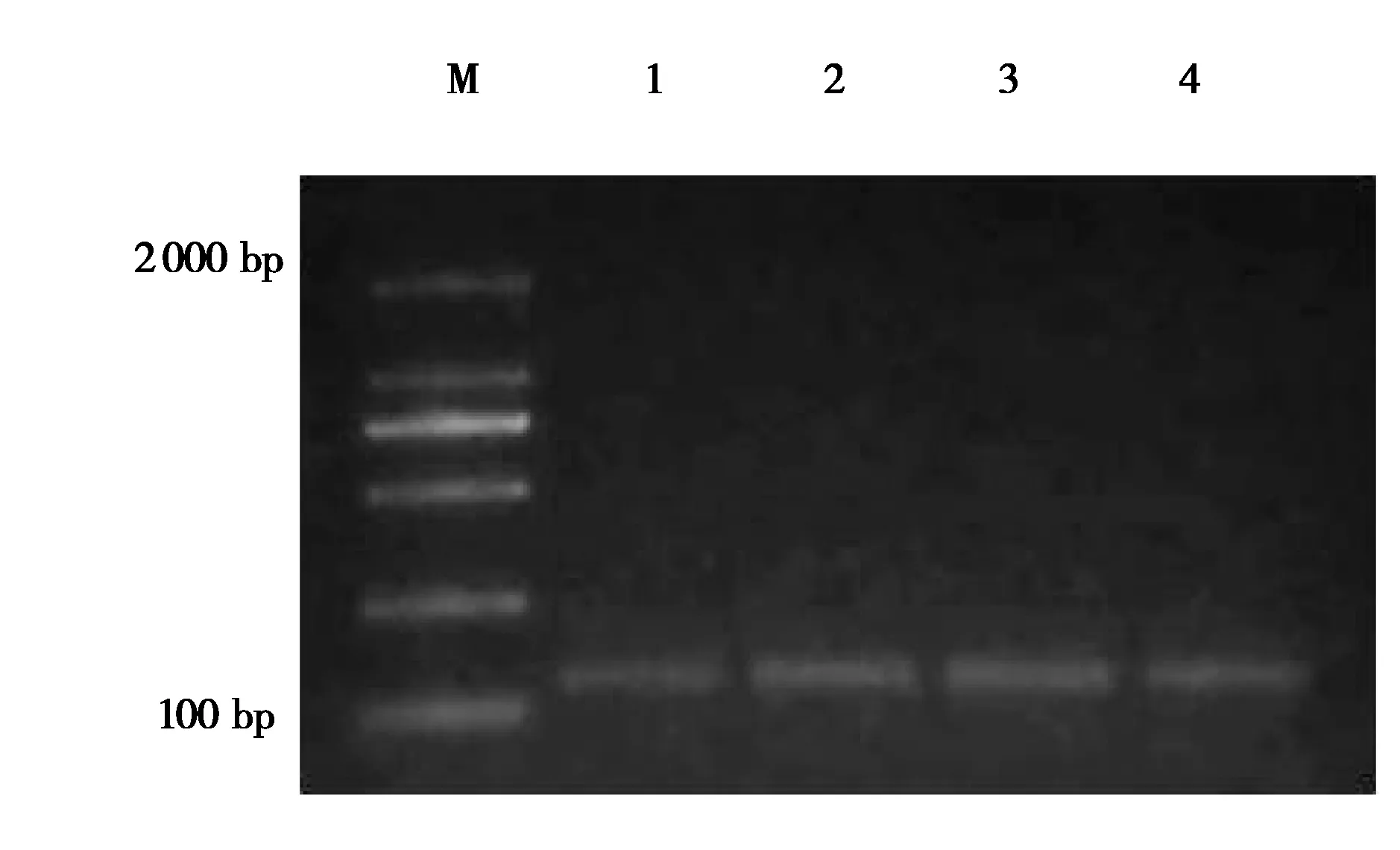
图6 牦牛DBI基因短链引物验证结果. M:2 000 bp marker;1:β-actin;2:泌乳前期;3:泌乳期;4:干乳期Fig. 6 Validation results of short-chain primers of yak DBI gene. M:2 000 bp marker; 1: β-actin; 2: Early lactation; 3: Lactation period; 4:Dried milk period
2.6 DBI mRNA在乳腺中的表达量
qPCR 数据显示:DBI在不同发育时期乳腺组织中均有表达,泌乳前期表达量最高(P=0.005 723),干乳期次之,泌乳期表达量最低(P=0.026 418)。
2.7 DBI分子在乳腺中的表达
WB 结果显示,DBI 分子在牦牛不同发育时期乳腺组织中均有表达(图7),泌乳前期表达量最高(P=0.000 010),干乳期次之,泌乳期表达量最低(P=0.000 183)。

图7 DBI 蛋白在牦牛不同时期乳腺中的表达. 1:泌乳前期;2:泌乳期;3:干乳期Fig. 7 Expression of DBI protein in mammary of yaks at different stages. 1:Early lactation;2:Lactation period;3:Dried milk period
2.8 DBI蛋白在牦牛不同时期乳腺中的定位
IHC检测DBI分子在牦牛不同发育时期的乳腺组织中的表达情况,图中棕色部分为DBI 的阳性表达,蓝色部分为阴性。DBI主要表达于乳腺腺泡上皮细胞、导管上皮细胞、小叶间质细胞,在脂肪细胞中表达很弱或不表达(图8)。
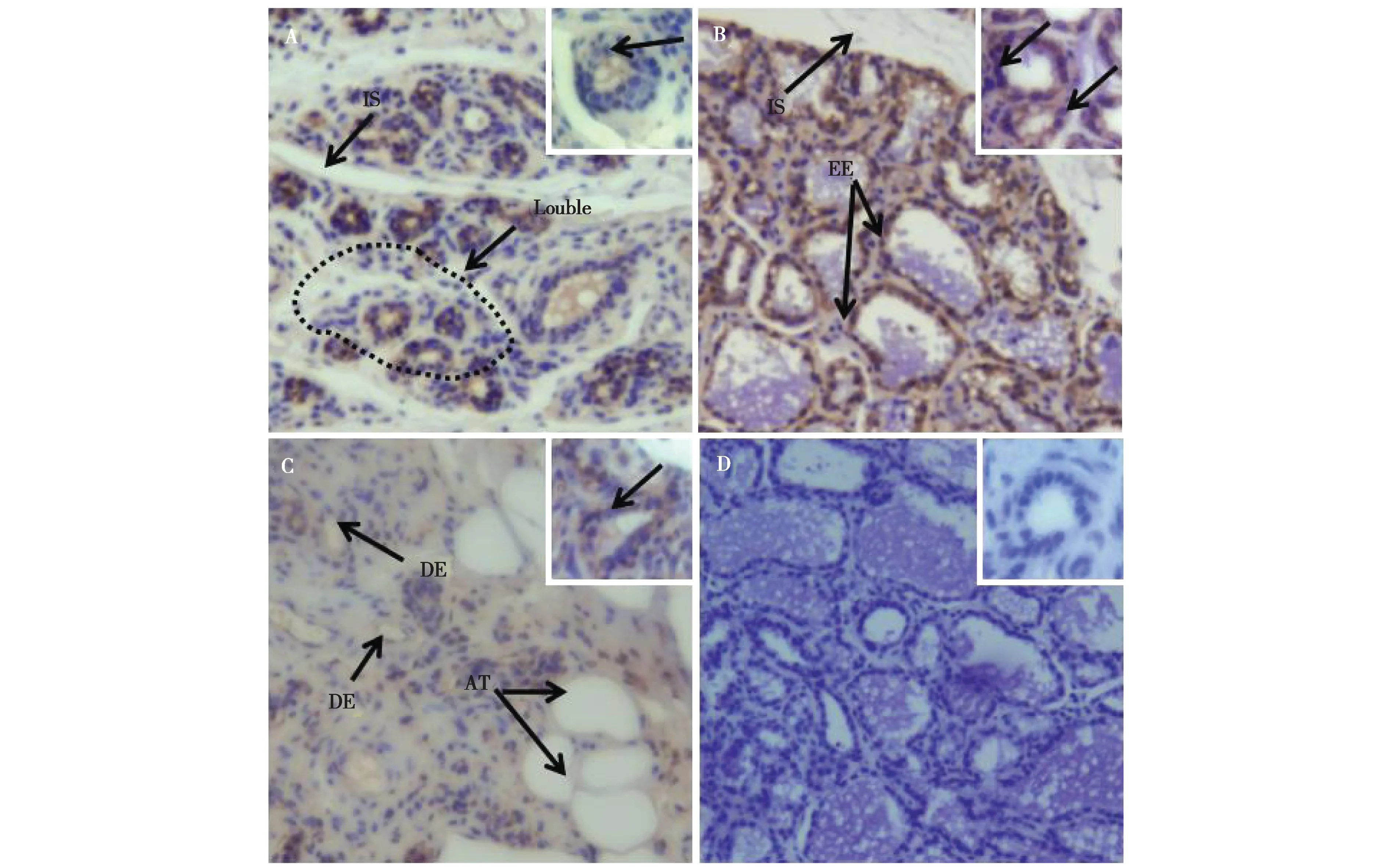
图8 DBI 蛋白在牦牛不同时期乳腺中的分布情况. A ~D 为免疫组织化学染色;A ~C:阳性表达;D:阴性对照;A:泌乳前期;B:泌乳期;C:干乳期;EE:乳腺上皮细胞;DE:导管上皮细胞;IS:小叶间基质;AT:脂肪组织(400×)Fig. 8 Distribution of DBI protein in mammary gland of yaks in different periods. A- D: Immunohistochemical staining;A- C: Positive expression; D: Negative control;A: Early lactation; B: Lactation period; C: Dried milk period; EE: Mammary epithelial cells; DE: Ductal epithelial cells;IS:Interlobular stroma;AT:Adipose tissue(400×)
3 讨论
DBI 最先由Guidotti 等从鼠脑组织中分离纯化获得,后相继从人、牛、猪、非洲爪蟾和酵母中分离到(李林春等,2010)。DBI是脂肪酸的一种活化形式(Vincenzoet al., 2003),能够负责转运Acyl-CoA 的胞内脂质结合蛋白,在脂肪酸代谢中具有重要作用。研究发现,DBI在胎盘滋养细胞中广泛表达,能够影响滋养细胞的增殖,通过影响类固醇激素合成酶的表达影响滋养细胞合成类固醇激素,与妊娠维持具有潜在关系(黄成渝,2020)。本研究获得DBI基因克隆序列全长516 bp,其中编码区为264 bp,与盛丹等(2018) 克隆槟榔江水牛(Bos bubalus)DBI基因结果一致,比李林春等(2010) 克隆青鳉鱼(Oryzias latipes)DBI编码区少6个碱基,该基因编码87个氨基酸,蛋白相对分子量为10 kDa,理论等电点为6.73。蛋白性质预测发现,牦牛DBI 分子为稳定的亲水性蛋白,4 个α-螺旋结构围成酰基辅酶A 结合口袋;其基因同源性与普通牛最近,高达99.62%。不同物种间序列比对发现,DBI基因在生物进化过程中高度保守,构建的系统进化树也发现牦牛与普通牛、绵羊和狷羚之间同源性很高,表明牦牛DBI基因与其他物种的功能高度一致。
DBI基因在不同类型的组织中表达量有明显不同,其在代谢活性高的组织中高表达,如肝脏、脂肪组织、皮肤和外分泌腺等(Gallegoet al.,2018)。有研究发现DBI在水牛的心、肝、脾、肺、肾、瘤胃、小肠、垂体、大脑、肌肉中均表达,且差异明显(盛丹等,2018)。本研究中,DBI基因在泌乳前期乳腺组织的表达量显著高于泌乳期和干乳期,与DBI分子的表达一致。DBI基因与蛋白均在泌乳前期高表达,说明该基因参与乳腺发育。对DBI进行定位研究,已发现该因子在BeWo 细胞中表达,且影响其增殖能力(黄成渝,2020),本文结果显示:DBI主要在乳腺腺泡上皮细胞、导管上皮细胞、小叶间质细胞中高表达,在脂肪细胞中表达较弱。乳腺是生成乳汁的场所,而乳脂是乳汁的主要成分,乳腺组织在泌乳前期需要充分发育,为泌乳做好充足的准备(McNallyet al.,2017)。脂肪酸调控乳腺发育的机制包括两条途径:一是通过脂肪酸受体及胞内信号通路直接调控;二是通过调控相关激素的分泌间接影响乳腺发育。动物体内激素含量的变化能够引起动物在不同生理时期乳腺细胞的分化、退化及乳腺细胞总数的变化(Lecomteet al., 2017; Chiet al., 2019; Treecket al., 2019)。泌乳前期乳腺导管的发育(Planteet al.,2011)主要是卵巢和胎盘分泌的雌激素作用的结果。卵巢产生的雌激素和孕酮是引起乳腺发育的重要因素(Derooet al., 2009; Hiltonet al.,2018)。泌乳前期由于雌激素与孕酮的双重作用,乳腺充分发育,尤其到了妊娠的中后期,雌激素和孕酮的分泌同时增加(Bagotet al., 2019),对乳腺组织持续发挥促进作用,促使乳腺小叶—腺泡高度发育(Hurleyet al.,2019)。雌激素含量在生理水平升高可促进乳腺发育,但过高会抑制乳腺发育(Yanget al., 2020)。糖皮质激素对乳腺发育和泌乳也有重要的调节作用。雌激素、孕酮和糖皮质激素都属于类固醇激素(Morelet al., 2016),DBI能够参与调节类固醇激素生物合成与代谢(Papadopouloset al.,1991)。这也印证了本研究结果,进一步说明DBI 在泌乳前期的高表达与乳腺发育具有内在联系。
乳腺组织中合成和分泌乳汁的腺泡结构在泌乳早期已经发育成熟(Akerset al., 2006)。脂肪酸是乳腺组织的一种重要营养素,其对乳腺上皮细胞的生长增殖具有一定的抑制作用。泌乳期乳腺组织DBI mRNA 表达量下降,脂肪酸合成减少,对上皮细胞的增殖、分化和生理功能的抑制作用降低,这将更有利于泌乳。研究表明,泌乳期奶牛乳腺上皮细胞中,DBI在细胞内酰基辅酶A的运输过程中具有特殊作用(Massimoet al.,2008),奶牛乳腺上皮细胞增殖速率先上升再下降。而本研究中DBI 在泌乳期的降低是不是与上皮细胞的增值速率升高存在某种内在联系,还需做进一步的探索。干乳期是奶牛饲养管理的一个关键时期(Hoeijet al., 2016; Fujiwaraet al., 2019)。实践证明,奶牛的泌乳期长达305 d 左右(Saowaphaket al., 2017; Sehestedet al., 2019),母体经过长期的泌乳及妊娠,机体就像一个昼夜不停高效运作的“加工厂”,需要短期的调理和缓冲过程。此外,妊娠后期胎儿的快速生长发育,需要母体提供大量的营养物质满足其生长需求(Smithet al.,2017),母牛必须停止挤奶,进入干乳期。科学合理的干乳期可以保证胎儿的正常发育,乳腺组织的休整重建(Weberet al.,2015;Koket al.,2019),有利于机体储备大量的营养物质,不仅可以减少产后疾病,还能为下一个泌乳期做好准备。本研究中,牦牛干乳期乳腺组织中DBI 分子的表达与泌乳期相比有明显的回升趋势。由此推测,DBI可能与乳腺上皮细胞的更新存在关联。
本研究克隆了牦牛DBI基因CDS 区序列,发现其在牦牛泌乳前期乳腺表达量高,主要表达于乳腺腺泡上皮细胞、导管上皮细胞和小叶间质细胞。由此推测,DBI与牦牛的乳腺发育存在密切联系,为进一步研究DBI基因功能奠定理论基础。
