基于网络药理学研究连翘叶提取物通过AMPK抗恩诺沙星诱导肝损伤的作用
2022-06-06安志霞潘阳阳范碧玥马小燕叶得河张治杰邱山桐姚亚乐
安志霞,潘阳阳,范碧玥,马小燕,叶得河,张治杰,邱山桐,姚亚乐,王 萌
(甘肃农业大学动物医学院,兰州 730070)
恩诺沙星(enrofloxacin,ENR)又称乙基环丙沙星、恩氟沙星,属于第三代氟喹诺酮类抗菌药,具有广谱抗菌活性,因此被广泛应用于畜牧业,是动物专用的抗菌药[1]。ENR的抗菌机制是抑制细菌DNA旋转酶,干扰细菌DNA的复制、转录和修复重组,使细菌不能正常生长繁殖而发挥杀菌作用[2]。ENR进入体内的代谢产物为环丙沙星。研究表明,人摄入大剂量或长期摄入含有环丙沙星的动物源性食品可能会引起肝损伤[3]。氟喹诺酮类药物对肝脏的损伤可能是通过产生过氧化物和自由基诱导氧化应激产生的[4-6]。ENR在SD大鼠[7]、施氏鲟[8]、鸡[9]等动物模型中均有一定的肝毒性,使试验动物血清中的谷丙转氨酶(alanine transferase,ALT)和谷草转氨酶(aspartate transferase,AST)活性显著上升[7-9]。
中药在肝损伤疾病的防治中扮演着越来越重要的角色[10],目前有许多中药已被证实有良好的保肝效果。连翘是木犀科连翘属植物,其主要以果实入药,主要成分有苯乙醇苷类、黄酮类和木脂素类等[11],具有抑菌、抗炎、抗氧化衰老及保肝的药理活性[12]。赵晨栋等[13]通过试验发现连翘提取物可能通过抗氧化作用及抑制CYP2E1酶活性,缓解对乙酰氨基酚诱导的肝损伤。连翘叶为木犀科植物连翘的干燥叶,也可供药用。连翘叶为非药用部位,一般多被丢弃,对连翘叶的开发利用较少。研究表明,连翘叶的成分主要为黄酮类、多糖类、有机酸类和木脂素类等[14]。据相关分析,连翘叶中的化学成分与连翘果实十分相似,甚至有些成分还高于连翘果实,如连翘苷和连翘脂苷A[15-17]。连翘叶含多种药理活性,如抗氧化、抑菌及肝保护作用[18-19]。刘静[20]研究发现,连翘叶提取物(Forsythiasuspenseleaves extract,FSLE)对CCl4诱导的肝损伤具有良好的保护作用;白美美[19]研究发现,连翘叶红茶对CCl4诱导的肝损伤具有良好的保护作用;朱淑云[21]研究发现,FSLE对四氧嘧啶所致的肝损伤有明显的保护作用。
网络药理学基于系统生物学理论,研究模式为“多成分网络靶点作用”,为中药的治疗机制、新用途等方面的研究提供了新的研究思路和方法,也广泛应用于中兽药的研发。本研究基于连翘叶多成分、多靶点作用的研究思路,应用网络药理学技术,通过对FSLE成分、靶点、生物功能及通路分析,探讨FSLE治疗ENR诱导的肝损伤(ENR-induced liver injury,EILI)的机制,以期为肝损伤的治疗提供候选药物和理论依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 48只4周龄洁净级昆明小鼠,体重25 g±3 g,雌雄各半,购自中国农业科学院兰州兽医研究所。动物饲养于甘肃农业大学动物医学院实验室,自由进食饮水。动物试验经甘肃农业大学伦理委员会批准(GAU-LC-2020-33)。
1.1.2 主要试剂及仪器 FSLE、生理盐水、羧甲基纤维素钠(carboxymethylcellulose sodium,CMC)和ENR(生物技术级)均购自上海源叶生物科技有限公司;AST、ALT、丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione,GSH)、过氧化氢(hydrogen peroxide,H2O2)和总超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒均购自南京建成生物工程研究所;RIPA裂解液、苯甲基磺酰氟(PMSF)、5×蛋白上样缓冲液、BCA蛋白试剂盒和超敏ECL化学发光即用型底物均购自北京索莱宝科技有限公司;AMPK多克隆抗体购自上海碧云天生物技术有限公司;β-actin抗体和羊抗兔二抗均购自北京博奥森生物技术有限公司;反转录试剂盒和荧光定量试剂盒均购自南京诺唯赞生物科技股份有限公司;TolsZel UP购自北京全式金生物技术有限公司。
YRE2000A旋转蒸发仪购自巩义市予华仪器有限责任公司;CT15RE日立微量高速冷冻离心机购自株式会社日立制作所;SpectraMax i3x多功能酶标测定仪购自Molecular Devices公司;Amersham Imager600全自动化学发光成像系统购自GE公司;LightCycler96荧光定量PCR仪购自罗氏集团;蛋白电泳仪及转膜装置购自Bio-Rad公司;Scientz-48L冷冻型高通量组织研磨器购自宁波新芝生物科技股份有限公司;Alpha1-2冷冻干燥机购自CHRIST公司;Leica ASP300S自动组织脱水机、HistoCore Arcadia H石蜡包埋机和HistoCore MULTICUT轮转式切片机均购自莱卡公司。
1.2 FSLE制备及其有效成分鉴定
1.2.1 连翘叶来源及提取物的制备 2020年8月中旬于甘肃省天水市秦岭镇采摘连翘叶,于通风处自然晾干,并储存至阴凉干燥处,使用前将连翘叶研制为粉末。
称取30 g连翘叶粉末,按照料液比1∶8加入60%乙醇,浸泡20 min,60 ℃水浴回流1 h,抽滤,收集滤液,滤渣中加入60%乙醇240 mL,纤维素酶0.15 g,50 ℃水浴回流2 h,抽滤,合并2次滤液,于50 ℃旋转蒸发,旋转蒸发后置于冷冻干燥机冻干,收集FSLE冻干后的产物,并将其研制为粉末,置于阴凉干燥处。
1.2.2 FSLE有效成分鉴定及初步筛选 将1 g冻干后的FSLE粉末送至南京集思慧远生物科技有限公司使用液相-质谱法(LC-MS)检测成分。
LC-MS条件:液相色谱柱,Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);液相色谱A相为水相,含5 mmol/L乙酸铵和5 mmol/L乙酸,B相为乙腈;样品盘温度,4 ℃;进样体积,3 μL;分析时间,15 min。
质谱参数:鞘气流速,30 Arb;辅助器流量,10 Arb;毛细管温度,350 ℃;碰撞能量,NCE模式下10/30/60;喷雾电压,正离子模式4.0 kV,负离子模式-3.8 kV。
1.3 网络药理学分析
1.3.1 FSLE活性成分筛选 将FSLE主要有效成分的CAS号输入到PubChem(https:∥pubchem.ncbi.nlm.nih.gov/)中,下载2D结构,将下载好的结构导入到Swiss ADME数据库(http:∥www.swiss adme.ch/)中,以胃肠吸收为“High”,类药性大于2个“YES”为依据筛选FSLE活性成分。
1.3.2 FSLE活性成分靶点与肝损伤靶点的获取 将筛选后的活性成分导入到Swiss Target Prediction网站中(http:∥www.swiss target prediction.ch/),预测FSLE相关靶点,并进行整理,去重。
在GeneCards(http:∥www.genecards.org/)数据库中输入“Drug-induced liver injury”,作为EILI靶点,并对数据进行整理,去掉分数较低的靶点。
1.3.3 FSLE治疗EILI核心靶点的筛选 将FSLE及EILI的活性成分靶点分别导入到STRING(https:∥cn.string-db.org/)数据库,获得各自的蛋白互作网络,通过Cytoscape 3.8.0软件中的Merge交集功能筛选核心靶点。
1.3.4 FSLE治疗EILI的GO功能、KEGG通路富集分析 取FSLE和EILI靶点的交集靶点,使用Metascape(https:∥metascape.org/)在线分析工具进行FSLE治疗EILI的GO功能和KEGG通路富集,物种选择为Homosapiens。通过微生信在线网站(http:∥www.bioinformatics.com.cn/)进行绘图。
1.3.5 成分-靶点-信号通路可视化网络的构建 将筛选得到的FSLE活性成分-疾病交集靶点及通路整理为nextwork.xsml文件,并编辑好type文件导入到Cytoscape 3.8.0软件,构建“成分-靶点-信号通路”可视化网络。
1.4 动物模型体内验证
1.4.1 动物分组及给药 取2 g FSLE溶于生理盐水中,分别配制成200、400和600 mg/kg的药液,将ENR溶于0.5% CMC溶液中配制为350 mg/kg的药液,4 ℃保存备用。适应性饲喂1周后,将48只昆明小鼠随机分为6组:空白组(NC组)、FSLE对照组(FSLE组,600 mg/kg)、EILI模型组(LD组)、连翘叶低剂量治疗组(LFSLE+LD组,200 mg/kg)、连翘叶中剂量治疗组(MFSLE+LD组,400 mg/kg)、连翘叶高剂量治疗组(HFSLE+LD组,600 mg/kg)。其中NC组灌胃0.5% CMC溶液,FSLE组灌服600 mg/kg FSLE;除NC组与FSLE组外,其余组小鼠均给予等量的ENR 350 mg/kg,每日2次连续4 d,在给药4 d后,LFSLE+LD、MFSLE+LD和HFSLE+LD组分别按200、400和600 mg/kg的剂量灌胃给予FSLE药液,每日2次,连续3 d,其余各组灌胃给予等量的0.5% CMC溶液。
1.4.2 小鼠肝脏功能指标的测定 在试验第7天给药后禁食12 h,不限制饮水,小鼠眼眶静脉丛采血,室温条件下静置30 min,4 ℃、3 000 r/min离心10 min分离血清,严格按照试剂盒说明书测定ALT及AST的活性。
1.4.3 小鼠肝脏组织病理形态学观察 采集各组小鼠肝脏同一部位组织,固定于4%多聚甲醛中,固定24 h以上,经过脱水、浸蜡、透明、包埋、切片后HE染色,于光学显微镜下观察各组小鼠肝脏组织的病理形态学特征。
1.5 FSLE对小鼠肝损伤关键靶点AMPKα1和AMPKα2表达的影响
1.5.1 小鼠肝脏AMPKα1和AMPKα2基因表达 采用Trizol法提取小鼠肝脏总RNA,反转录为cDNA,采用实时荧光定量PCR检测AMPK通路关键基因AMPKα1和AMPKα2表达,以β-actin为内参,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 实时荧光定量PCR引物序列
1.5.2 小鼠肝脏组织AMPKα1和AMPKα2蛋白表达 称取小鼠肝脏组织80 mg左右,加入1 mL含蛋白酶抑制剂的RIPA裂解液,充分裂解30 min后28 820 r/min离心5 min,取上清液,BCA法测定蛋白浓度,按蛋白上样缓冲液∶蛋白样1∶4的比例加入5×蛋白上样缓冲液,100 ℃水浴10 min,进行10% SDS-PAGE、转膜、封闭,加入一抗(AMPK多克隆抗体,稀释比1∶900,β-actin(单克隆抗体,1∶4 000稀释),4 ℃孵育过夜。PBST清洗30 min后,加入二抗(羊抗兔,1∶5 000稀释)室温孵育2 h,PBST清洗60 min,ECL显影成像,Image J软件分析条带。
1.6 小鼠肝脏氧化应激指标测定
取适量肝脏样品制成10%匀浆,4 ℃、2 500 r/min离心10 min取上清液备用。按照试剂盒说明书测定SOD活性及GSH、MDA和H2O2含量。
1.7 数据处理与统计分析
试验数据应用统计学软件GraphPad Prism 9.0进行t检验和单因素方差分析(One-way ANOVA)考察组间差别,试验结果以平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 FSLE有效成分初步鉴定
由图1可知,FSLE成分较多且较复杂,由获得的精确分子质量及相关文献报道,并结合本课题组研究,对FSLE的主要有效成分进行初步筛选。主要筛选具有保肝作用的成分,具体成分见表2。初步鉴定得到31种活性成分,主要为30种黄酮类化合物和1种五环三萜类化合物熊果酸,其余成分主要为萜类、木脂素及有机酸。
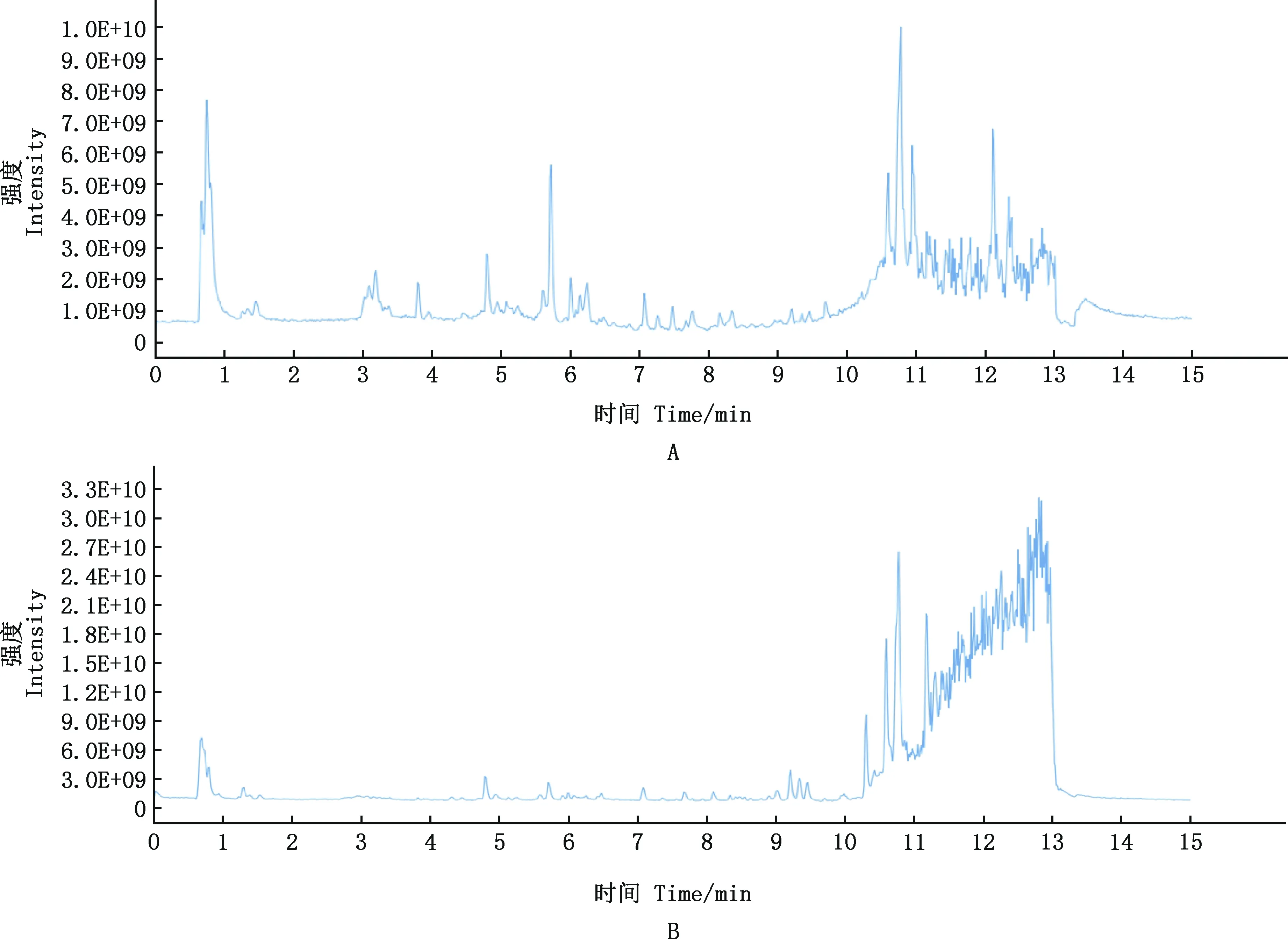
A,FSLE正离子流色谱图;B,FSLE负离子流色谱图A,Positive flow chromatography of FSLE;B,Negative flow chromatography of FSLE图1 FSLE离子流色谱图Fig.1 Total ion current chromatogram of FSLE
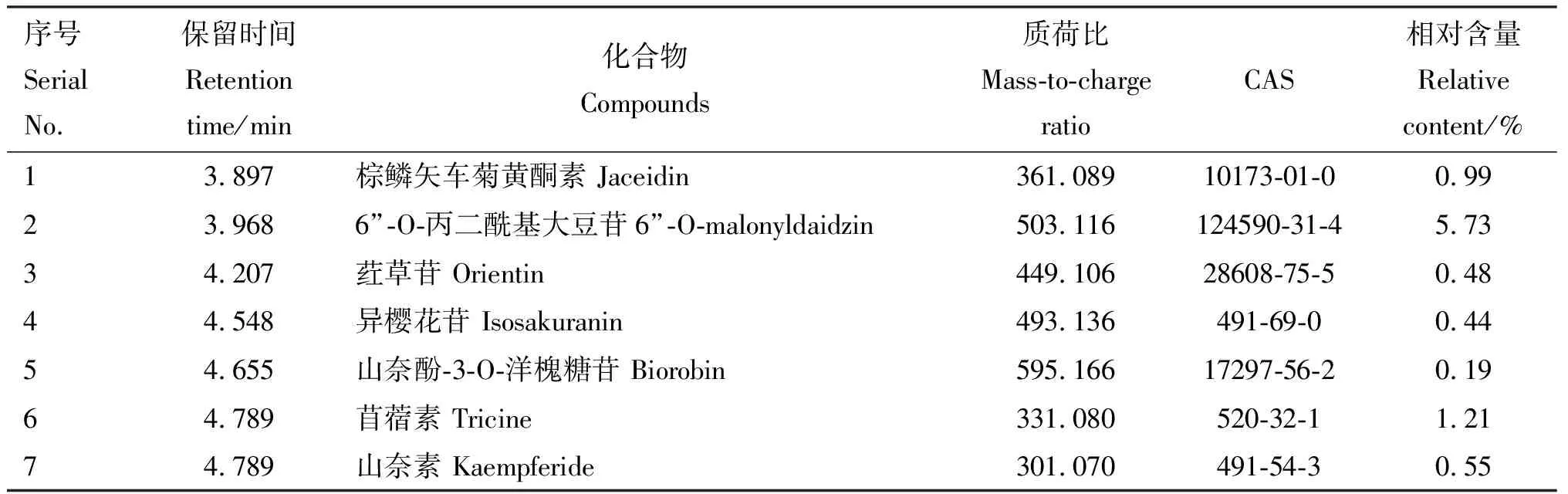
表2 FSLE主要有效成分
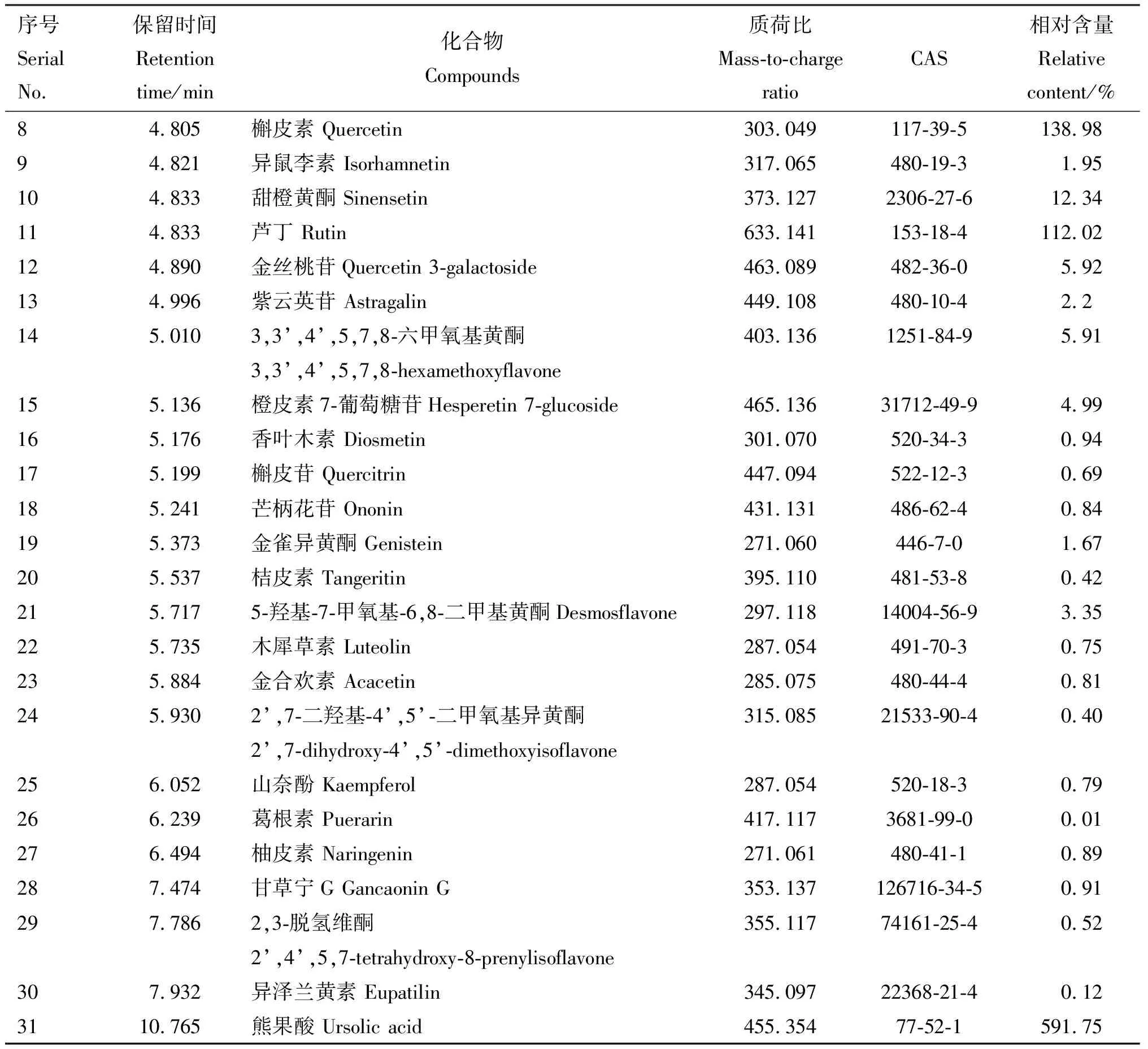
续表
2.2 网络药理学分析
2.2.1 FSLE活性成分筛选 将31种成分根据胃肠吸收及类药性进行筛选,得到20种活性成分,包含19种黄酮类化合物及1种五环三萜类化合物(表3)。 熊果酸的胃肠吸收较低,但由于其含量较高,且有明确的保肝作用,因此也选为活性成分。
2.2.2 FSLE活性成分及疾病靶点预测 将所选活性成分导入到Swiss Target Prediction中,整理去重后得到相关药物成分靶点338个。通过GeneCards数据库搜索“Drug-induced liver injury”作为EILI的靶点,整理去掉分值较低的靶点后共筛选出913个疾病靶点,作为候选靶点。
2.2.3 FSLE治疗肝损伤核心靶点筛选 通过STRING在线网站及Cytoscape 3.8.0软件中的Merge功能进行筛选,得到12个核心成分靶点(图2)。FSLE可能通过作用于MAPK1、MAPK3、ESR1、PIK3CA、HSP90AA1、SRC、APP、PIK3R1、MAPK8、EGFR、VEGFA和AKT1靶点治疗EILI。
2.2.4 FSLE治疗EILI的GO功能和KEGG通路富集分析 在Excel表格中取FSLE与EILI的交集,即得124个交集靶点。将交集靶点输入到Metascape中进行GO功能和KEGG通路富集分析。GO功能分析绘制为柱状图(图3),其中,生物过程涉到细胞对化学应激的作用、对无机物的作用、细胞对氮化合物的作用和激酶活性的正调控的过程等;细胞组分涉及到膜筏、囊泡腔、受体复合体和膜面等成分;分子功能涉及到蛋白激酶活性、磷酸酶结合、蛋白丝氨酸/苏氨酸激酶活性和核受体活性等。根据P<0.05,筛选出排名前20的KEGG通路富集分析并绘制成气泡图(图4)。KEGG通路富集分析显示,FSLE治疗EILI的通路主要富集在癌症通路、流体剪切应力与动脉粥样硬化通路、癌症中的microRNA通路、膀胱癌、癌症中的转录失调、5-HT神经突触、AMPK信号通路、卵巢类固醇生成、轴突导向、钙信号通路、细胞因子与细胞因子受体相互作用、药物代谢等。去掉与癌症相关及与肝损伤无关的通路,FSLE治疗肝损伤的直接通路有:AMPK信号通路、细胞因子与细胞因子受体的相互作用、药物代谢、补体和凝血级联、p53信号通路、胆汁分泌、酪氨酸代谢、PPAR信号通路和色氨酸代谢。
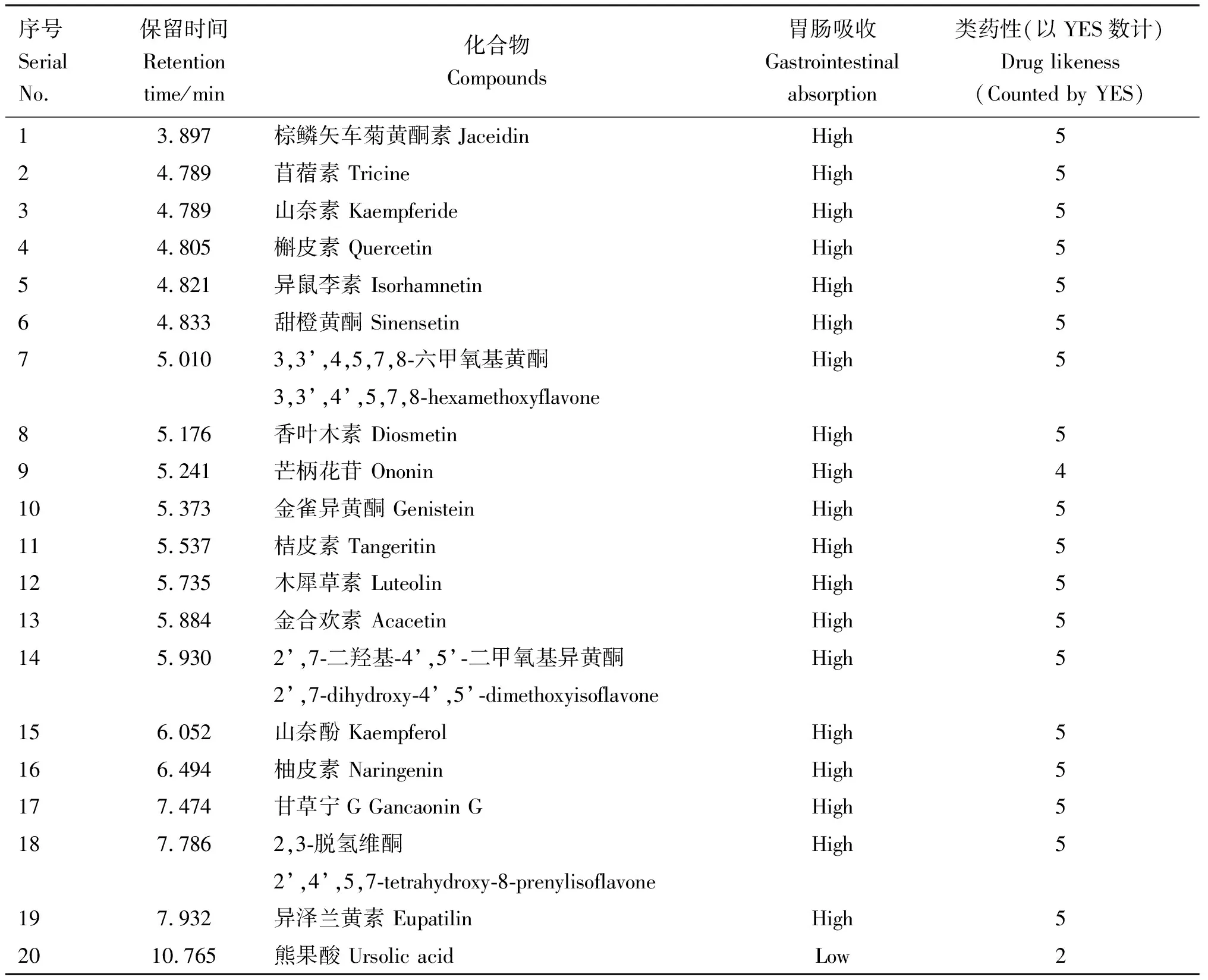
表3 FSLE活性成分
2.2.5 成分-靶点-信号通路可视化网络 将FSLE活性成分靶点、药物与疾病交集靶点和通路相关靶点导入到Cytoscape 3.8.0软件绘制“成分-靶点-信号通路”可视化网络(图5)。采用Network Analyzer计算网络拓扑参数,结果显示,该网络的节点数为378,边数为1 915。可看出FSLE治疗EILI各靶点之间密切连接。FSLE中成分的平均度值(Degree)为69.80,其中高于平均Degree值的成分有13种,Degree值排名前5的分别为棕鳞矢车菊黄酮素、甜橙黄酮、桔皮素、异泽兰黄素和山奈素;信号通路的平均Degree值为11.31,其中高于平均Degree值的通路有5条,分别为癌症通路、癌症中的microRNAs通路、流体剪应力和动脉粥样硬化、癌症中的转录失调和AMPK信号通路。除去癌症相关通路,FSLE治疗EILI的关键通路为AMPK信号通路,故FSLE可能通过AMPK通路发挥治疗EILI的作用。
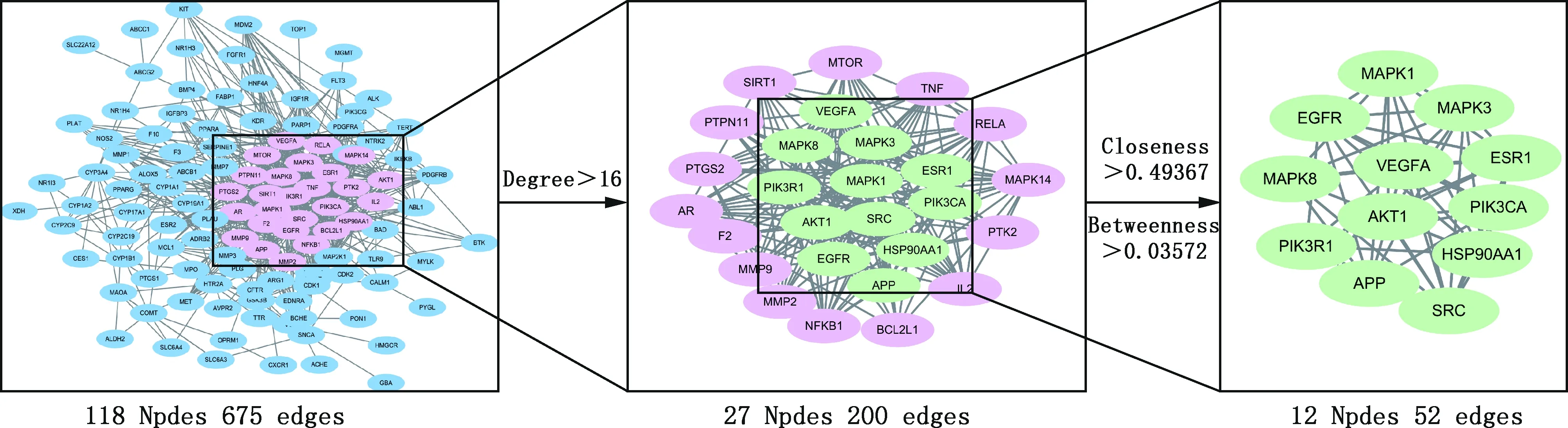
图2 核心靶点筛选Fig.2 Core target screening
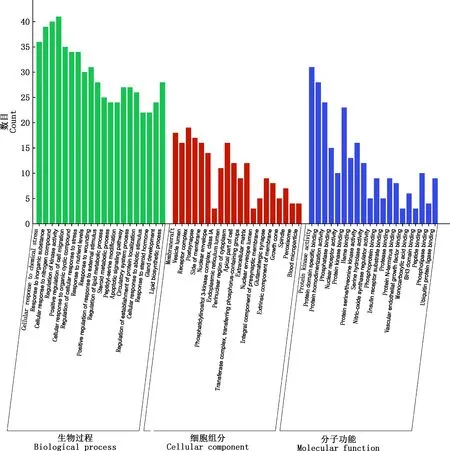
图3 GO功能分析柱状图Fig.3 Chart histogram of GO function analysis
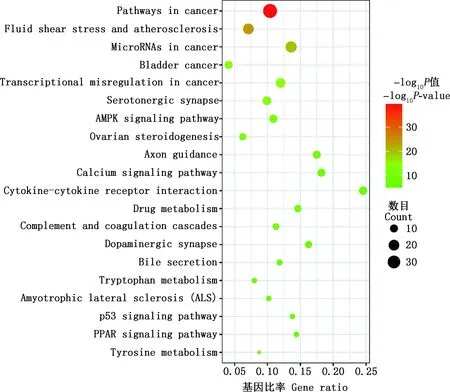
图4 KEGG通路富集分析气泡图Fig.4 Bubble diagram of KEGG pathway analysis
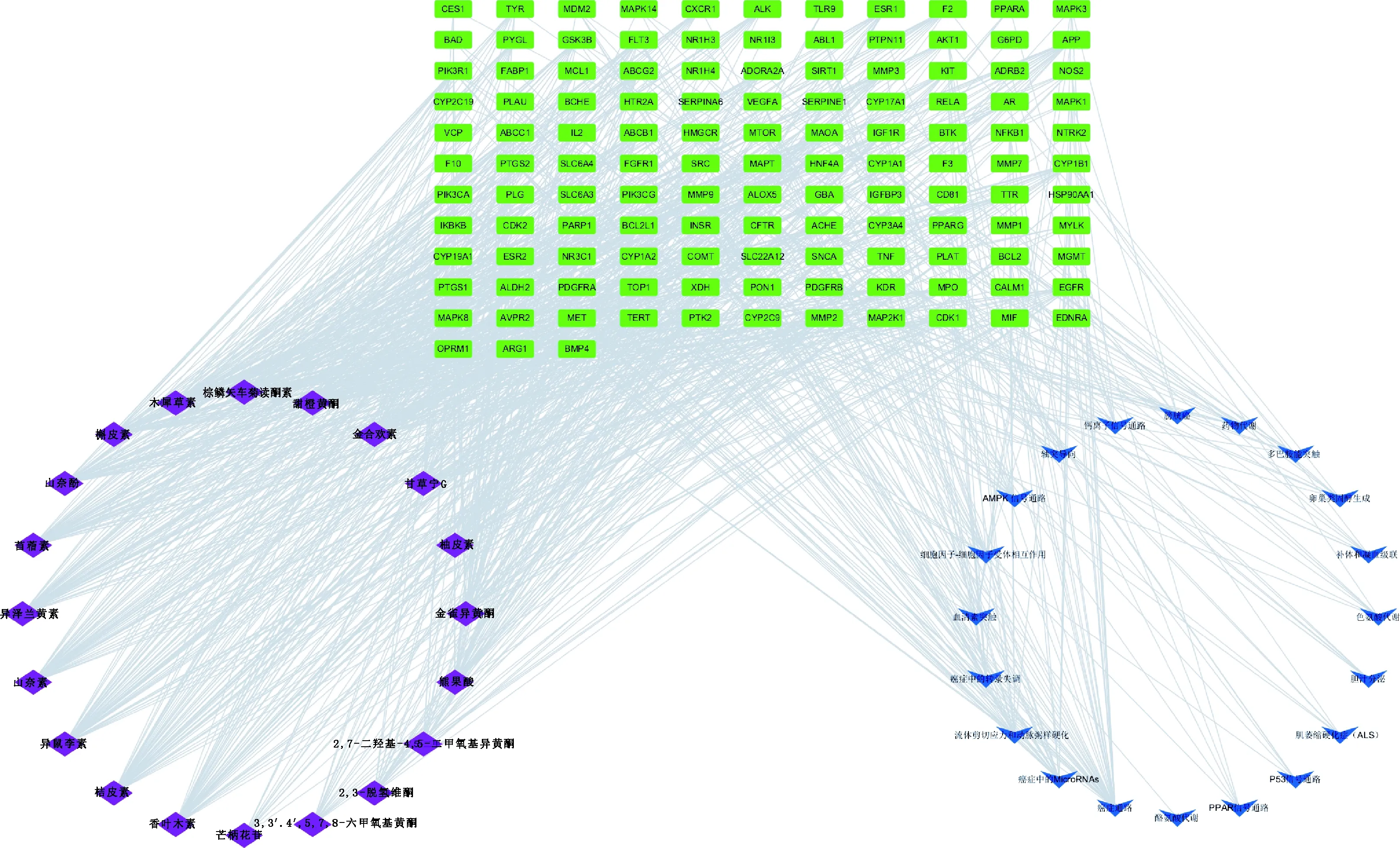
菱形代表成分;长方形代表靶点;箭头代表通路Diamond represents components;Rectangle represents targets;Arrow represents pathways图5 成分-靶点-信号通路Fig.5 Component-target-signal pathway network
2.3 FSLE抗EILI的体内验证
2.3.1 FSLE对小鼠血清ALT和AST水平的影响 由图6可知,与NC组相比,LD组小鼠血清ALT和AST活性显著升高(P<0.05),提示EILI造模成功;与LD组相比,HFSLE+LD、MFSLE+LD和LFSLE+LD组小鼠血清AST活性均显著降低(P<0.05),HFSLE+LD组小鼠血清ALT活性显著降低(P<0.05),说明FSLE可有效减轻EILI。
2.3.2 FSLE对小鼠肝脏组织病理变化的影响 HE染色结果显示,NC组的小鼠肝脏组织细胞形态正常,细胞结构完整,细胞间隙致密,肝脏组织以中央静脉为中心呈放射状排列、结构完整,无炎性细胞浸润(图7A);LD组小鼠肝脏组织肝细胞结构较为紊乱,肝索基本消失,界限不清,肝细胞出现水肿现象,有部分核溶解现象,并伴有少量出血和炎性细胞(图7C),表明小鼠EILI模型成功建立;与LD组相比,HFSLE+LD组细胞完整,排列整齐,水肿现象减少,肝索清晰,无大量炎性细胞及坏死灶(图7D);MFSLE+LD组肝细胞形态出现好转,水肿现象减轻(图7E);LFSLE+LD组小鼠肝脏组织形态好转,虽有水肿现象但水肿减轻,无核溶解现象,细胞排列较为紧密(图7F)。
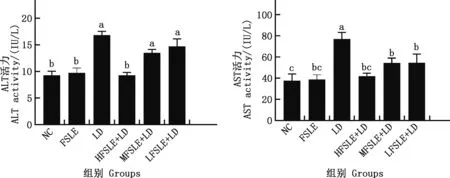
肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below图6 FSLE对小鼠血清AST和ALT活性的影响Fig.6 Effect of FSLE on the activity of serum AST and ALT in mice
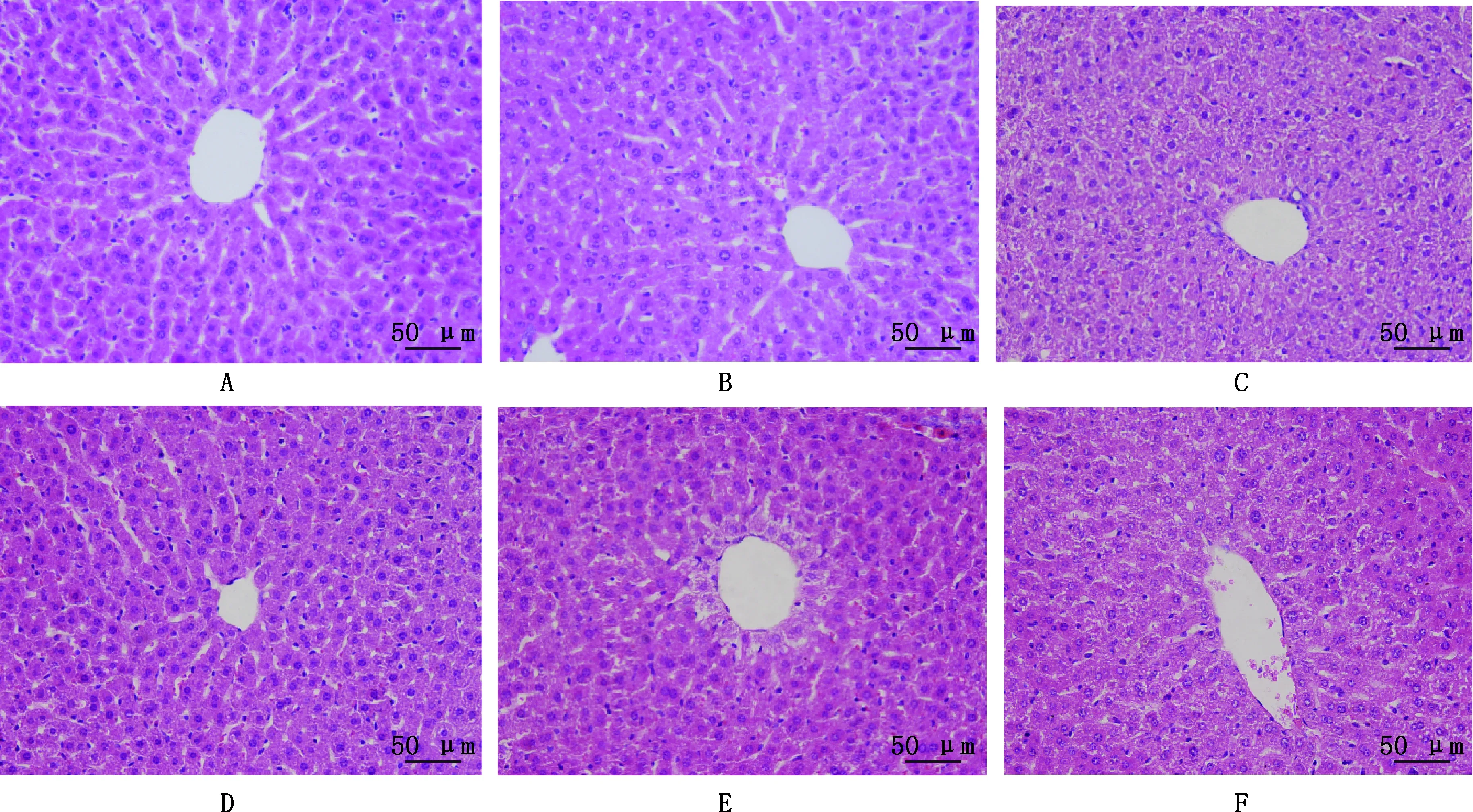
A~F,分别为NC、FSLE、LD、HFSLE+LD、MFSLE+LD和LFSLE+LD组A-F,NC,FSLE,LD,HFSLE+LD,MFSLE+LD and LFSLE+LD groups,respectively图7 FSLE对小鼠肝脏组织病理学变化的影响(HE,400×)Fig.7 Effect of FSLE on histopathological changes of mouse liver (HE,400×)
2.4 FSLE对小鼠肝损伤关键靶点AMPKα1和AMPKα2表达的影响
2.4.1 FSLE对小鼠肝损伤AMPKα1和AMPKα2基因表达的影响 由图8可知,与NC相比,LD组AMPKα1和AMPKα2基因mRNA表达量均显著下降(P<0.05);与LD组相比,HFSLE+LD组可显著上调AMPKα1和AMPKα2基因mRNA表达量(P<0.05)。
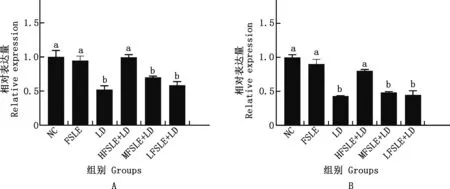
图8 FSLE对AMPKα1(A)和AMPKα2(B)基因mRNA表达水平的影响Fig.8 Effects of FSLE on AMPKα1 (A) and AMPKα2 (B) genes mRNA expression levels
2.4.2 FSLE对小鼠肝损伤关键靶点AMPK蛋白表达的影响 由图9可知,与NC组相比,LD组小鼠肝脏的AMPK蛋白表达量显著下降(P<0.05);与LD组相比,HFSLE+LD组可显著提高AMPK的蛋白表达量(P<0.05)。
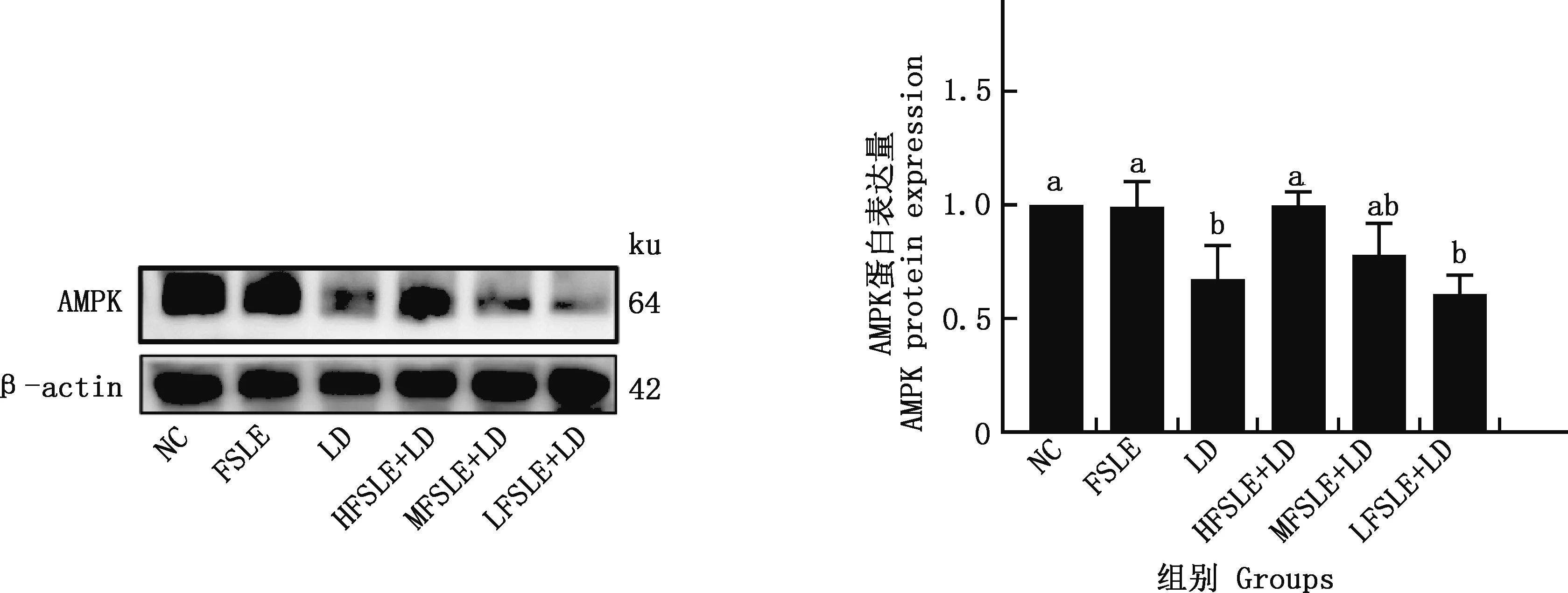
图9 FSLE对AMPK蛋白表达水平的影响Fig.9 Effects of FSLE on AMPK protein expression levels
2.5 FSLE对小鼠肝脏氧化应激水平的影响
由图10可知,与NC组相比,LD组小鼠肝脏SOD活性及GSH含量显著降低(P<0.05),小鼠肝脏MDA及H2O2含量显著升高(P<0.05);与LD组相比,HFSLE+LD组小鼠肝脏SOD活性及GSH含量显著上升(P<0.05),HFSLE+LD、MFSLE+LD小鼠肝脏MDA及H2O2含量显著降低(P<0.05),且HFSLE+LD组基本达到正常水平。表明FSLE对ENR诱导的小鼠肝损伤的保护作用可能与其提高机体抗氧化应激水平有关。
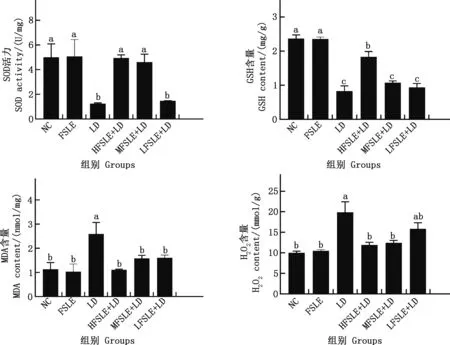
图10 FSLE对小鼠肝脏氧化应激水平的影响Fig.10 Effect of FSLE on the level of oxidative stress in mouse liver
3 讨 论
本研究基于LC-MS分析及网络药理学,对FSLE治疗EILI进行研究。通过LC-MS分析鉴定出30种黄酮类化合物和1种萜类化合物。研究表明,黄酮类化合物和萜类化合物均有显著的肝脏保护作用[22-23]。根据胃肠吸收和类药性,筛选出20种活性较高的成分参与调控EILI,排名靠前的主要包括甜橙黄酮、山奈素和桔皮素。通过网络药理学筛选出核心靶点12个,即MAPK1、MAPK3、ESR1、PIK3CA、HSP90AA1、SRC、APP、PIK3R1、MAPK8、EGFR、VEGFA和AKT1。FSLE治疗EILI可能是通过这些核心靶点来实现的。通过KEGG通路富集分析并构建“成分-靶点-信号通路”可视化网络显示,AMPK信号通路[24]、p53信号通路[25]和PPAR信号通路[26]都与肝损伤密切相关。其中AMPK信号通路具有多种重要的生物学功能,其生物功能主要包括蛋白质合成、核糖体蛋白翻译、脂肪酸合成、线粒体生物合成氧化代谢、脂肪酸氧化和脂肪酸摄取[27],在酒精性脂肪肝损伤[28]、氧化应激造成的肝损伤[29]及药物性肝损伤[30]的治疗中都发挥着重要作用。
在肝脏中,ALT主要存在于细胞浆内,AST主要存在于肝细胞线粒体中,当肝细胞受到损害时,细胞内的ALT和AST会释放到血液中,故血清中的ALT和AST水平会增加,因此ALT和AST为评价肝损伤的常用指标[31]。本试验结果显示,ENR可显著提高小鼠血清中ALT和AST的活性,结合病理切片结果,如肝细胞水肿、核溶解、坏死及炎性细胞浸润等,说明EILI模型成功建立。FSLE可显著降低小鼠血清中ALT和AST活性,改善肝细胞水肿和坏死等现象,提示FSLE能有效恢复EILI小鼠的肝脏功能指标。刘静[20]通过腹腔注射CCl4诱导的小鼠急性肝损伤模型中,小鼠血清ALT和AST活力显著升高,当给予FSLE后,小鼠血清ALT和AST活力显著降低,这与本试验结果一致。
AMPK是一种调节能量稳态及代谢应激的能量传感器,在热休克、氧化应激和缺血的条件下被激活[32]。研究表明,AMPK在线粒体合成、线粒体氧化应激中发挥重要的作用[33]。AMPK的激活通过上调线粒体抗氧化酶表达[34],加速线粒体更新[35],维持正常线粒体形态[36],导致细胞线粒体活性氧(reactive oxygen species,ROS)生成减少,减轻氧化应激。在本试验中,FSLE可显著上调EILI小鼠肝脏AMPK基因和蛋白的表达。这与王春丽[37]发现的菊花提取物通过激活AMPK通路缓解氧化应激、减轻肝损伤的结果基本一致。
肝脏是机体内以代谢和合成功能为主的器官,每个肝细胞中含上千个线粒体,线粒体是产生ROS的主要细胞器[38]。因此,肝脏既易产生ROS,但也易受ROS的攻击。研究表明,ROS可导致蛋白质修饰、脂质过氧化和核酸损伤。脂质过氧化一旦开始,即会进行链式反应,直到生成脂质过氧化产物,如MDA[39]。MDA是一种常用的生物标记物,用于评价生物体内的氧化应激水平,间接反映细胞损伤的程度[40]。SOD是一种重要的抗氧化酶,SOD活力的高低间接反映了机体清除氧自由基的能力[41]。SOD通过歧化反应,将氧自由基转化为H2O2与O2,故在一定程度上SOD活力的高低可说明机体对抗氧化应激的能力。GSH是细胞内天然的抗氧化酶,对维持细胞的氧化还原平衡十分重要[42]。GSH耗竭后可导致脂质的过氧化,引起肝细胞损伤[43]。在本试验中与LD组相比,FLSE显著提高EILI小鼠肝脏中SOD活力和GSH含量,降低H2O2和MDA含量。LFSLE+LD组MDA浓度显著降低,可能是FSLE对MDA的敏感性较高,这可能与连翘叶清除脂质能力有关[44]。朱淑云[21]通过四氧嘧啶诱导小鼠产生氧化损伤,致使小鼠肝脏中MDA显著升高,SOD显著降低,当给予FSLE后,MDA显著降低,SOD显著升高,与本试验结果基本一致。
4 结 论
本研究通过网络药理学筛选到FSLE可能主要通过AMPK信号通路发挥抗EILI的作用。动物体内试验表明,FSLE可显著降低小鼠血清ALT和AST活力,可能通过上调AMPK基因和蛋白的表达来减轻肝脏的氧化应激,从而发挥抗EILI的作用。
