三乙醇胺的电化学降解研究
2022-06-05尤雨婷白钰婷周婉秋康艳红
尤雨婷, 白钰婷, 周婉秋, 康艳红
(沈阳师范大学化学化工学院,辽宁沈阳 110034)
三乙醇胺(Triethanolamine,TEA)是一种链烷醇胺,在工业生产中应用广泛,可以用作切削和金属加工液、缓蚀剂,以及工业试验、医药和化妆品中的乳化剂[1],水泥中的助磨剂[2]等。此外,三乙醇胺也是一种常用的络合剂,它可以和很多金属离子形成络合物,有助于化学反应的持续和平稳进行[3]。但在生产过程中含三乙醇胺络合剂的重金属离子的废液,不能通过酸碱中和沉淀法沉淀完全,达不到排放标准,以至于不能直接排放。所以对含有三乙醇胺的废水进行处理研究,是十分必要的。
目前对三乙醇胺的处理方法有微生物法[4]、化学氧化法[5]、Fenton氧化法[6]、超声波-Fenton氧化法[7]等。上述方法虽然对三乙醇胺的降解有一定效果,但存在降解速率低、氧化剂用量过多、容易产生沉淀、操作复杂等缺点。目前采用电化学方法对三乙醇胺进行降解鲜有报道。电化学水处理技术是一种绿色水处理技术,其主要原理是利用电位差调控电子流向,使得污染物质在电极界面或溶液中完成降解或转化过程,以实现水质净化[8 - 12]。本文采用电化学方法对三乙醇胺进行降解研究,分别探讨三乙醇胺电化学窗口信息,以及通过气相色谱-质谱法分析三乙醇胺电化学降解产物,并推测其降解途径。
1 实验部分
1.1 仪器及试剂
CHI620E电化学工作站(上海辰华仪器有限公司);GYDF 50A/24V高频开关电源(北京华泰众合科技有限公司);GCMS-QP2020气相色谱-质谱联用仪(日本,岛津公司)。
三乙醇胺(TEA,沈阳市新化试剂厂);NaCl、HCl、H2SO4(国药集团化学试剂有限公司);无水 Na2SO4(无锡市亚泰联合化工有限公司);无水乙醇(天津市恒兴化学试剂制造有限公司)。实验试剂均为分析纯,所有溶液配制用水均为二次蒸馏水。
1.2 实验方法
1.2.1 三乙醇胺的电化学窗口信息用电化学工作站,采用循环伏安法获得三乙醇胺的电化学窗口信息。以玻碳电极(φ=2 mm)为工作电极,铂片(5×5 mm2)为对电极,Hg/Hg2SO4为参比电极构成三电极体系。三电极间距为1.5 cm。每次取20 mL一定浓度的三乙醇胺溶液。支持电解质分别为HCl、NaCl、Na2SO4、H2SO4溶液,浓度均为0.01 mol·L-1。对含有不同支持电解质的三乙醇胺溶液分别进行循环伏安扫描,选出最佳电解质,并扫描不同浓度和次数条件下的三乙醇胺溶液。
1.2.2 电化学降解三乙醇胺采用自制电极反应器对三乙醇胺溶液进行降解,其中阴极、阳极均为石墨极板,极板有效面积为7×7 cm2,隔膜为阴离子膜。槽体长宽高为16.5 cm×11.0 cm×12.0 cm,有效容积为14.5 cm×8.5 cm×6.0 cm,外加高频开关电源控制电压和电流,并带温度控制外循环系统。采用上述实验装置,分别取400 mL 0.04 mol·L-1三乙醇胺溶液(1 g·L-1Na2SO4)于阴极室和阳极室中,极距为2 cm,溶液用稀H2SO4调节初始pH为3~4后,在一定电位下对三乙醇胺溶液进行电解,电解过程中不断搅拌,并且每隔一定时间取样,平行测量三次,取平均值。
1.2.3 三乙醇胺降解产物分析利用气相色谱-质谱法分析降解过程中的产物。气相色谱条件:HP-5MS色谱柱;进样口温度250 ℃;载气为氦气,流速1.5 mL/min;分流比30:1;进样量1.0 μL;溶剂(无水乙醇)延迟2.0 min;程序升温至80 ℃保持5 min后,以30 ℃/min升至200 ℃,保持5 min,再以50 ℃/min升至260 ℃,保持10 min。质谱条件:色谱-质谱接口温度为280 ℃;电离方式为电子轰击(EI);电离能量70 eV;扫描方式为全扫描(Scan);离子源温度:250 ℃[13]。
2 结果与讨论
2.1 三乙醇胺电化学窗口信息分析
2.1.1 支持电解质的选择利用电化学工作站研究Na2SO4、NaCl、HCl、H2SO4溶液4种不同电解质,分别对浓度为0.04 mol·L-1三乙醇胺电解的影响,并选取最佳的电解质。图1为三乙醇胺中分别加入Na2SO4、NaCl、HCl、H2SO4电解质的循环伏安曲线。图1(a)、1(c)、1(e)、1(g)为三乙醇胺发生氧化反应的循环伏安曲线。由图可知,三乙醇胺在该4种电解质中均有氧化峰的产生,且氧化峰都在电位范围为0.6~1.4 V内出现,说明三乙醇胺可在阳极发生氧化反应。在Na2SO4和NaCl电解质中,氧化峰电流在-0.8×10-4A左右,在HCl和H2SO4电解质中,氧化峰电流有明显的减小,分别为-0.6×10-4A和-0.3×10-4A左右,说明酸性电解质对三乙醇胺氧化产物的产生有一定影响。图1(b)、1(d)、1(f)、1(h)为三乙醇胺发生还原反应的循环伏安曲线。由图可知,三乙醇胺在该4种电解质中均没有还原峰的产生,推测为阴极没有还原产物的生成,只发生水的电解反应,生成H2。综上可以选择Na2SO4和NaCl作为降解三乙醇胺的支持电解质,但由于考虑到在实际生产生活应用中,Cl2的产生会对环境造成一定的污染,因此最终选择Na2SO4作为降解三乙醇胺的最佳支持电解质。

图1 三乙醇胺在Na2SO4(a)、NaCl(c)、HCl(e)、H2SO4(g)中氧化反应的循环伏安图;三乙醇胺在Na2SO4(b)、NaCl(d)、HCl(f)、H2SO4(h)中还原反应的循环伏安图Fig.1 Cyclic voltammograms of oxidation reaction of triethanolamine in sodium sulfate (a) sodium chloride (c) hydrochloric acid(e) sulfuric acid(g) and cyclic voltammograms of reduction reaction of triethanolamine in sodium sulfate(b) sodium chloride(d) hydrochloric acid(f) sulfuric acid(h)
2.1.2 三乙醇胺电化学性质分析采用循环伏安法研究不同浓度三乙醇胺的电化学性质,支持电解质为0.01 mol·L-1Na2SO4溶液。图2为不同浓度三乙醇胺氧化反应的循环伏安曲线。由图中可以看到,在电位0~1.4 V之间,随着三乙醇胺浓度的增大,其氧化峰也逐渐明显,峰电流逐渐增大。进一步证明,三乙醇胺可以在阳极发生氧化反应。图3为不同扫描次数下三乙醇胺氧化反应的循环伏安曲线。由图3可知,随着扫描次数增加,三乙醇胺的氧化峰逐渐减弱,峰电流逐渐减小,说明三乙醇胺在阳极产生的氧化产物对电极有钝化作用。

图2 不同浓度三乙醇胺的氧化反应的循环伏安图Fig.2 Cyclic voltammograms of oxidation reaction of triethanolamine with different concentrations

图3 不同扫描次数下三乙醇胺的氧化反应的循环伏安图Fig.3 Cyclic voltammograms of oxidation reaction of triethanolamine under different scanning times
2.2 三乙醇胺降解产物分析


图4 三乙醇胺阴极降解气相色谱图Fig.4 Gas chromatograms of triethanolamine degradation at the cathode
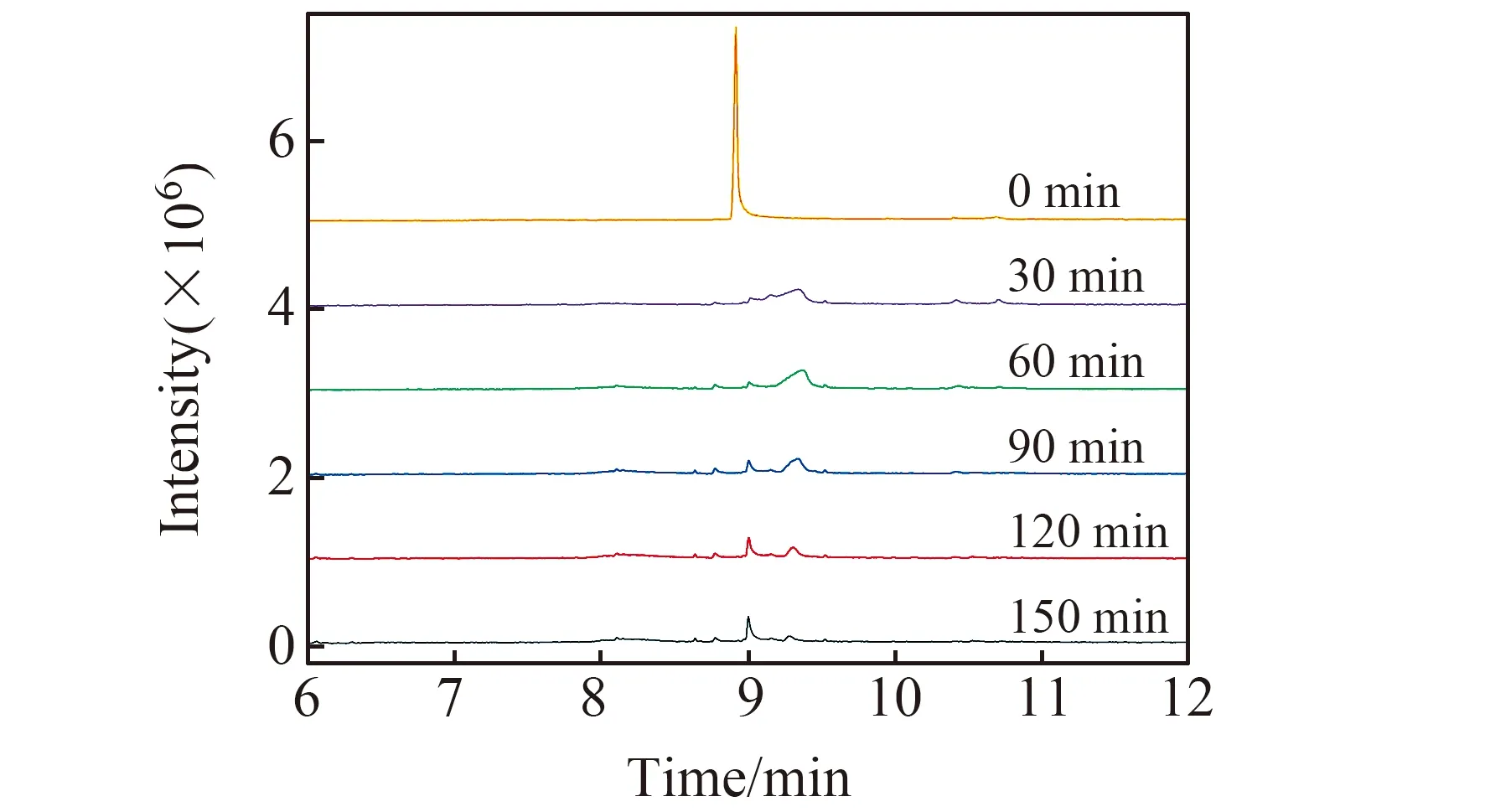
图5 三乙醇胺阳极降解气相色谱图Fig.5 Gas chromatograms of triethanolamine degradation at the anode
图6和图7分别为实验测得的三乙醇胺和其降解产物的质谱图,经过与标准图谱对照分析,推断得出三乙醇胺降解产物为N,N-二(2-羟基乙基)甲酰胺。
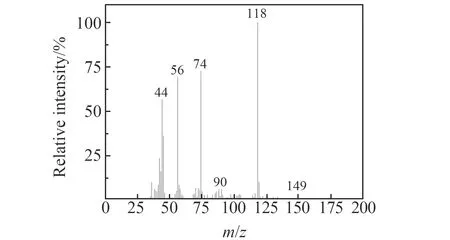
图6 三乙醇胺质谱图Fig.6 Mass spectrum of triethanolamine

图7 N,N-二(2-羟基乙基)甲酰胺的质谱图Fig.7 Mass spectrum of N,N-bis(2-hydroxyethyl)formamide
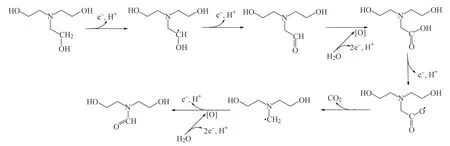
通过气相色谱-质谱分析,初步确认三乙醇胺降解产物的生成,由此推断出电化学降解三乙醇胺的可能过程如下。

3 结论
(1)采用循环伏安法,得到三乙醇胺的电化学窗口信息,在Na2SO4、NaCl、HCl、H2SO44种不同支持电解质溶液中,经实验选择Na2SO4为降解三乙醇胺的最佳支持电解质,并判断出三乙醇胺主要在阳极发生氧化反应。
(2)在反应时间为150 min,初始pH为3~4,极板间距为2 cm的条件下,对浓度为0.04 mol·L-1的三乙醇胺进行降解,通过气相色谱-质谱分析出三乙醇胺的电化学降解产物为N,N-二(2-羟基乙基)甲酰胺,并进一步推断出三乙醇胺可能的降解过程。
