超高效液相色谱-串联质谱法快速分析环境水样中的碘海醇和碘帕醇残留量
2022-06-05宋宁慧范义锋
张 爽, 宋宁慧, 范义锋, 李 旦
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.生态环境部南京市环境科学研究所,江苏南京 210042;3.广州智达实验室科技有限公司,广东广州 510535;4.无锡分子桥科技有限公司,江苏无锡 214021)
碘海醇(Iohexol)和碘帕醇(Iopamidol)属于第二代碘造影剂,是目前最为畅销的造影剂[1],其结构式如图1所示。通常在进行CT造影诊断前注入静脉,用于血管、泌尿系统、脊髓及股关节、淋巴系统造影,具有造影密度低,毒性低,耐受性好等优点,在发达国家已全面取代了离子型造影剂[1,2]。根据Newport数据,2018年全球碘海醇制剂规模超过12亿美元。中国医药工业信息中心数据显示,2019年国内X射线造影剂市场规模约为139.45亿元,其中碘帕醇的市场规模约为15.13亿元。然而,已有国外研究报道非离子型X射线造影剂,通过医疗废水、工业废水、患者尿液等途径进入地表水体,并在自然水环境中表现出持久性[3 - 5]。Pérez等[4]报道碘帕醇在原水、二级出水、地下水和地表水等水体中被检出,质量浓度分别为2.7 μg/L、15 μg/L、2.4 μg/L和0.49 μg/L。亦有研究[6 - 9]表明,碘帕醇易在饮用水处理过程中生成具有毒性转化产物,但其在环境中的迁移转化规律尚未明确。因此,需要对环境中,尤其是水体中典型碘化造影剂进行监测。
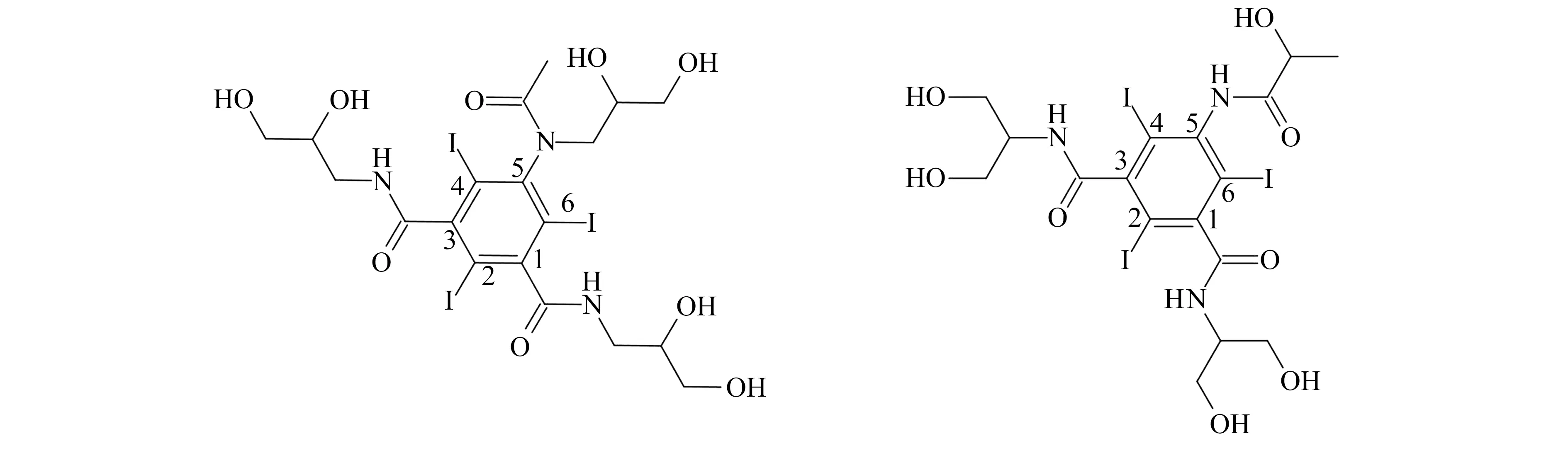
图1 碘海醇和碘帕醇的结构式Fig.1 Structural formulas of iohexol and iopamidol
已有的检测方法主要集中在碘海醇的检测中,包括高效液相色谱法(HPLC)[10 - 14]、液相色谱-串联质谱法(LC-MS/MS)[15 - 22],检测对象为注射液和血液样品。在血浆和血清的碘海醇检测中,利用HPLC法分析的时间为13~60 min,检出限在700~1 000 μg/L之内[10 - 13];利用LC-MS/MS法的分析时间为7.3~31 min,检出限在10.5~300 μg/L之内[17 - 22]。在注射液样品的碘海醇检测中,利用HPLC法的分析时间为13~30 min,检出限在500 μg/L之内[14,15];利用LC-MS/MS的分析时间为30 min,检出限在25 μg/L之内[16]。张美微等[22]利用LC-MS/MS法对血浆中的碘帕醇进行了检测,方法使用含0.1%甲酸-5 mmol九氟戊酸-10%乙腈水溶液为流动相进行等度洗脱,定量限为1 000 μg/L。在水质风险监测中,潜在危害物的量级往往在μg/L或者ng/L水平,因此针对地表水水样,建立了碘海醇和碘帕醇的液-液萃取前处理,结合LC-MS/MS检测方法,适合水样中有害物的快速、准确、高通量定性定量分析,尤其适合转化为全自动在线处理与检测系统。
1 实验部分
1.1 主要仪器与试剂
QTRAP 5500三重四极杆复合线性离子阱液-质联用系统(美国,AB Sciex公司);Vortex Genie2涡旋混合器(美国,Scientific Industries公司);Eppendorf移液器(德国,Eppendorf公司)。
碘海醇(纯度98.0%)、碘帕醇(纯度98.0%)标准品购自默克美国Sigma试剂公司。分别准确称量100.0 mg碘帕醇、碘海醇标准品于100 mL容量瓶中,用50%乙腈水溶液溶解后,配制成1.0 g/L混合标准品储备溶液,于-20 ℃储存。混合标准品工作溶液:用50%乙腈水溶液将混合标准品储备溶液稀释为0.01、0.05、0.2、0.5、2、10、50、100 μg/L混合标准系列溶液,待用。乙腈(质谱纯,美国Fisher公司),甲酸(质谱纯,默克美国Sigma试剂公司)。实验室用水为Millipore纯水系统制备(电阻率为18.2 MΩ·cm)。
地表水和地下水水样均取自造影剂生产企业所在工业园区周边的河流、地下水中。其中,基质空白样品,取自该工业园区50公里外的上游河流、地下水采样点。
1.2 样品前处理
准确移取5 mL水样于15 mL离心管中,加入5 mL乙腈,涡旋提取2 min,4 ℃下12 000 r/min离心10 min,取上清液过0.22 μm聚四氟乙烯滤膜,待上机检测。
1.3 色谱分析条件
色谱柱为PHNOMON Kinetex F5(100 mm×3 mm,2.6 μm);柱温40 ℃;流动相A为0.1%甲酸水溶液,B为乙腈。梯度洗脱程序为:0.0~0.5 min,95%A;0.5~3.5 min,95%A~35%A;3.5~4 min,35%~5%A,4~5 min,5%A;5~6.5 min 95%A。流速为0.4 mL/min。
1.4 质谱分析条件
电喷雾离子源(ESI):正离子扫描;气帘气:241 kPa,雾化气:414 kPa,加热气:414 kPa,源温:550 ℃,电喷雾电压:5 500 V。多反应检测(MRM)条件如表1所示。
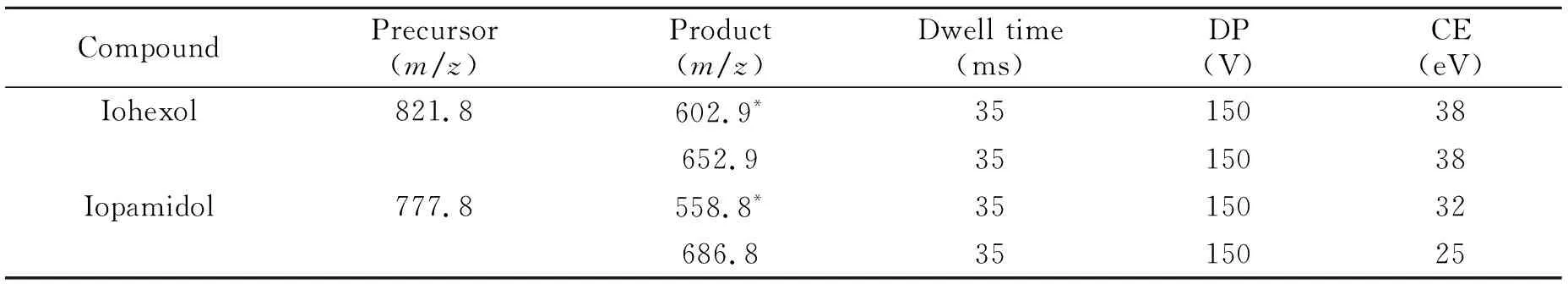
表1 碘海醇和碘帕醇的MRM质谱参数
优化条件下,碘海醇和碘帕醇的定性、定量离子色谱图如图2所示。由图2可见,峰形尖锐,每个离子对检测下色谱峰中采集点数均大于25个,满足准确定量要求。
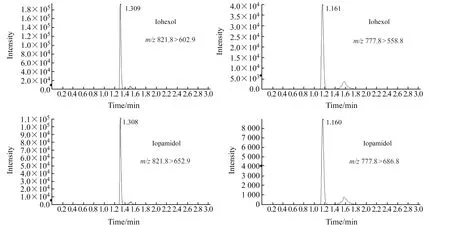
图2 碘海醇和碘帕醇的提取离子色谱图Fig.4 Extraction ion chromatogram of iohexol and iopamidol
2 结果与讨论
2.1 碘海醇与碘帕醇的质谱分析条件的优化
分别将浓度为0.1 mg/L的碘海醇和碘帕醇标准溶液,利用针泵注射进样。在正离子模式下,分别得到碘帕醇准分子离子峰[M+H]+m/z777.8,碘海醇准分子离子峰[M+H]+m/z821.8。在碰撞能量为30 eV下进行二级质谱分析,碘海醇和碘帕醇的前体离子经过碰撞诱导解离(CID)后,分别产生了9个和5个碎片离子。碘海醇形成了显著的脱水峰[M+H-H2O]+m/z803.8。准分子离子峰脱去乙酰基形成[M+H-C2H3O]+m/z779.8,再脱去邻位碘形成[M+H-C2H3O-I]+m/z652.9。准分子离子峰脱去1个2,3-二羟基丙基形成[M+H-C3H7O2]+m/z730.8,脱去1个2,3-二羟基丙基和1个氢碘酸形成[M+H-C3H7O2-C6H10O3N]+m/z602.9。碎片离子m/z602.9和m/z652.9均为重排的成环离子,相对稳定,是除脱水峰外相应最强的两个碎片离子。因此,选择m/z821.8/m/z602.9为定量离子对,m/z821.8/m/z652.9为定性离子对,建立碘海醇的MRM质谱检测方法。碘帕醇同样形成了脱水峰[M+H-H2O]+m/z759.8。碘帕醇准分子离子峰脱去1,3-二羟基丙胺形成[M+H-C3H8O2N]+m/z686.8,再脱去一个氢碘酸,形成[M+H-C5H8O3N-HI]+m/z558.5。选择m/z777.8/m/z558.8为定量离子对,m/z777.8/m/z686.8为定性离子对。
2.2 色谱分离条件的选择
首先,在流动相中添加了0.1%的甲酸,以增强ESI正离子模式下碘海醇和碘帕醇的准分子离子峰[M+H]+离子化程度,并使色谱峰峰形更加尖锐和对称。碘海醇和碘帕醇均含碘,为强卤代极性化合物。PHNOMON Kinetex F5色谱柱(PFP柱)的填料颗粒是在硅烷基上键合一个五氟苯基,对于碘海醇和碘帕醇的保留机制与WATERS AQUITY BEHC18柱(C18)柱相似,但选择性不同。PFP色谱柱对极性目标的保留能力强,特别是对卤族化合物。因此,分别采用C18色谱柱和PFP色谱柱进行色谱分离,利用碘海醇和碘帕醇的定性离子对和定量离子对进行扫描监测。实验结果如图3所示,C18色谱柱分离碘海醇和碘帕醇的保留时间分别为0.75 min和0.72 min,而PFP色谱柱分别为1.31 min和1.16 min,说明两种色谱柱对目标物的保留能力不同,PFP色谱柱对碘海醇和碘帕醇的保留能力更强。同时,在两种色谱柱分离下,碘海醇与碘帕醇的色谱峰半峰宽具有显著差异。在PFP色谱柱分离下,碘海醇和碘帕醇的定量离子对色谱峰的半峰宽分别为0.042、0.035 min,相较于C18色谱柱分离下分别减少了63.2%和44.4%。因此,说明PFP色谱柱更适合用于含碘、具有多重共轭结构、强极性的碘海醇和碘帕醇的分析。最终,将色谱方法优化为总时长6.5 min,有效洗脱分离时间为3.5 min,有利于大规模环境样品的高通量、快速、准确的定性定量分析。
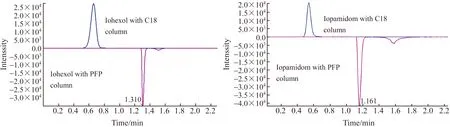
图3 碘海醇和碘帕醇的色谱分离条件的优化Fig.3 Effect of C18 column and pentaflurophenyl (PFP) column on separation of iohexol and iopamidol
2.3 基质效应、标准曲线、定量限
分别以地下水、地表水基质制备标准曲线,用基质标准曲线的斜率与溶剂标准曲线的斜率之比评估基质效应(ME)[23]。当0.8≤ME≤1.2时为无明显基质效应,ME<0.8时为基质抑制效应,ME>1.2时为基质增强效应。结果表明,碘海醇(0.01~20 μg/L)和碘帕醇(0.2~50 μg/L)在3种基质内线性良好,相关性系数(r)≥0.9956。地下水基质中,碘海醇和碘帕醇的ME分别为1.02和0.95,在地表水基质中分别为0.88和1.00,表明地表水和地下水基质对碘海醇和碘帕醇的定量结果不存在显著影响,可以直接采用溶剂标准曲线进行定量分析。通过对标准溶液进行逐级稀释进样,本方法对碘海醇的检出限(S/N=3)为0.004 μg/L,定量限(S/N=10)为0.01 μg/L;对碘帕醇的检出限为0.05 μg/L,定量限为0.50 μg/L。结果见表2。
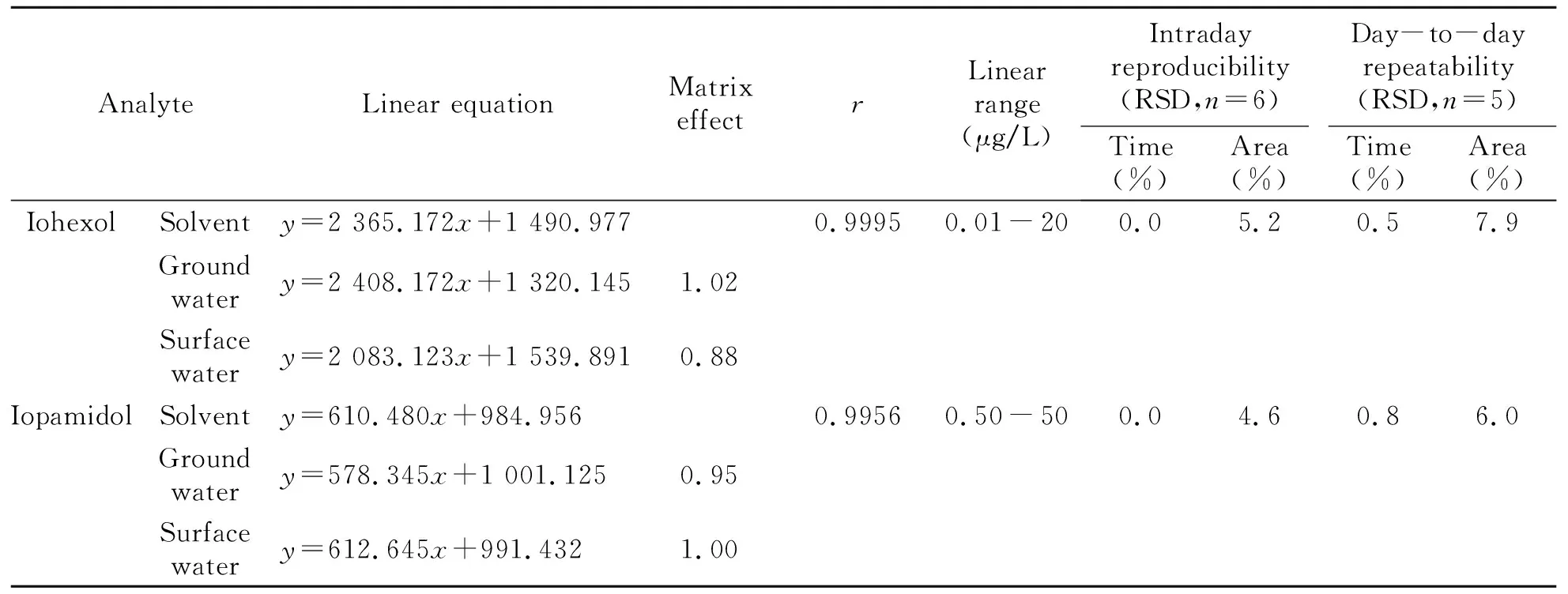
表2 线性方程和重现性
2.4 准确度和精密度
分别向地下水、地表水空白样品中添加0.5、5、10 μg/L碘海醇和碘帕醇标准,进行3个添加水平的加标回收试验,每个水平重复5次,计算回收率和相对标准偏差(RSD)。结果见表3,两种目标物在不同地表水样品中的回收率在84.1%~109.1%之间,RSD为4.1%~9.3%。
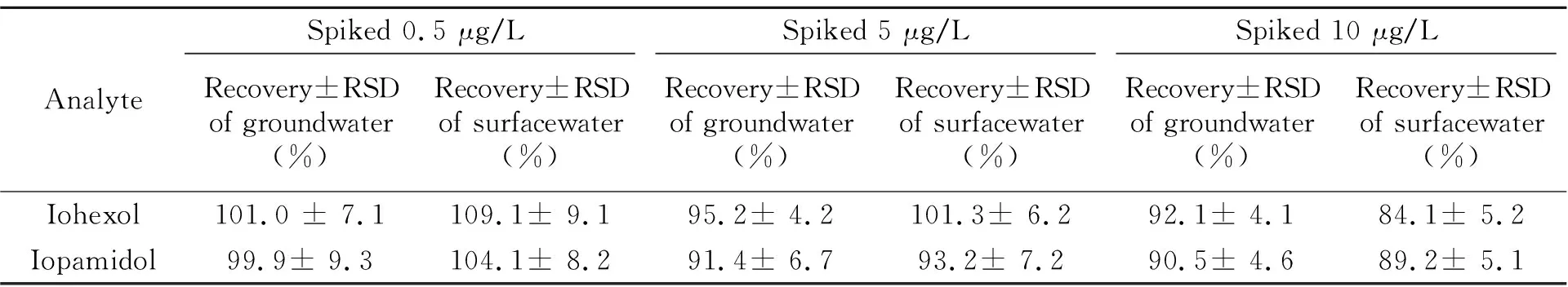
表3 回收率实验结果(n=5)
2.5 实际样品的检测
利用建立的UPLC-MS/MS分析方法,对某工业园区及周边河流、地下水等40个采样位点的水样进行了检测,在工业园区地下水水样中检出碘海醇1.2 μg/L,碘帕醇5.1 μg/L。
3 结论
本研究解析了碘海醇、碘帕醇的质谱行为,选择了最具结构代表性的特征离子对作为定性、定量离子对。优化了碘海醇和碘帕醇的色谱分离条件,建立了超高效液相色谱-串联质谱测定水体中碘化造影剂的方法。该方法前处理简便,检测限低,灵敏度高,重现性好。为水体中碘化造影剂的监测提供了方法学依据,为相关全自动在线处理与检测系统提供了支持方案。
