高效液相色谱-原子荧光光谱法测定土壤中4种有效砷形态
2022-06-05范俊楠田文娟贺小敏严文佩梁龙飞
范俊楠, 田文娟, 张 钰, 贺小敏*, 严文佩, 张 蒙, 梁龙飞
(1.湖北省生态环境监测中心站,湖北武汉 430072;2.湖北省计量测试技术研究院,湖北武汉 430223;3.湖北省地质局地球物理勘探大队,湖北武汉 430056)
砷是一种广泛存在于自然界中的类金属元素,而且不同价态的砷具有不同的生物毒性。砷会在人体组织中蓄积,引发慢性砷中毒,继而引起消化系统、神经系统、皮肤等病变甚至癌变[1]。砷在地壳中的丰度约为5 mg/kg,我国土壤中砷元素的背景值范围为2.5~33.5 mg/kg,中位值约9.6 mg/kg[2]。自然界中已发现的含砷化合物有50多种,它们的生物毒性大小不仅取决于浓度水平,还与其存在的形态密切相关。一般来说无机态砷的毒性较强,但近年来研究发现,有机态砷代谢过程中产生的中间体一甲基砷(MMA)、二甲基砷(DMA)也具有一定程度的生物毒性[3]。研究表明,土壤中重金属总量并不能直接地反映土壤重金属的生物有效性和环境效应,赋存形态决定其在土壤中的迁移性、生物可利用性以及毒性[4]。
土壤环境中有效砷主要是氧化条件下的砷酸根(As(Ⅴ))和还原条件下的亚砷酸根(As(Ⅲ)),以及在土壤微生物的作用下代谢产生的MMA、DMA、砷甜菜碱(AsB)、砷胆碱(AsC)等[5]。各形态富集砷在土壤中的移动转化、生物毒性及生物有效性在很大程度上取决于其在土壤环境中的存在形态,所以对土壤中砷的形态及其转化、土壤中砷形态分析方法的研究也尤为重要和迫切。采用分离富集技术和特征元素检测技术联用,以达到不同形态砷的检测目的是有效砷形态检测方法的发展趋势。高效液相色谱法与电感耦合等离子质谱(HPLC-ICP-MS)联用技术,具有灵敏度高、检出限低、线性范围宽等优点,近年来成为元素形态检测主要手段之一,但在实际的应用中,因仪器设备价格昂贵、操作复杂、对检测样品要求较高等原因,使其在应用和推广上受到了一定的限制。高效液相色谱法与原子荧光光谱(HPLC-AFS)联用技术检测有效砷形态的灵敏度、检出限具有与HPLC-ICP-MS基本相当甚至更优,同时还具有仪器价格低廉,操作简便、样品基体干扰小等优点,在有效砷形态检测领域更容易被应用和推广。
1 实验部分
1.1 仪器与试剂
HPLC-AFS联用仪(聚光科技(杭州)股份有限公司),配SAP-50-LC型形态分析液相色谱装置、AFS-9330型原子荧光光度计、Autosampler5500型自动进样器;UPR-11-20L型超纯水器(四川优普超纯科技有限公司);THZ-C型台式恒温振荡器(太仓市华美生化仪器厂);JA1103N型电子天平(上海民桥精密科学仪器有限公司)。
标准物质:As(Ⅲ)标准溶液(1.011 μmol/g,以As计);As(Ⅴ)标准溶液(0.233 μmol/g,以As计);MMA标准溶液(0.335 μmol/g,以As计);DMA标准溶液(0.706 μmol/g,以As计),均购自于中国科学计量研究院。HCl、KOH、KBH4、KH2PO4、(NH4)2HPO4、NH3·H2O、甲酸等试剂均为分析纯,购自于国药集团药业股份有限公司。实验用水满足国家标准(GB/T 6682-2008)中一级水要求。
1.2 样品制备与测试
按照(HJ/T 166-2004)《土壤环境监测技术规范》,分别在湖北省荆门市和恩施州采集筛选出5个不同pH和砷含量的土壤样品,样品代号为SMP01~SMP05。采样点位信息如下:SMP01(E112.66455,N31.16211)、SMP02(E112.65673,N31.20746)、SMP03(E109.77970,N30.17884)、SMP04(E112.29111,N31.42062)、SMP05(E109.57111,N30.28861)。采集的土壤样品经自然风干后,研磨过60目筛,储存于棕色磨口玻璃瓶中,备用。
按照(HJ 962-2018)《土壤pH值的测定 电位法》测定土壤样品pH值。称取土壤样品1 g(精确到0.001 g)于15 mL离心管中,根据测定的土壤样品pH值,加入预先用50%HCl或280 g/L KOH溶液进行调节好pH的KH2PO4溶液10 mL,于恒温振荡器上以25±5 ℃、210±10 r/min振荡提取120 min,再以3 000 r/min离心15 min,取上清液过0.45 μm滤膜后进行测定。以目标化合物的色谱保留时间定性,外标法定量。
1.3 仪器条件
液相色谱条件:Hamoltion PRP-X100阴离子交换柱(250 mm×4.1 mm i.d.,10 μm);流动相为(NH4)2HPO4溶液(1.725 g/L,pH=6.0±0.2);等度洗脱;流速为1.0 mL/min;进样体积为100 μL。
原子荧光光谱条件:空心阴极灯负高压为280~320 V,总电流为80~100 mA,辅阴极电流为40~50 mA;载气流量为400 mL/min;屏蔽气流量为600 mL/min;原子化器高度为8 mm;原子化器温度为200 ℃;载流为7%HCl;还原剂为20 g/L KBH4溶液,KOH溶液浓度为5 g/L。
2 结果与讨论
2.1 提取条件选择
土壤中有效砷的提取以提取水溶态和可交换态的含砷化合物为主。研究表明,水溶态的有效砷提取采用水∶甲醇(9∶1,V/V)或中性盐溶液(如KCl溶液)等;可交换态的有效砷,不同样品类型中有效砷的提取液有HCl、H3PO4、NaHCO3、Na2HPO4-KH2PO4、KH2PO4、KOH等溶液[6 - 10]。参考地方标准(DB35/T 1459-2014)《酸性土壤中有效砷、有效汞的测定 原子荧光法》,酸性土壤有效砷的提取液采用KH2PO4溶液,pH值在6.5~7.0的土壤也可参考使用[11]。对于pH>7.0的碱性土壤,实验考察了68.0 g/L的上述提取液,对预先加入了有效砷混合标准物质的土壤样品SMP04(pH=7.19)和SMP05(pH=8.20),加标浓度为0.5、5.0、10.0 mg/kg。按“1.2”、“1.3”进行试样制备与测试,各提取液对有效硒形态提取回收率平均值见图1。结果表明:提取液KH2PO4溶液对土壤样品有效砷形态提取效果优于其它提取液,回收率范围为62.7%~107%。其中,As(Ⅲ)的提取回收率范围为62.7%~86.7%、DMA为70.0%~89.7%、MMA为72.0~87.6%、As(Ⅴ)为86.3%~107%。
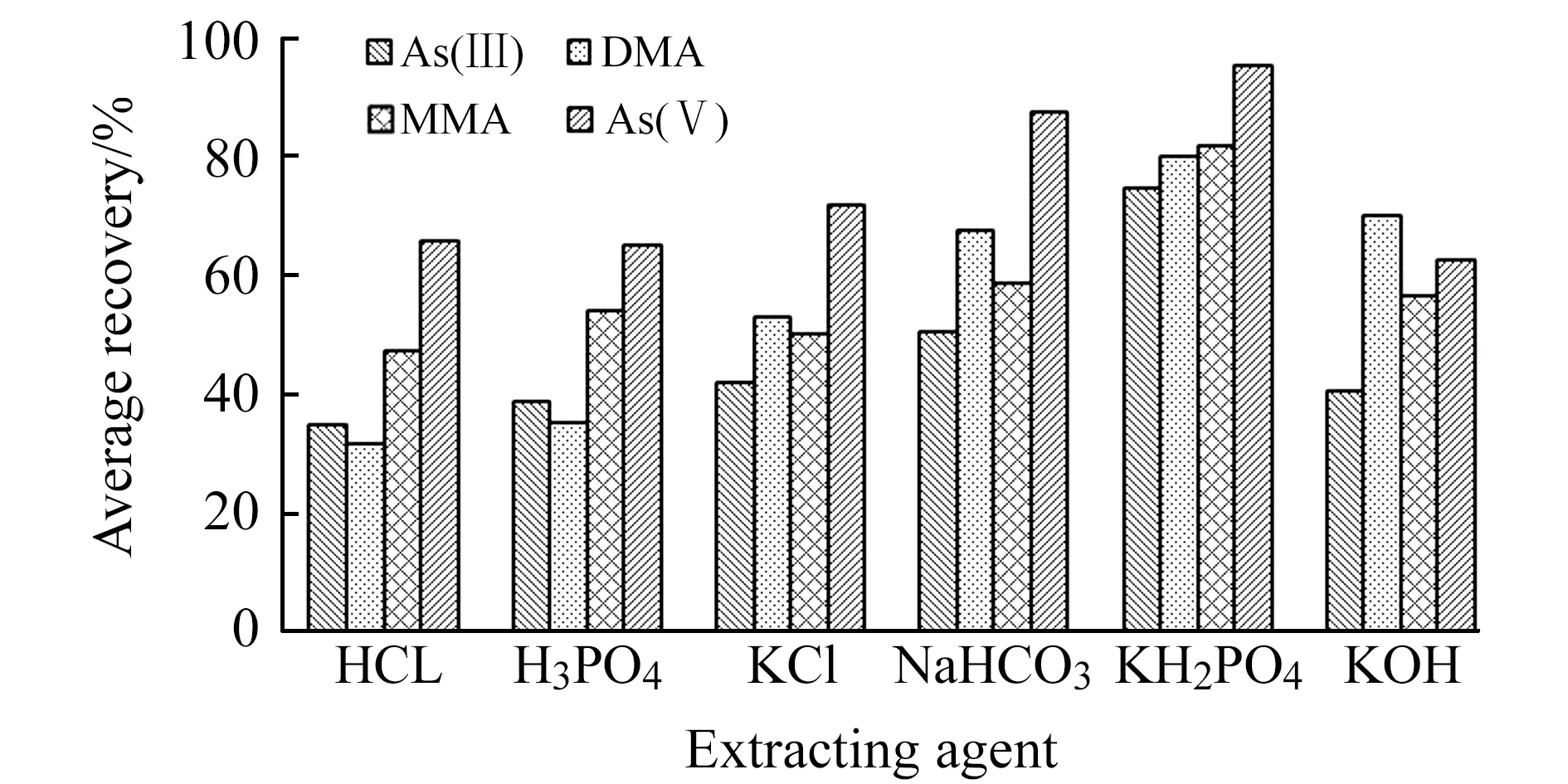
图1 不同提取液条件下有效砷形态平均回收率Fig.1 The average recovery of four arsenic species under different extraction conditions
土壤有效砷形态之间会随着pH值的变化而相互转化,提取液pH值调节对有效砷形态分析至关重要。提取液的pH选择应该保证在提取过程中不改变有效砷形态间的价态转化,以满足提取液的pH对不同酸碱度的土壤适用性,提取液的pH应与土壤的酸碱度尽可能的保持一致。实验考察了调节提取液的pH值,对预先加入了1.0 μg有效砷混合标准物质的SMP01~SMP05号土壤样品按“1.2”、“1.3”进行试样制备与测试。结果表明:未调节pH值的提取液相较于调节了pH的提取液对样品提取回收率变化在-9.6%~2.7%,提取液pH值的调节对As(Ⅴ)的提取效果的影响较其它组分明显。对于不同酸碱度的土壤,当土壤pH<4.0时,调节提取液pH至4.0;土壤pH为4.0~5.0时,调节提取液pH至5.0;土壤pH为5.0~6.0时,调节提取液pH至6.0;土壤pH为6.0~7.0时,调节提取液pH至7.0;土壤pH为7.0~8.0时,调节提取液pH至8.0;土壤pH>8.0时调节提取液pH至9.0。
2.2 仪器条件选择
2.2.1 色谱柱和流动相有效砷形态检测采用的液相色谱柱主要有C18和离子交换两种色谱柱,都能实现As(Ⅲ)、As(Ⅴ)、MMA、DMA 4种有效砷形态完全分离。但相比而言,离子交换柱对有效砷形态的分离效果优C18色谱柱,有效砷形态在阴离子交换柱的保留时间稳定,基线响应低[12,13]。本文参考国家标准(GB5009.11-2014)《食品安全国家标准食品中总砷及无机砷的测定》[14],采用阴离子交换柱Hamoltion PRP-X100(250 mm×4.1 mm i.d.,10 μm),以1.725 g/L的(NH4)H2PO4为流动相。
2.2.2 流动相pH值在不同pH值流动相条件下,有效砷形态的分离情况差异明显。实验考察了以1.725 g/L的(NH4)2HPO4为流动相,用甲酸或NH3·H2O调节pH分别为5.0、6.0、7.0、8.0,对50 μg/L有效砷形态的分离和检测信号响应情况。结果表明:当pH<5.0时,As(Ⅲ)和DMA不能完全分离,随着pH的增高,As(Ⅲ)和As(Ⅴ) 的保留时间基本不变,DMA的保留时间缓慢增加,MMA的保留时间缓慢缩短,当pH值为6.0时,4种有效砷形态基线分离达到最佳,且检测信号基本达到峰值(图2),这与韦丽丽等[15]、孟春英等[16]在类似的研究中流动相pH值分别选择5.8和6.0的研究结果基本一致。
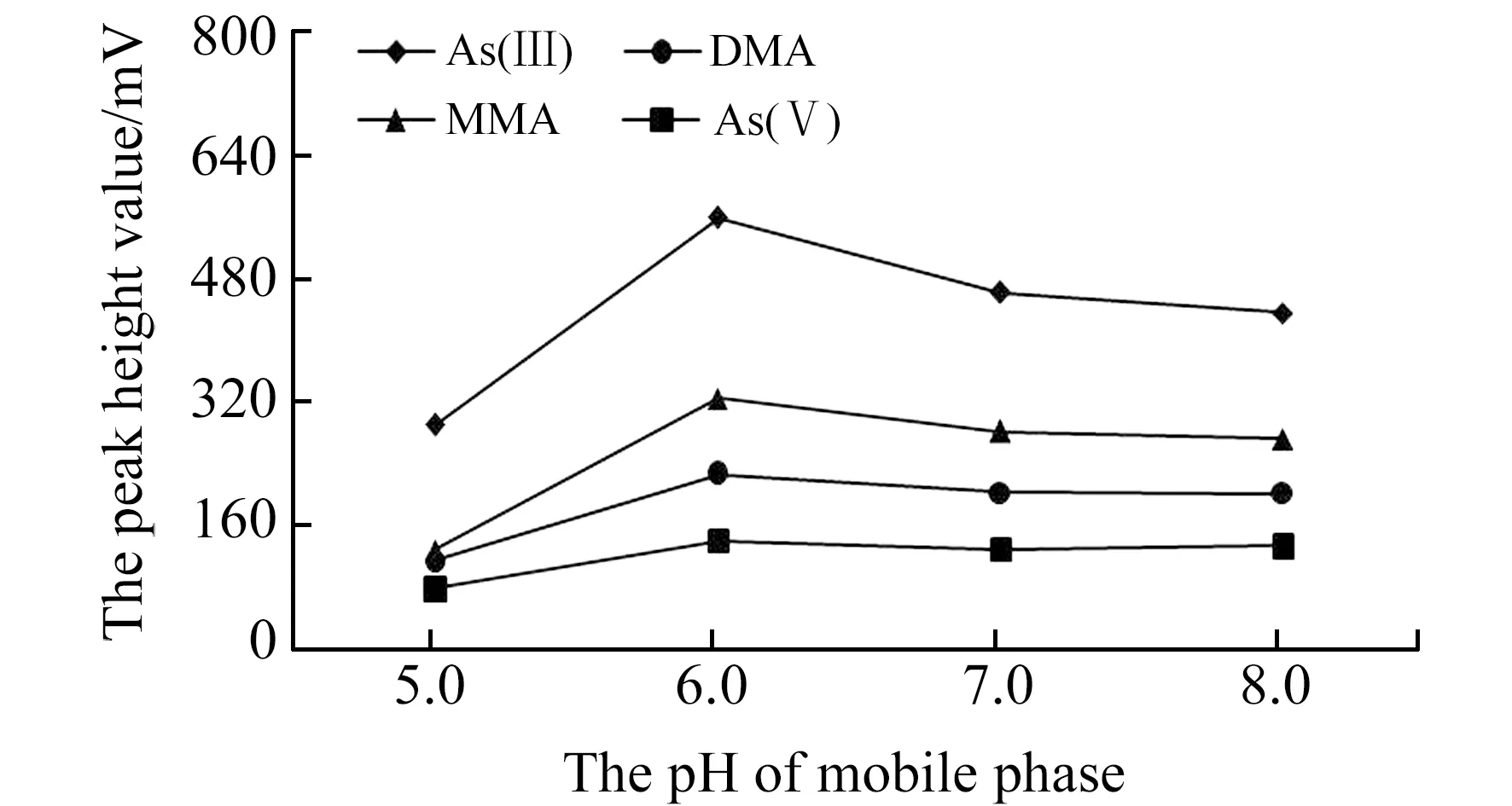
图2 不同pH值流动相条件下有效砷检测信号Fig.2 Four arsenic species detection signal in mobile phase with different pH
2.2.3 KBH4溶液浓度KBH4溶液浓度会影响气态氢化物产率、基线噪音和漂移,进一步影响有效砷形态检测灵敏度。本文考察了KBH4溶液分别为10、15、20、25 g/L条件下对50 μg/L的有效砷形态标准溶液检测情况(图3)。结果表明:随着KBH4浓度增大,气态氢化物产率增大,检测信号响应和信噪比也增大,当KBH4溶液大于20 g/L时,基线噪音和漂移增大,还原反应生成大量的氢气稀释了气态氢化物浓度,检测灵敏度降低,造成有效砷形态检测信号减小。相关研究表明土壤和水产品中的砷形态检测中KBH4溶液一般约15~20 g/L[13 - 17];食品和中药材样品一般约30 g/L[13],不同类型样品砷形态检测使用的KBH4溶液浓度有一定差异。
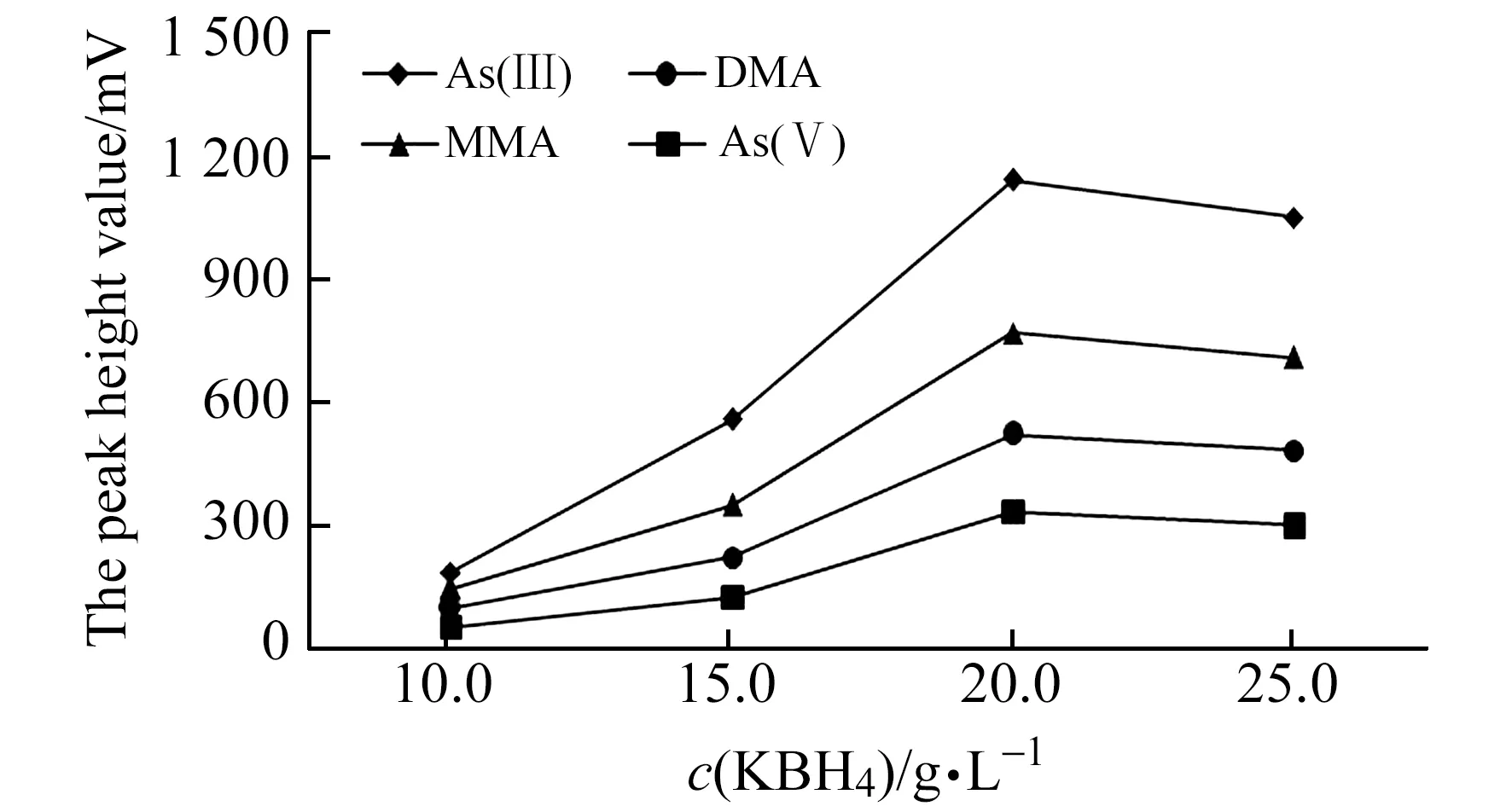
图3 不同KBH4浓度条件下有效砷检测信号Fig.3 Four arsenic species detection signal under different KBH4 concentration conditions
2.2.4 HCl浓度HCl为有效砷形态检测提供生成活性氢的H+,HCl浓度会影响气态氢化物产率。本文考察了HCl溶液体积分数分别为5.0%、7.0%、9.0%、10%条件下对50 μg/L的有效砷形态标准溶液检测情况(图4)。结果表明:随着载流HCl溶液体积分数的增加,有效砷形态检测信号响应增大,当HCl溶液体积分数大于7%时,有效砷形态检测信号响应无明显增大变化,还原反应所需的H+趋于饱和。相关研究表明土壤和水产品中的砷形态检测中HCl溶液体积分数一般约7%~10%[13,16,17],食品和中药材样品一般约20%[14,18],不同类型样品砷形态检测使用的HCl溶液浓度也存在一定差异。
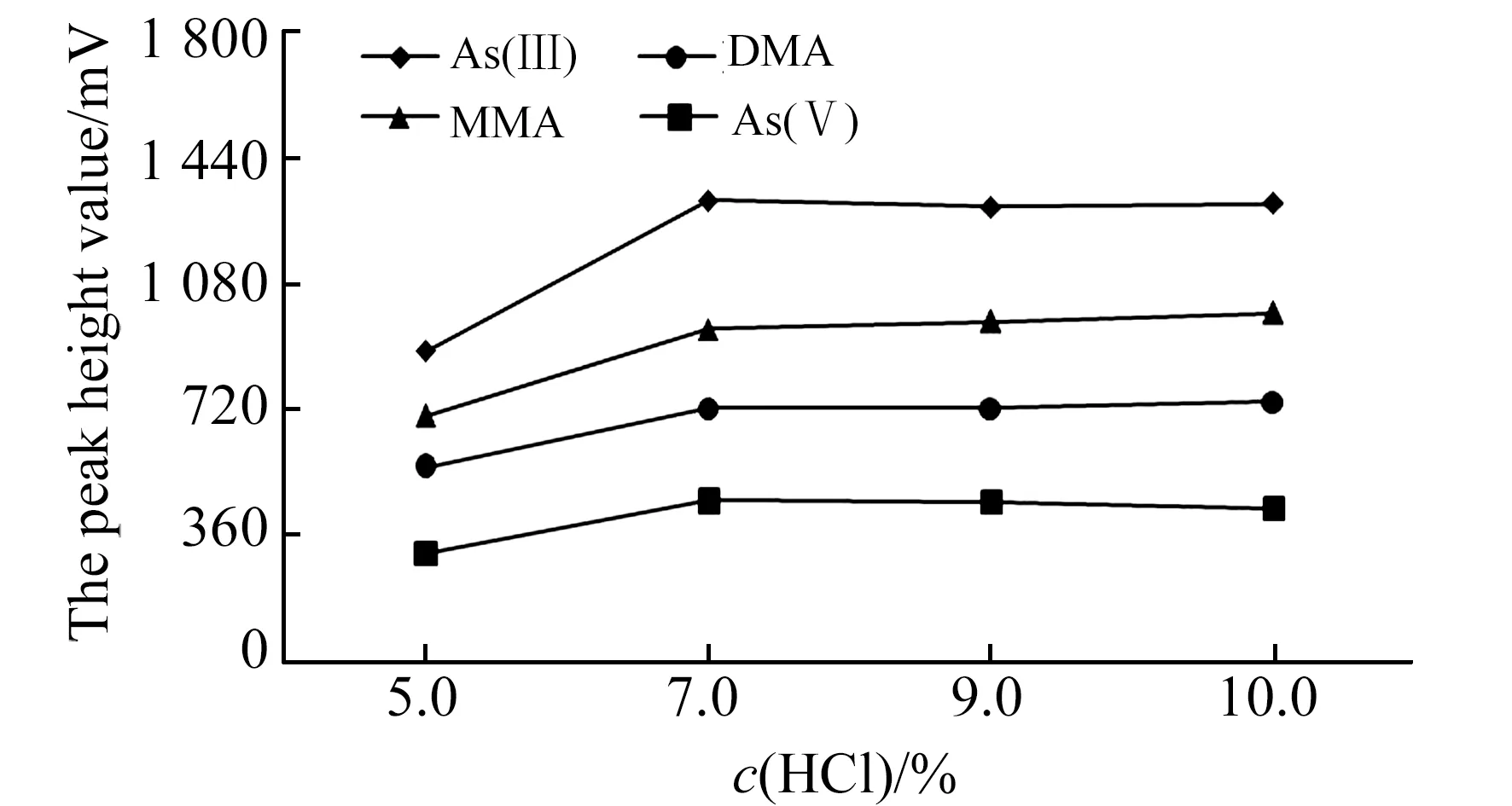
图4 不同HCl浓度条件下有效砷检测信号Fig.4 Four arsenic species detection signal under different HCl concentration conditions
2.3 校准曲线及检出限
配制含As(Ⅲ)、DMA、MMA、As(Ⅴ)的标准溶液系列,依次均为0、20、40、60、80、100 μg/L,浓度由低至高的顺序按照“1.3”仪器条件测定,以浓度为横坐标,荧光响应信号的峰高(或峰面积)为纵坐标,绘制校准曲线,计算校准曲线方程及相关系数(表1)。依据(HJ 168-2020)《环境监测 分析方法标准制修订技术导则》,实验室空白样品中未检测出目标物质可采用样品加标,加标浓度为估算检出限的2~5倍,按照样品分析的全部步骤测定7次,计算方法检出限(表1)。

表1 4种有效砷形态的保留时间、校准方程、相关系数及检出限
2.4 方法精密度和准确度
对土壤样品SMP01~SMP05添加0.5 mg/kg、5.0 mg/kg、10.0 mg/kg不同浓度的有效砷形态标准样品,按照“1.2”试样制备与测试和“1.3”仪器条件进行测定,计算6次平行测定结果的相对标准偏差(RSD)和加标回收率(表2)。实验结果表明:4种有效砷形态实验室内RSD范围为1.8%~17.2%,加标回收率范围为62.7%~107%。
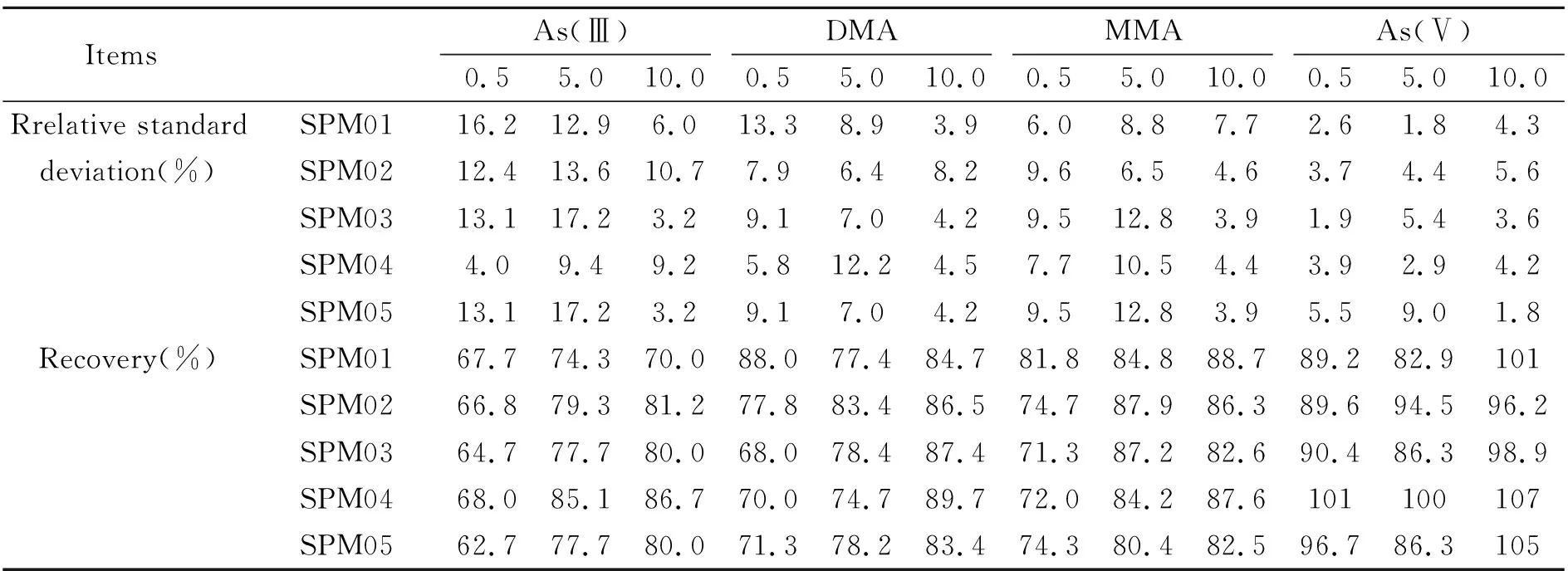
表2 4种有效砷形态的相对标准偏差和加标回收率(n=6)
2.5 样品测试
根据(GB/T22105.2-208)《土壤质量总汞、总砷、总铅的测定原子荧光法》和(DB35/T 1459-2014)《酸性土壤中有效砷、有效汞的测定 原子荧光法》测定土壤样品SMP01~SMP05总砷和有效砷含量;按照“1.2” 试样制备与测试和“1.3”仪器条件测定有效砷形态含量,结果见表3。土壤样品SMP01~SMP05中有效砷占总砷含量的24.1%~39.8%。土壤有效砷形态以As(Ⅴ)为主,占有效砷含量的66.6%~80.1%;As(Ⅲ) 含量水平与检出限相当,约占有效砷含量的3.0%,甚至更低;DMA和MMA均未检出。
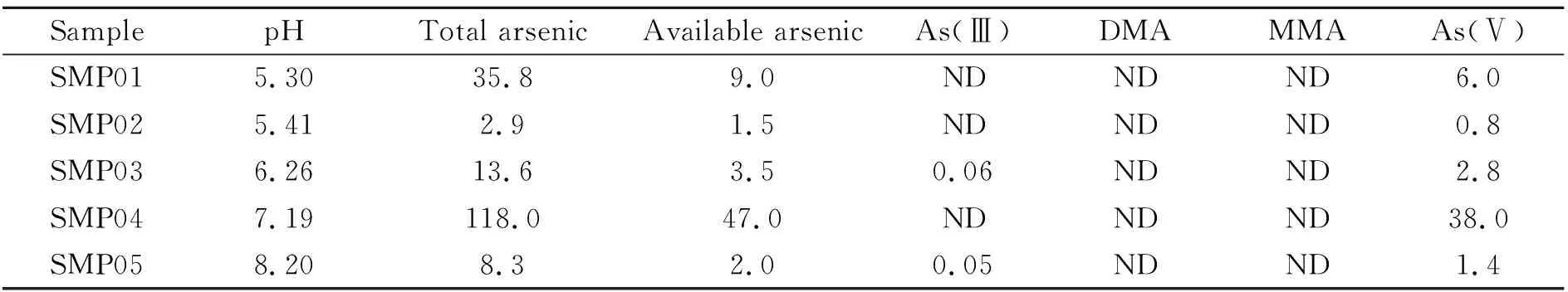
表3 土壤样品中4种有效砷形态测定结果(mg/kg)
3 结论
建立了高效液相色谱-原子荧光光谱法测定土壤中亚砷酸根、二甲基砷、一甲基砷和砷酸根4种有效砷形态。方法操作简便,灵敏度、精密度和准确度均能满足土壤有效砷形态检测质量控制与保证要求,在实际应用中值得推广。
