沉默LncRNA DLGAP1-AS2对人视网膜母细胞瘤增殖和迁移及侵袭的影响
2022-06-04汪明红廖风玲刘国立
李 晖,汪明红,廖风玲,刘国立
0引言
视网膜母细胞瘤是临床常见的一种恶性肿瘤且已严重威胁患者生命安全,目前视网膜母细胞瘤的发病机制尚未阐明,研究表明长链非编码RNA(LncRNA)表达异常与视网膜母细胞瘤发生及发展密切相关,并可能作为视网膜母细胞瘤诊断及治疗的潜在靶点[1-4]。LncRNA DLGAP1-AS2在胆管癌中呈高表达,并可促进胆管癌细胞增殖、迁移及侵袭[5]。但DLGAP1-AS2与视网膜母细胞瘤相关研究报道相对较少。Starbase预测显示DLGAP1-AS2与miR-1193存在结合位点,研究表明miR-1193上调表达可抑制宫颈癌细胞增殖及转移[6]。但DLGAP1-AS2与miR-1193在视网膜母细胞瘤发生及发展过程中的作用机制尚未可知。因此,本研究主要探讨DLGAP1-AS2是否可通过靶向调控miR-1193表达而调节人视网膜母细胞瘤HXO-Rb44增殖、迁移和侵袭。
1材料和方法
1.1材料收集病理确诊且临床资料完整的视网膜母细胞瘤组织标本25例,其中男15例,女10例,年龄8月龄~10岁(平均5.68±1.25岁)。同时选取因外伤摘除眼球的正常视网膜组织9例为对照,其中男5例,女4例,年龄9月龄~10岁(平均5.22±1.16岁)。两组研究对象年龄、性别比较差异均无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会审核。
人正常视网膜血管内皮细胞ACBRI-181、视网膜母细胞瘤HXO-Rb44购自美国ATCC;DMEM培养液与胎牛血清购自美国Gibco;Trizol试剂购自美国Thermo Fisher;cDNA合成及qRT-PCR试剂及引物购自大连宝生物;Lipofectamine 2000、Transwell小室、Matrigel基质胶购自北京索莱宝;CCK-8试剂购自上海碧云天生物;DLGAP1-AS2小分子干扰RNA(si-DLGAP1-AS2)及其阴性对照(si-NC)、miR-1193寡核苷酸模拟物(miR-1193 mimic)及阴性对照mimic NC序列(miR-NC)、miR-1193寡核苷酸抑制物(miR-1193 inhibitor)购自广州锐博生物;兔抗人E-cadherin、N-cadherin抗体与二抗购自美国CST。
1.2方法
1.2.1石蜡切片HE染色将烤好的组织切片置于新鲜二甲苯中脱蜡10min×3次;依次放入体积分数100%、95%、85%、70%乙醇中各3~5min后蒸馏水冲洗;Harry苏木素染液染色8min,蒸馏水冲洗;体积分数1%盐酸酒精分色,蒸馏水冲洗,自来水冲洗20min返蓝;伊红染液染色1min,蒸馏水冲洗;依次经体积分数95%、100%乙醇浸泡脱水各2次,每次20s,干燥后依次置于酒精二甲苯溶液、两缸二甲苯中各5min;迅速滴加适量中性树胶,盖玻片封固;显微镜下观察、照相。
1.2.2实验分组ACBRI-181细胞、HXO-Rb44细胞培养于含有10%胎牛血清、100U/mL青霉素与100μg/mL链霉素的DMEM培养基,于37℃、5% CO2体积分数培养箱内培养,待细胞生长至80%融合度时进行传代培养。取对数生长期HXO-Rb44细胞接种于96孔板(3×103个/孔),按照Lipofectamine 2000转染试剂说明书进行操作。将si-DLGAP1-AS2 A、si-DLGAP1-AS2 B、si-DLGAP1-AS2 C分别转染至HXO-Rb44细胞,分别记为si-DLGAP1-AS2 A组、si-DLGAP1-AS2 B组、si-DLGAP1-AS2 C组,采用qRT-PCR法检测细胞中DLGAP1-AS2表达量,选取干扰效果较好的进行后续实验。将si-NC、si-DLGAP1-AS2、miR-NC、miR-1193 mimic、si-DLGAP1-AS2与miR-1193 inhibitor(共转染)分别转染至HXO-Rb44细胞,分别记为si-NC组、si-DLGAP1-AS2组、miR-NC组、miR-1193 mimic组、si-DLGAP1-AS2+miR-1193 inhibitor组。同时将正常培养的HXO-Rb44细胞记为control组。
1.2.3qRT-PCR检测DLGAP1-AS2和miR-1193的表达水平用Trizol试剂分别提取正常视网膜组织、视网膜母细胞瘤组织、ACBRI-181细胞、HXO-Rb44细胞与转染后各组HXO-Rb44细胞总RNA,应用紫外分光光度计测定RNA浓度。反转录合成cDNA,以cDNA为模板进行qRT-PCR扩增,反应条件:95℃预变性5min循环1次,95℃变性15s,60℃退火60s,72℃延伸30s,共循环40次。应用ABI StepOnePlus荧光定量PCR仪检测DLGAP1-AS2、miR-1193相对表达量。
1.2.4双荧光素酶报告实验检测DLGAP1-AS2与miR-1193的靶向关系由美国Promega公司构建含有DLGAP1-AS2与miR-1193互补序列的野生型报告基因载体WT-DLGAP1-AS2和含有突变序列的突变型报告基因载体MUT-DLGAP1-AS2,用脂质体转染法将miR-NC/WT-DLGAP1-AS2、miR-NC/MUT-DLGAP1-AS2、miR-1193 mimic/WT-DLGAP1-AS2、miR-1193 mimic/MUT-DLGAP1-AS2分别共转染至HXO-Rb44细胞,加入20μL 1×Passive Lysis Buffer,加入100μL Luciferase Assay Reagent Ⅱ,于荧光发光仪检测Firefly Luciferase活性值,加入100μL Stop&Glo Reagent于荧光发光仪检测Renilla Luciferase活性值,以海肾荧光素酶报告基因活性值为内参,计算各组细胞荧光素酶活性值。
1.2.5CCK-8实验检测细胞增殖取各组HXO-Rb44细胞接种于96孔板(4×103个/孔),每孔加入10μL CCK-8溶液,于37℃培养箱培养2h,用酶标仪检测各孔光密度值(OD 450nm)并计算细胞增殖抑制率[(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%]。
1.2.6平板克隆形成实验取各组HXO-Rb44细胞接种于6孔板(500个/孔),于37℃培养箱培养14d,每隔2d更换一次培养液,4%多聚甲醛固定20min(-20℃),1%结晶紫染色15min,PBS洗涤后晾干,观察集落形成数。
1.2.7Transwell实验检测细胞迁移与侵袭迁移实验:取各组HXO-Rb44细胞(1×105cell/mL)按照每孔200μL的密度加入小室的上室,按照每孔600μL的密度将含有10%胎牛血清的培养液加入下室,37℃培养箱内培养24h,多聚甲醛固定20min,用0.1%结晶紫染液染色20min,显微镜下观察迁移细胞数。侵袭实验:Matrigel基质胶稀释液按照每孔40μL的密度加入小室的上室,37℃培养箱内固定5h,后续实验步骤同迁移实验。
1.2.8Westernblot检测E-cadherin和N-cadherin蛋白表达量各组HXO-Rb44细胞加入500μL RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度,经SDS-PAGE凝胶电泳、电转膜至PVDF膜,密封2h,加入E-cadherin(1∶500)、N-cadherin(1∶500)、GAPDH抗体(1∶1000)稀释液4℃孵育24h,TBST洗膜40min,加入二抗稀释液(1∶3000)37℃孵育1h,TBST洗膜40min,ECL试剂与DNR BioImaging System观察PVDF膜上蛋白条带,用凝胶图像处理系统软件分析蛋白条带灰度值。
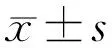
2结果
2.1病理形态特征检测与正常视网膜组织细胞相比,视网膜母细胞瘤组织中肿瘤细胞核大,染色较深,细胞呈椭圆或梭形,可见核分裂,排列不规则,见图1。
2.2DLGAP1-AS2和miR-1193表达的检测与正常视网膜组织比较,视网膜母细胞瘤组织中DLGAP1-AS2的表达量升高(P<0.05),miR-1193的表达量降低(P<0.05),见表1。与ACBRI-181细胞比较,HXO-Rb44细胞中DLGAP1-AS2的表达量升高(P<0.05),miR-1193的表达量降低(P<0.05),见表2、图2。
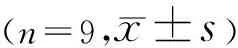
表2 视网膜母细胞瘤细胞HXO-Rb44中DLGAP1-AS2和miR-1193表达的检测

图2 视网膜母细胞瘤组织和细胞中DLGAP1-AS2和miR-1193表达的检测 A:与正常视网膜组织相比,DLGAP1-AS2在视网膜母细胞瘤组织中高表达;B:与正常视网膜组织相比,miR-1193在视网膜母细胞瘤组织中低表达;C:与ACBRI-181细胞相比,DLGAP1-AS2在HXO-Rb44细胞中高表达;D:与ACBRI-181细胞相比,miR-1193在HXO-Rb44细胞中低表达。aP<0.05 vs 正常视网膜组织组;cP<0.05 vs ACBRI-181组。
2.3沉默DLGAP1-AS2处理后DLGAP1-AS2表达的检测与control组、si-NC组比较,si-DLGAP1-AS2 A组、si-DLGAP1-AS2 B组、si-DLGAP1-AS2 C组DLGAP1-AS2的表达量降低(P<0.05),见表3、图3。其中si-DLGAP1-AS2 A组DLGAP1-AS2的表达量相对较低,因而选用si-DLGAP1-AS2 A进行后续实验。
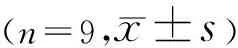
表3 沉默DLGAP1-AS2后DLGAP1-AS2表达的检测
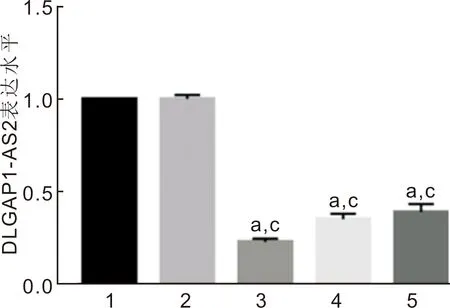
图3 沉默DLGAP1-AS2后DLGAP1-AS2表达的检测 1:control组;2:si-NC组;3:si-DLGAP1-AS2 A组;4:si-DLGAP1-AS2 B组;5:si-DLGAP1-AS2 C组。aP<0.05 vs control组;cP<0.05 vs si-NC组。
2.4DLGAP1-AS2和miR-1193靶向关系Starbase预测显示DLGAP1-AS2与miR-1193存在结合位点,见图4A。miR-1193过表达可抑制野生型载体WT-DLGAP1-AS2的荧光素酶活性(P<0.05),而未能抑制突变型载体MUT-DLGAP1-AS2的荧光素酶活性,见表4、图4B。
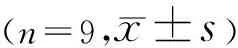
表4 双荧光素酶报告实验

图4 DLGAP1-AS2和miR-1193的互补序列及荧光素酶活性检测 A:DLGAP1-AS2和miR-1193的互补序列;B:双荧光素酶报告实验检测荧光素酶活性。aP<0.05 vs miR-NC组。
2.5各个处理组对HXO-Rb44中miR-1193及增殖的影响与control组、si-NC组比较,si-DLGAP1-AS2组miR-1193的表达量升高(P<0.05),细胞增殖抑制率升高(P<0.05),集落形成数减少(P<0.05);与miR-NC组比较,miR-1193 mimic组miR-1193的表达量升高(P<0.05),细胞增殖抑制率升高(P<0.05),集落形成数减少(P<0.05);与si-DLGAP1-AS2组比较,si-DLGAP1-AS2+miR-1193 inhibitor组miR-1193的表达量降低(P<0.05),细胞增殖抑制率降低(P<0.05),集落形成数增多(P<0.05),见表5、图5。
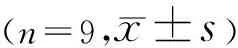
表5 HXO-Rb44细胞中miR-1193、抑制率和集落形成数的检测

图5 HXO-Rb44细胞中miR-1193、抑制率和集落形成数的检测 A:miR-1193表达的检测;B:HXO-Rb44细胞抑制率的检测;C:HXO-Rb44细胞集落形成数的检测。1:control组;2:si-NC组;3:si-DLGAP1-AS2组;4:miR-NC组;5:miR-1193 mimic组;6:si-DLGAP1-AS2+miR-1193 inhibitor组。aP<0.05 vs control组;cP<0.05 vs si-NC组;eP<0.05 vs miR-NC组;gP<0.05 vs si-DLGAP1-AS2组。
2.6各个处理组对HXO-Rb44迁移和侵袭的影响与control组、si-NC组比较,si-DLGAP1-AS2组迁移及侵袭细胞数减少(P<0.05);与miR-NC组比较,miR-1193 mimic组迁移及侵袭细胞数减少(P<0.05);与si-DLGAP1-AS2组比较,si-DLGAP1-AS2+miR-1193 inhibitor组迁移及侵袭细胞数增多(P<0.05),见图6、表6。
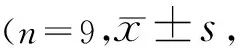
表6 HXO-Rb44细胞迁移和侵袭的检测 个)
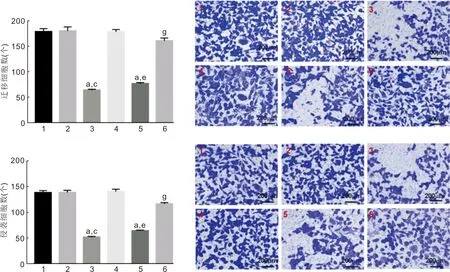
图6 HXO-Rb44细胞迁移、侵袭的检测 1:control组;2:si-NC组;3:si-DLGAP1-AS2组;4:miR-NC组;5:miR-1193 mimic组;6:si-DLGAP1-AS2+miR-1193 inhibitor组。aP<0.05 vs control组;cP<0.05 vs si-NC组;eP<0.05 vs miR-NC组;gP<0.05 vs si-DLGAP1-AS2组。
2.7各个处理组对HXO-Rb44中E-cadherin和N-cadherin表达的影响与control组、si-NC组比较,si-DLGAP1-AS2组E-cadherin蛋白水平升高(P<0.05),N-cadherin蛋白水平降低(P<0.05);与miR-NC组比较,miR-1193 mimic组E-cadherin蛋白水平升高(P<0.05),N-cadherin蛋白水平降低(P<0.05);与si-DLGAP1-AS2组比较,si-DLGAP1-AS2+miR-1193 inhibitor组E-cadherin蛋白水平降低(P<0.05),N-cadherin蛋白水平升高(P<0.05),见图7、表7。

图7 E-cadherin和N-cadherin蛋白表达的检测 1:control组;2:si-NC组;3:si-DLGAP1-AS2组;4:miR-NC组;5:miR-1193 mimic组;6:si-DLGAP1-AS2+miR-1193 inhibitor组。aP<0.05 vs control组;cP<0.05 vs si-NC组;eP<0.05 vs miR-NC组;gP<0.05 vs si-DLGAP1-AS2组。
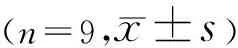
表7 HXO-Rb44中E-cadherin和N-cadherin蛋白表达的检测
3讨论
LncRNA在视网膜母细胞瘤发生发展过程中可发挥重要调控作用,例如,沉默LncRNA ANRIL可通过调节miR-99a和c-Myc而抑制视网膜母细胞瘤细胞生长并促进其凋亡[7]。LncRNA XIST通过竞争性结合miR-101而促进视网膜母细胞瘤细胞转移[8]。敲低LncRNA PVT1可抑制视网膜母细胞瘤的进展[9]。LncRNA CANT1可抑制视网膜母细胞瘤细胞增殖[10]。
DLGAP1-AS2在视网膜母细胞瘤中的表达尚未可知。研究表明抑制DLGAP1-AS2表达可抑制肝癌细胞迁移及侵袭[11]。DLGAP1-AS2通过上调YAP1表达而促进神经胶质瘤的发生[12]。DLGAP1-AS2在Wilms肿瘤中表达上调,并可能作为Wilms肿瘤诊断的潜在生物学标记物[13]。本研究结果显示,视网膜母细胞瘤组织与细胞系中DLGAP1-AS2的表达量升高,沉默DLGAP1-AS2可增高视网膜母细胞瘤细胞增殖抑制率,集落形成数减少,提示沉默DLGAP1-AS2可抑制视网膜母细胞瘤细胞增殖及克隆形成。表明DLGAP1-AS2高表达可促进视网膜母细胞瘤细胞增殖及增强细胞克隆形成能力从而促进视网膜母细胞瘤的发生及发展。E-cadherin与N-cadherin表达失调可调节上皮-间质转化(EMT)进而调控细胞转移[14]。本研究结果显示,沉默DLGAP1-AS2后视网膜母细胞瘤迁移及侵袭细胞数减少,E-cadherin蛋白水平升高,N-cadherin蛋白水平降低,提示沉默DLGAP1-AS2可抑制视网膜母细胞瘤细胞迁移及侵袭。表明DLGAP1-AS2高表达可促进视网膜母细胞瘤细胞迁移及侵袭从而发挥癌基因作用。
本研究证实DLGAP1-AS2可靶向结合miR-1193,并可负向调控miR-1193的表达。提示DLGAP1-AS2可能通过靶向miR-1193而促进视网膜母细胞瘤发展。研究表明miR-1193表达下调可促进皮肤鳞状细胞癌的发展[15]。miR-1193通过直接靶向跨膜9超家族3(TM9SF3)抑制人T细胞白血病细胞增殖和侵袭[16]。抑制miR-1193表达可促进成胶质细胞瘤的发生[17]。本研究结果显示,视网膜母细胞瘤组织与细胞系中miR-1193的表达量降低,上调miR-1193表达可抑制视网膜母细胞瘤细胞增殖、克隆形成、迁移及侵袭,而抑制其表达可恢复沉默DLGAP1-AS2对视网膜母细胞瘤细胞增殖、克隆形成、迁移及侵袭的抑制作用。提示DLGAP1-AS2可能通过靶向miR-1193而促进视网膜母细胞瘤细胞增殖、迁移和侵袭。
综上所述,视网膜母细胞瘤组织与细胞系中DLGAP1-AS2表达上调,而miR-1193表达下调,DLGAP1-AS2与miR-1193存在靶向调控作用,沉默DLGAP1-AS2可通过促进miR-1193表达而抑制视网膜母细胞瘤细胞增殖、克隆形成、迁移及侵袭,DLGAP1-AS2/miR-1193在视网膜母细胞瘤发生发展过程中可发挥重要调控作用,并可能作为视网膜母细胞瘤治疗的潜在靶点,还可能为进一步揭示视网膜母细胞瘤的发病机制奠定实验基础。但DLGAP1-AS2基因序列上富含多个miRNA的结合位点,其是否可通过靶向调控其他miRNA而参与视网膜母细胞瘤发生及发展过程仍需进一步探究。
