淫羊藿素对乳腺癌细胞化疗敏感的影响机制研究*
2022-05-29刘卫国何利芳何育威侯俊杰
刘卫国 ,何利芳 ,顾 玲 ,何育威 ,侯俊杰△
(1.长江大学附属仙桃市第一人民医院甲状腺乳腺外科,仙桃 433000;2.湖北省黄石市中心医院甲状腺乳腺外科,黄石 435000)
乳腺癌是世界女性最常见恶性肿瘤之一,据流行病学资料显示,其在美国死亡率已经跃居第一位[1],在中国,乳腺癌的发病率和死亡率也呈逐年上升的趋势,严重威胁女性健康[2]。化疗是临床上针对乳腺癌治疗的常用手段,但由于患者的个体差异性,其对化疗药物的敏感性也各有不同,统一的化疗方案对不同的患者有着不同的疗效[3]。研究发现,与乳腺癌细胞增殖和凋亡相关的基因,如人表皮生长因子受体(human epidermal growth factor receptor-2,HER-2)、人抑癌基因p53 和促凋亡基因Bax等与患者化疗敏感性有关[4-5]。
淫羊藿为小檗科淫羊藿属植物,临床上主要用于乳房肿块和高血压等疾病的治疗。淫羊藿素(icaritin,ICT)是淫羊藿主要活性单体淫羊藿苷的水解产物,具有抗肿瘤、抗骨质疏松、抗氧化和免疫抑制等多重效应[6]。研究发现,ICT可逆转人多发性骨髓瘤耐药细胞株KM3/BTZ 的多药耐药性的作用[7]。脱水ICT 可抑制受体状态不同的人乳腺癌细胞株的增殖活性[8]。基于此,本研究通过构建乳腺癌顺铂(cisplatin,CDDP)耐药株,进一步探究ICT对乳腺癌化疗敏感性的影响及其可能的作用机制,为乳腺癌的临床治疗提供可靠的化疗增敏药物。
1 材料与方法
1.1 细胞、药物和主要试剂 人三阴乳腺癌细胞株MDA-MB-231购自中科院上海细胞库。ICT(货号:JOT-11573;纯度≥98%)购自成都普菲德生物公司;注射用CDDP(国药准字H37021358)购自齐鲁制药。MTT 购自美国Sigma 公司;PRMI-1640 购自美国HyClone 公司;Matrigel 购自美国的BD 公司;结晶紫购自北京碧云天公司;ECL购自武汉谷歌生物科技公司;Alexa Fluor 488 Annexin V/PI 细胞凋亡试剂盒购自美国的Invitrogen 公司;Transwell 小室购自美国Millipore公司。一抗磷酸化(p)-ERK1/2、p-p53及GAPDH购自美国CST公司。
1.2 细胞培养及MDA-MB-231/CDDP 耐药株的构建 取MDA-MB-231 细胞,用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的不完全RPMI-1640 培养基培养,置于37 ℃、5%CO2的培养箱内培养。待细胞汇合度达到90%,加入100 ng/mL的CDDP,采用持续诱导法以100 ng/mL 浓度稳定增加药物浓度,使细胞稳定存活,传代。以4 μg/mL的维持浓度至少培养7 个月获得耐药CDDP 细胞株。实验前停用CDDP两周。
1.3 MTT 法检测MDA-MB-231 和MDA-MB-231/CDDP耐药细胞株增殖活性 取传代后对数生长期MDA-MB-231和MDA-MB-231/CDDP耐药细胞,消化,重悬细胞,并进行细胞计数,使细胞密度为5 000个/孔,将细胞接种至96 孔板中,设置对照组(0.0 μmol/L ICT)和不同浓度(0.5 μmol/L、1.0 μmol/L、1.5 μmol/L、2.0 μmol/L、2.5 μmol/L、3.0 μmol/L、4.0 μmol/L、5.0 μmol/L)ICT处理组。待细胞贴壁后根据分组给予药物处理后继续培养48 h。采用MTT 检测细胞的增殖情况,检测波长为570 nm,计算细胞增殖率=处理组OD 值/对照组OD 值×100%。取对MDA-MB-231和MDA-MB-231/CDDP耐药细胞增殖没有影响的临界浓度用于后续实验。
取对数生长期MDA-MB-231和MDA-MB-231/CDDP耐药细胞,消化、重悬后继续接种于96孔板,设置各浓度CDDP 组及CDDP+ICT 组,CDDP 处理MDA-MB-231 细胞的终浓度分别为0.1 μg/mL、0.2 μg/mL、0.3 μg/mL、0.4 μg/mL、0.5 μg/mL、1.0 μg/mL、2.0 μg/mL,处理MDA-MB-231/CDDP耐药细胞的终浓度分别为1.0 μg/mL、2.0 μg/mL、3.0 μg/mL、4.0 μg/mL、5.0 μg/mL、6.0 μg/mL、7.0 μg/mL,ICT 浓度为上述临界浓度。待细胞贴壁后根据分组给予药物处理后继续培养至48 h。采用MTT 检测细胞的增殖情况,检测波长为570 nm,计算细胞相对增殖率=(实验组OD 值-对照组OD 值)/对照组OD值×100%。
1.4 Transwell 检测细胞侵袭 取100 μL Matrigel凝胶均匀铺在小室上层,然后将小室放在孔板内;取对数生长期MDA-MB-231 和MDA-MB-231/CDDP耐药细胞,PBS洗涤后换用无血清培养基重悬细胞,调整细胞密度约5×105个/mL;在小室上室加入200 μL 细胞悬液,设置对照(Con)组、CDDP 组及CDDP+ICT组,按照分组加入CDDP和ICT,使其终浓度分别为IC50和临界浓度,对照组加200 μL 细胞悬液。培养48 h后将Transwell小室取出,弃去培养基,酒精棉签擦去上层Matrigel 凝胶及未穿膜的细胞。另取干净的24孔板中,将小室置于其中,4%多聚甲醛固定30 min。弃去固定液,结晶紫染色10 min,PBS 洗涤,棉签擦去未结合的染料,显微镜下随机选取3个视野,计算穿膜细胞数量。相对侵袭率=实验组穿膜细胞数/对照组穿膜细胞数×100%。1.5 流式细胞术检测细胞凋亡 取对数生长期MDA-MB-231和MDA-MB-231/CDDP耐药细胞,消化,重悬并调整其密度为1×105个/mL,接种于6 孔板。胰酶消化,离心,弃上清,加入结合缓冲液500 μL 对细胞进行重悬,再加5 μL AnnexinV-FITC 及5 μL PI 染液,混匀后避光孵育15 min,流式细胞仪分析检测各组细胞凋亡率。
1.6 Western blotting法检测p-ERK1/2和p-p53蛋白表达 于冰上裂解细胞,提取总蛋白;BCA 法测定蛋白浓度,配胶、上样,SDS-PAGE电泳分离蛋白,转移至PCDF膜,封闭;加入一抗p-ERK1/2、p-p53与内参蛋白GAPDH,4 ℃下孵育过夜;洗膜,加入二抗,室温下孵育2 h,洗膜;ECL 显色,Image J 软件分析蛋白条带灰度值。
1.7 统计学方法 采用SPSS 22.0软件对数据进行分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSDt检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ICT 对MDA-MB-231 和MDA-MB-231/CDDP耐药细胞CDDP敏感性的影响 随着ICT浓度的增加,其对乳腺癌细胞的增殖抑制作用更加明显,ICT表现出一定的抗肿瘤作用。当ICT浓度大于1.5 μmol/L时,ICT对MDA-MB-231细胞增殖有明显抑制作用(P<0.001);当ICT 浓度大于2 μmol/L 时,ICT 对MDA-MB-231/CDDP 耐药细胞增殖有显著的抑制作用(P<0.05),见图1A。选择ICT 对两种乳腺癌细胞增殖无显著影响的浓度,即1.5 μmol/L 的ICT进行后续实验。
与CDDP 单独作用比较,ICT 联合CDDP 对两种乳腺癌细胞的增殖抑制作用更加明显(均P<0.05),见图1B~1C。根据实验选取MDA-MB-231细胞的IC50浓度,即1 μg/mL CDDP进行后续实验。
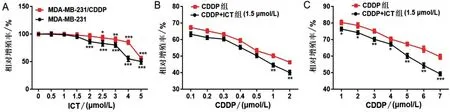
图1 ICT对MDA-MB-231耐药细胞CDDP敏感性的影响
2.2 ICT 对MDA-MB-231 和MDA-MB-231/CDDP耐药细胞侵袭的影响 在两种乳腺癌细胞中,与Con组比较,CDDP单用和CDDP联合ICT均能明显抑制乳腺癌细胞的侵袭(P<0.05);与CDDP单用比较,CDDP 联合ICT 抑制细胞侵袭的作用更加显著(P<0.01),见图2。
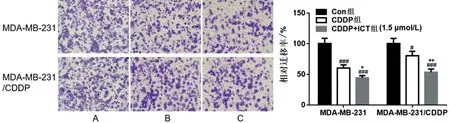
图2 ICT对MDA-MB-231和MDA-MB-231/CDDP耐药细胞侵袭的影响(×200)
2.3 ICT 对MDA-MB-231 和MDA-MB-231/CDDP耐药细胞凋亡的影响 在两种乳腺癌细胞中,与Con 组比较,CDDP 组和CDDP+ICT 组细胞凋亡更加明显(P<0.001);与CDDP 单用比较,CDDP 联合ICT 诱导两种细胞凋亡的作用更加显著(P<0.001),见图3。
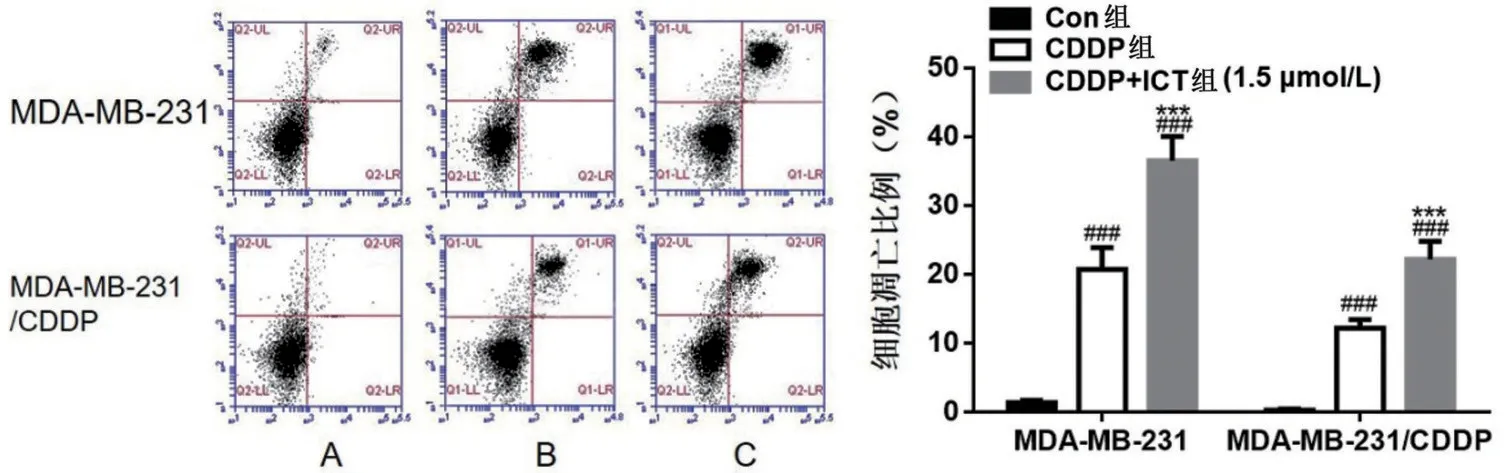
图3 ICT对MDA-MB-231和MDA-MB-231/CDDP耐药细胞凋亡的影响
2.4 ICT 对MDA-MB-231 和MDA-MB-231/CDDP耐药细胞ERK1/2 和p53 蛋白表达的影响 与Con组比较,两种细胞的p-ERK1/2蛋白表达均显著降低(P<0.001),p-p53蛋白表达显著升高(P<0.05);且CDDP联用ICT较CDDP单用对p-ERK1/2蛋白表达的下调及p-p53蛋白表达的上调作用更加明显(P<0.05),见图4、表1。
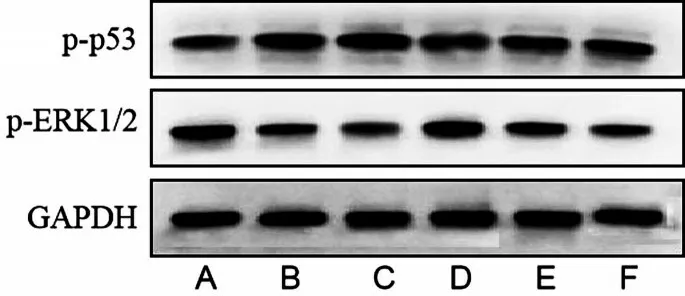
图4 ICT对两种细胞p-ERK1/2和p-p53蛋白表达的影响
表1 3组p-ERK1/2和p-p53蛋白表达比较±s

表1 3组p-ERK1/2和p-p53蛋白表达比较±s
与Con组比较,#P<0.05,##P<0.01,###P<0.001;与CDDP组比较,*P<0.05。
3 讨论
目前临床上针对乳腺癌的治疗已经有了较为明显的进展,但乳腺癌患者由于经常产生耐药情况且缺乏有效的药物治疗靶点,因此,乳腺癌患者面临着生存期较短,死亡率较高的危险[9]。CDDP为一种抑制DNA复制的烷化剂,属于非细胞周期特异性化疗药,其在三阴乳腺癌的临床治疗中具有重要地位[10]。但在乳腺癌的临床治疗上,随着化疗药物周期的延长,其也易产生耐药性,同时伴随着多种毒副作用的发生。因此,针对乳腺癌细胞对CDDP 的耐药,临床上也多采取多药联合的方式来治疗乳腺癌,寻求一种化疗增敏剂能够增强CDDP 化疗敏感性而降低其毒副作用的药物则显得至关重要[11-12]。蒋绍艳等[13]研究证实,淫羊藿苷可抑制人卵巢癌细胞的多药耐药,抑制耐药细胞株的增殖、侵袭及侵袭能力,同时,还可通过上调凋亡相关蛋白caspase-3的表达诱导细胞的凋亡。
本研究发现,相较于CDDP单独作用,ICT联合CDDP 对两种乳腺癌细胞的增殖抑制作用更加明显。根据实验选取MDA-MB-231 细胞的IC50浓度,继续探究ICT联合CDDP对两种细胞的侵袭和凋亡的影响。结果发现,在两种乳腺癌细胞中,相较于Con组,CDDP单用和CDDP联合ICT均能明显抑制乳腺癌细胞的侵袭,诱导凋亡;但与CDDP 单用比较,CDDP 联合ICT 抑制细胞侵袭及诱导凋亡的作用更加明显。结果提示ICT可增强CDDP对乳腺癌细胞增殖和侵袭的抑制作用,且诱导细胞凋亡的作用更加显著。
有研究发现,铂类药物可通过p63/p73 相关通路影响三阴乳腺癌的化疗敏感性[14]。此外,p53 基因的突变也被证实与三阴乳腺癌较差的预后密切相关,许多化疗药物通过p53 依赖性细胞凋亡实现其作用。p53基因表达的下调可大大降低铂类药物的敏感性,其机制可能涉及到DNA 的损伤修复[15]。除p53基因外,ERK1/2通路的异常激活在乳腺癌的发生发展中也扮演着重要角色[16],ERK1/2 MAPK是Ras 基因下游最为经典的一条信号通路,ERK1/2 MAPK 通路主要参与调控细胞周期以及促炎性细胞因子的表达,与许多肿瘤的发生发展密切相关[17-18]。研究表明,ICT 可激活包括PI3K/Akt、JAK/STAT3 和MAPK/ERK/JNK 在内的多种关键细胞信号通路发挥抗血液恶性肿瘤的作用[19]。Lu等[20]研究发现,ICT 还可通过靶向ERK 通路抑制A549 细胞的增殖和迁移等。本研究发现,相较于Con组,两种细胞的p-ERK1/2 蛋白表达均显著降低,p-p53 蛋白表达显著升高;且CDDP 联用ICT 较CDDP 单用对p-ERK1/2蛋白表达的下调及p-p53蛋白表达的上调作用更加明显。提示ICT对CDDP的增敏作用可能与ERK1/2 相关通路的抑制及p-p53 蛋白的激活有关。
综上,ICT 联合CDDP 较CDDP 单用对人乳腺癌细胞及其CDDP 耐药细胞株的增殖、侵袭抑制作用和凋亡诱导作用更加明显,且ICT 的增敏作用可能与ERK1/2 相关通路的抑制及p-p53 蛋白的激活有关。
