异丙酚对胎鼠离体海马神经元脑源性神经营养因子表达的影响*
2022-05-29覃银莹谢玉波
韦 祎,周 沾,覃银莹,谢玉波,利 莉
(广西医科大学第一附属医院麻醉科,南宁 530021)
异丙酚是快速短效的静脉麻醉药物,为GABA受体激动剂,常用于诱导和维持小儿麻醉以及重症监护[1]。长期体内外大剂量异丙酚给药会引起神经元损伤,导致认知和学习能力障碍[2]。从胚胎时期起持续2~3 年这一时期大脑发育最快,神经元、轴突、树突和突触数量迅速增加,在此期间内长时间大剂量接触异丙酚会诱发神经元发育性神经毒性[3]。然而,关于新生儿中异丙酚安全性的研究报道较少。因此,减少麻醉药品对发育性脑神经元的损伤成为一个日益热门的研究课题。本研究拟评价异丙酚对胎鼠离体海马神经元脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)表达的影响,探讨异丙酚神经毒性的分子作用机制。
1 材料与方法
1.1 实验动物 采用广西医科大学实验动物中心提供SPF级SD大鼠(实验动物许可证号:SCXK[桂]2003-0005),实验遵循实验动物福利伦理审查指南(GB/T35892—2018)。
1.2 细胞培养 将SD 大鼠腹中14 d 胎鼠处死,分离海马组织,剪碎至1 mm×1 mm×1 mm并与DMEM/F12移入离心管中,加入不含EDTA 胰酶的胶原酶,吹打,37 ℃温水浴,直至剪碎的海马组织液呈现混浊不清并可拉出丝状,然后加入不含EDTA的胰酶,吸除胰酶并加培养基终止消化。吸管上下吹打直至肉眼看不到明显组织块,离心,弃上清液,加培养液,制备单细胞悬液。筛网过滤,取过滤后液体0.5 mL,加入台盼兰染液,染色。镜下细胞计数,蓝色细胞为死细胞,无色透明为活细胞,密度以1~2×106个/mL接种于培养板中。显微镜下观察并记录海马神经元的生长情况包括胞体形态、树突、轴突和排列密度程度等。
1.3 免疫组化法鉴定神经元 保温箱取出培养板,甲醛固定30 min,弃去甲醛后PBST轻洗;在室温下通透15 min;用与二抗同源的5%的血清封闭30 min;弃掉培养基,PBST 轻洗,神经元特异性的MAP2 单克隆抗体标记神经元孵育过夜,滴加生物素化二抗工作液孵育30 min;PBS漂洗3次,每次3 min;辣根酶标记链霉卵白素工作液,恒温箱孵育30 min;PBS漂洗3次,DAB显色剂显色,终止。苏木素染色,冲洗,盐酸酒精分化,分别用浓度80%、95%、100%的酒精梯度脱水,每次5 s;二甲苯2 次,每次5 s;脱水透明后封片,取其阳性细胞数均值计算海马神经元纯度。
1.4 实验分组 神经元体外培养至第8 天,分为3组:空白对照组(C组)不做任何处理,I组加入脂肪乳剂(20%),P组加入异丙酚孵育3 h使其最终浓度为100 μmol/L。
1.5 CCK-8试剂盒测定海马神经元细胞活力
L-左旋多聚赖氨酸预先处理96 孔板并分别每组设置6个复孔,孵育神经元细胞。每2 d测定1次吸光度值,记录至第16天。用酶标仪(BioTek公司,美国)测定波长于450 nm 处P 组(a)、C 组(b)和I 组(c)的吸光度值(OD)并绘制生长曲线。细胞活力%=(a-b)/(c-b)×100%。
1.6 实时荧光定量PCR(RT-qPCR)检测BDNF mRNA基因表达 按试剂盒(TARAKA公司,日本)提取总RNA 后逆转录cDNA。引物序列如下:GAPDH 引物F:5’-ACAGCAACAGGGTGGTGGAC-3’,R:5’-TTTGAGGGTGCAGCGAACTT-3’。BDNF 引物F:5’-CAGCGCGAATGTGTTAGTGGTTA-3’,R:5’-CAGTGGACAGCCACTTTGTTTCA-3’;RT-qPCR 扩增条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,反复40组。以GAPDH为内参,使用2-ΔΔCT法检测mRNA的表达。
1.7 Western blotting检测BDNF蛋白表达含量
10% SDS-PAGE 凝胶电泳将上样的蛋白质分离,转至PVDF 膜,5%脱脂奶粉封闭,1×TBST 稀释兔抗鼠BDNF(1∶1 000,CST 公司,美国),兔抗鼠Cleaved-Caspase3(1∶1 000,CST公司,美国)孵育过夜,加入山羊抗兔荧光二抗(稀释度1∶10 000,LI-COR公司,美国)避光孵育1 h,内参GAPDH(1∶5 000,CST公司,美国),使用凝胶成像系统和Image J软件扫膜和条带分析灰度值。
1.8 统计学方法 采用SPSS 22.0统计学软件对数据进行分析,计量资料以均数±标准差(±s)表示,两组数据方差齐,采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 原代海马神经元的形态结构 显微镜下观察海马神经元胞体饱满程度和突起连接情况。接种4 h 后,大部分胞体已明显贴壁,第1 天大部分胞体紧贴壁生长,突起延长;第3~5天胞体形态多样,突起连接成网;第7天胞体饱满排列紧密,突起纵横交错;第9天胞体皱缩,且部分胞体裂解。
2.2 免疫细胞化学鉴定结果 显微镜下观察体外培养至第8 天的胎鼠海马神经元细胞,神经元胞体丰满,突起明显延长并相互连接,细胞核被DAPI染成蓝色。按照判断原代海马神经元细胞体外培养成功的标准,由此判断新生大鼠海马神经元细胞培养成功。计算阳性细胞数在10 个视野内平均值为(95.2±3.6)%。纯度较高可满足进一步的实验的需求。
2.3 CCK-8检测细胞活力 每2 d测定并记录1次OD值,共测定8次。观察到细胞活力上升速度越来越快,第8 天上升速度达到顶峰,然后上升速度变慢,由此得出第8天进行药物干预为最佳时间,见图1。与C 组比较,P 组海马神经元活性降低(P<0.05);I 组海马神经元活性几乎无变化(P>0.05),见图2。
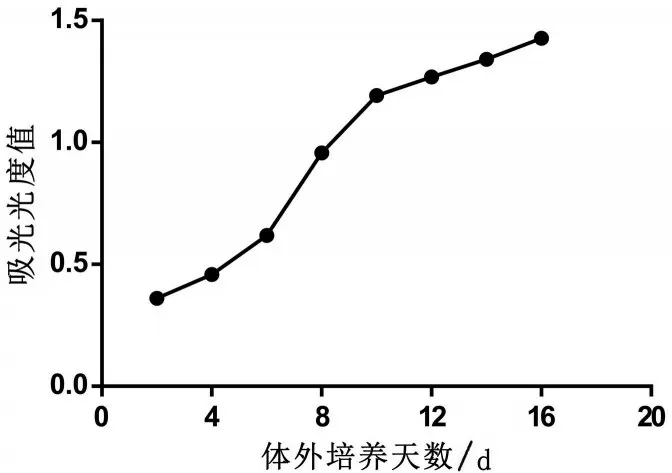
图1 海马神经元生长曲线
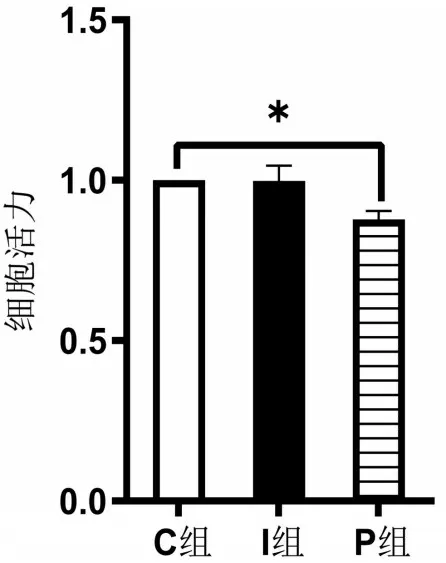
图2 各组海马神经元细胞活力比较
2.4 Western blotting检测BDNF蛋白表达量 与C组比较,P组BDNF蛋白表达量下调(P<0.05);I组神经元BDNF蛋白未见明显差异(P>0.05),见图3。
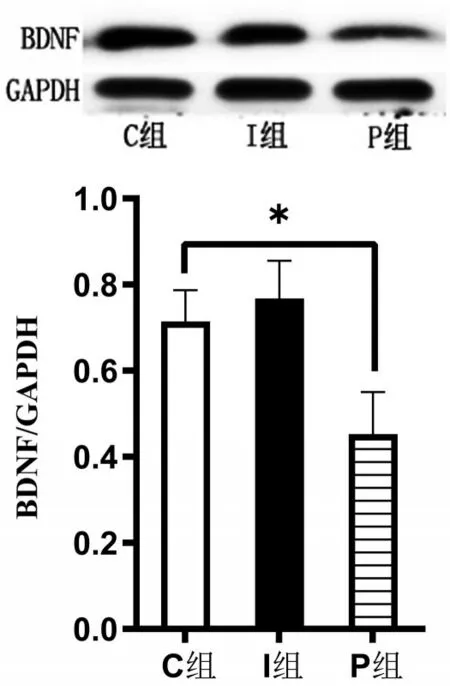
图3 各组BDNF相对表达量比较
2.5 RT-qPCR 检测BDNF mRNA 表达含量 与C组比较,P组BDNF mRNA的表达量降低(P<0.05);I 组神经元BDNF mRNA 未见明显差异(P>0.05),见图4。
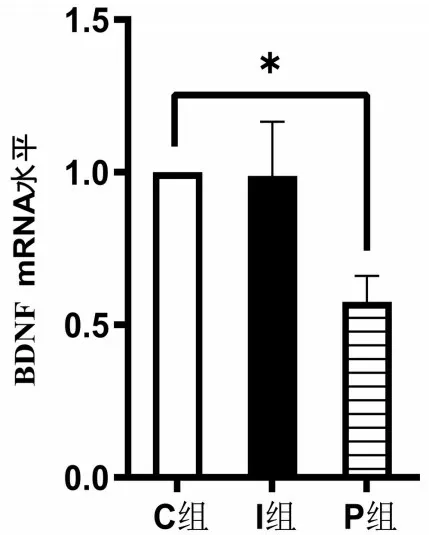
图4 各组BDNF mRNA相对表达量
3 讨论
异丙酚GABA 受体激动剂以及NMDA 拮抗剂(如氯胺酮、异氟醚和氧化亚氮)对各种神经传递系统产生剂量依赖性和年龄依赖性影响[4]。研究提示,全麻对婴幼儿神经发育神经毒性的影响不仅仅取决于麻醉次数、时间和深度等因素,神经易损性是另一个至关重要的原因[5]。全麻药可能具有神经毒性,这已引起麻醉医生对小儿麻醉安全性的关注。幼儿长期大剂量暴露于异丙酚麻醉中,将对神经发育的各个方面产生不良影响,导致学习和行为缺陷,神经元损伤和神经元凋亡水平升高,以及增加神经认知损害风险且将对儿童后天的学习能力产生不良的影响[6]。研究报道,3个月以内婴幼儿异丙酚剂量为25 mg/(kg·h),3~6个月的婴幼儿异丙酚剂量为20 mg/(kg·h),6~12 个月的婴幼儿异丙酚剂量为15 mg/(kg·h),幼儿期1~3岁异丙酚剂量为12 mg/(kg·h),且与成人相比早产儿和足月新生儿的药物清除率仅为药物有效形式的10%~38%,这一事实极大地限制尤其是在新生儿中异丙酚的使用[7]。50 μmol/L 异丙酚对神经细胞的短期暴露(<3 h)没有明显的神经毒性作用;异丙酚暴露如超过12 h,神经细胞活性显著降低。幼儿大脑模型可用培养至第7 天海马神经元替代,此时麻醉药作用于海马神经元反应性最强,海马神经元在100 μmol/L异丙酚作用下出现神经毒性[8]。
BDNF 是神经营养因子,能促进海马学习记忆和神经形成,促进神经元突触可塑性并参与轴突和树突的分化。BDNF通常通过两个关键的信号级联途径在发育中的神经元发挥其生存效应。其一,BDNF通过其受体TrkB诱导的PI3K活性激活Akt;其二,BDNF通过TrkB诱导的Erk1/2激活GSK3β或MSK1[9-10]。BDNF促进神经元和胶质细胞的同步成熟,并提高神经细胞的存活率,BDNF上调对许多神经疾病产生有益的影响[11]。BDNF 表达水平的改变,可能导致神经元突触丢失从而影响认知能力。临床浓度异丙酚可致发育期神经元凋亡,抑制BDNF 分泌是其中一种重要损伤机制[12]。本研究中异丙酚孵育海马神经元,胎鼠海马神经元活性明显降低,BDNF蛋白及其mRNA表达下调,揭示异丙酚对胎鼠离体海马神经元神经毒性机制可能是通过下调BDNF蛋白完成的。
综上所述,异丙酚通过影响BDNF 蛋白的表达从而抑制胎鼠海马神经元活性,产生神经毒性作用。
