基于网络药理学和巨噬细胞炎症模型探讨积雪草酸抗动脉粥样硬化的作用机制*
2022-05-29莫凡露吴灵君李佳琳韦智译苏奕达黄清兰
李 丹,莫凡露,吴灵君,黄 菊,李佳琳,韦智译,苏奕达,黄清兰,王 辉,何 萍
(广西医科大学药学院,南宁 530021)
动脉粥样硬化(AS)是以脂质积累、炎症细胞浸润、脂质斑块形成为特征的慢性炎症过程,其作为缺血性心脑血管疾病的主要病理学基础,已成为危害人类健康的第一杀手[1]。巨噬细胞作为AS 斑块内的主要细胞成分,是斑块组织中炎症因子的主要来源和先天性免疫应答中的主要免疫细胞,在AS发生和发展过程中发挥关键作用[2]。近年来,中药及其活性成分因作用温和、毒副作用小、多途径多靶点等特点在防治AS及相关心脑血管疾病方面具有明显优势,成为抗AS 药物研究的热点。积雪草酸(asiatic acid,AA)是从壮药积雪草中分离出来的活性较高的乌苏烷型五环三萜酸,具有抗炎、抗氧化、调脂、护肝、抗肿瘤和免疫调节等多种药理学作用[3]。研究发现,AA 可有效调节血脂,并通过抗氧化作用减轻高脂血症金黄地鼠的肝脏损伤[4]。AA通过抑制炎症反应改善大鼠急性心肌梗死[5]。此外,AA还能起到降压作用,有效抑制自发性高血压大鼠心脏纤维化[6]。以上研究提示,AA 可能对AS具有潜在的治疗价值,但其对AS 作用机制仍有待进一步阐明。本研究采用网络药理学并结合巨噬细胞炎症模型对AA 抗AS 作用机制进行预测和验证。
1 材料与方法
1.1 主要材料与试剂
RAW264.7 小鼠巨噬细胞(中国科学院上海生科院细胞资源中心提供);AA标准品(成都普瑞法,纯度HPLC≥98.0%),实验中采用0.1%二甲基亚砜(DMSO)溶解;脂多糖(LPS)(美国Sigma,批号:0000114327);DMEM 高糖培养基(美国Gibco)、优质胎牛血清(乌拉圭Lonsera);TNF-α ELISA检测试剂盒(武汉伊莱瑞特,批号:K9BVC5A31Y)、AnnexinV-APC/7-AAD细胞凋亡检测试剂盒(武汉伊莱瑞特,批号:SH1ITFVUAW);BCA 法蛋白定量试剂盒(上海碧云天,批号:120320210323);Bax、Cyt-C、Bcl-2兔抗多克隆抗体及β-actin鼠抗多克隆抗体(武汉三鹰,批号分别为00082363,00041196,00092360和10004156);山羊抗兔或鼠荧光二抗(美国Invitrogen,批号分别为VC303853和V1308834)。
1.2 主要仪器
Scientific 3111 二氧化碳细胞培养箱(美国赛默飞);ACB-4A1 细胞培养用超净工作台(新加坡Esco);Calibor 流式细胞分析仪(美国BD);Spectramax Plus 384 酶标仪(美国Molecular Devices);Odyssey 双色红外荧光成像系统(美国LI-COR);荧光显微镜(日本OLYMPUS);Western blotting 全套电泳槽和转印槽(美国Bio-Rad)。
1.3 药物、疾病靶点及交集靶点的筛选
采用ChemDraw 软件绘制AA 的结构式导入Swiss Target Prediction 数据库(http://www.swisstargetprediction.ch/),同时以“asiatic acid”为关键词检索CTD(http://ctdbase.org/)和GeneCards 5.0 数据库(https://www.genecards.org/),将3 个数据库得到的作用靶点合并后删除重复值,得到AA 药物作用靶点。以“atherosclerosis”为关键词检索GeneCards 和TTD数据库(http://db.idrblab.net/ttd/),获取AS疾病靶点;其中GeneCards数据库将检索结果按Score值大于平均值的原则进行筛选。将2个数据库得到的靶点合并后删除重复值得到AS 疾病靶点并利用Uniprot 数据库(https://www.uniprot.org/)并进行进一步校正,最后通过Venny 2.1.0 在线工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html)得到AA与AS的交集靶点,即为AA抗AS的潜在作用靶点。
1.4 交集靶点蛋白质相互作用(PPI)网络的构建及核心靶点的筛选
将交集靶点导入String 11.5 数据库(https://string-db.org/),物种选择为“Homo sapiens”得到PPI 网络。利用Cytoscape 3.7.2 软件对PPI 网络进行拓扑学分析,根据各节点的中心度值(Degree)的大小将PPI 网络图可视化,并利用Cytohubba 插件计算并根据degree 值筛选出网络中Top 10 的核心靶点。
1.5 基因功能和通路富集分析及“药物-靶点-疾病-通路”网络图的构建
通过DAVID 6.8 数据库(https://david.ncifcrf.gov/)对交集靶点进行GO 及KEGG 分析,以P<0.01 和FDR<0.01 为标准筛选Top10 基因功能和Top 20信号通路,并使用微生信数据处理平台(http://www.bioinformatics.com.cn/)的在线作图工具对结果进行可视化。最后,运用Cytoscape 3.7.2 软件构建AA与Top 10 核心靶点及AS与Top 20信号通路的“药物-靶点-疾病-通路”网络模式图。
1.6 AA对LPS诱导的RAW264.7巨噬细胞的影响1.6.1 细胞培养及给药 在含10%胎牛血清的DMEM高糖培养液中,37 ℃、5%CO2培养箱中常规培养RAW264.7巨噬细胞。对数生长的巨噬细胞常规培养24 h 后分为空白组(control 组)、LPS 组、AA低剂量组(15 μmol/L)和AA 高剂量组(25 μmol/L)。空白组采用0.1%DMSO进行同期对照,LPS组采用1 μg/mL LPS处理细胞24 h,AA各剂量组则先用相应浓度AA孵育1 h后再加入1 μg/mL LPS继续孵育24 h。
1.6.2 ELISA 法检测细胞培养上清液TNF-α含量
收集各组细胞培养液上清,按试剂盒说明检测TNF-α含量。实验重复3次。
1.6.3 AnnexinV-APC/7-AAD双染法流式细胞术检测细胞凋亡率 根据试剂盒说明书进行染色处理后采用流式细胞仪检测细胞凋亡率。分布于散点图左下象限散点代表正常细胞,右下象限的散点代表APC单染的早期凋亡细胞,右上象限的散点代表双染的晚期凋亡细胞,凋亡率=早期凋亡率+晚期凋亡率。实验重复3次。
1.6.4 Western blotting 检测细胞凋亡相关蛋白表达 RIPA 裂解液提取细胞蛋白,BCA 蛋白定量试剂盒测定蛋白质浓度。12.5%SDS-PAGE电泳分离蛋白后转移至PVDF膜,封闭1 h。分别采用Bax(1∶1 000)、Bcl-2(1∶1 000)、Cyt C(1∶1 000)及内参βactin(1∶10 000)等一抗4 ℃冰箱孵育过夜,再加入荧光二抗(1∶10 000)室温避光孵育1 h。近红外双色荧光成像系统扫膜,Image J软件分析蛋白条带灰度值,蛋白质相对表达水平=各组目的条带的灰度值/内参的灰度值。实验重复3次。
1.7 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多样本组间比较采用单因素方差分析,方差齐时,组间两两比较采用LSD-t检验;方差不齐时,采用Tamhane's检验;以P<0.05为差异具有统计学意义。
2 结果
2.1 AA抗AS作用机制网络药理学预测分析
2.1.1 AA 与AS 的交集靶点 从数据库筛选获得158个AA药物作用靶点和1 314个AS疾病靶点,通过映射获得84 个AA 与AS 的交集靶点作为AA 抗AS的潜在作用靶点(图1)。
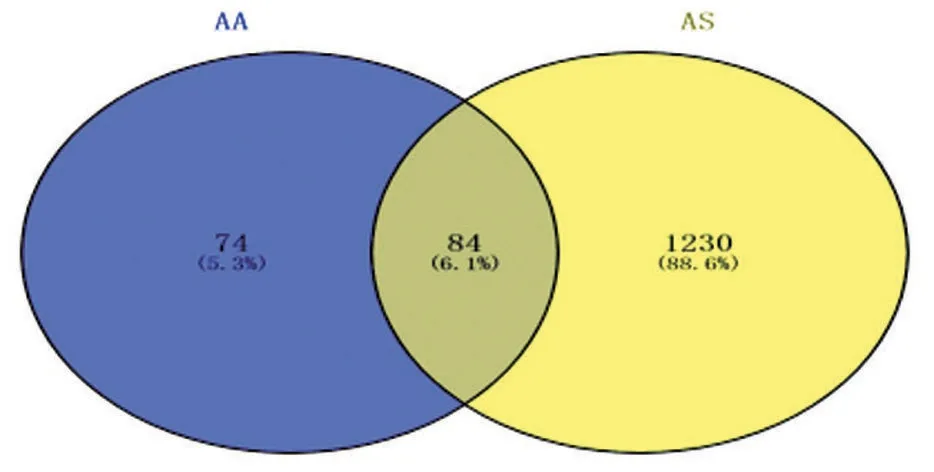
图1 AA-AS交集靶点韦恩图
2.1.2 交集靶点PPI 网络及核心靶点 在0.4 的中等置信度条件下,该PPI网络图(图2A)共包含84个节点和864 条边(其中MMACHC 和F13A1 两个靶点不连接其他蛋白,故不在PPI 中显示)。经网络拓扑学分析,各节点的平均自由度为20.6,PPI 富集P值<1.0 ×10-16。Cytohubba 插件筛选出的Top 10核心靶点所示,按degree 值排序依次为TNF、IL6、ALB、TP53、PTGS2、IL1B、PPARG、CASP3、ESR1、TLR4(图2B)。
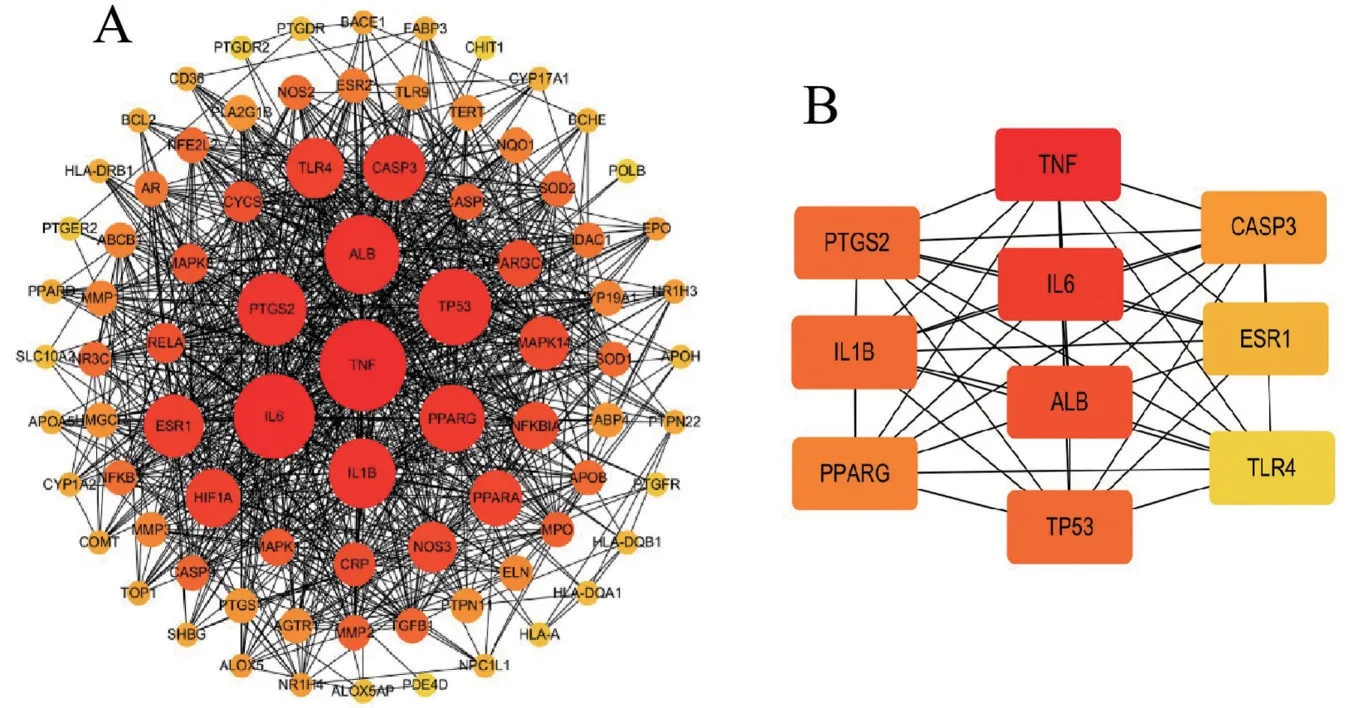
图2 AA-AS交集靶点PPI网络(A)及Top 10核心靶点图(B)
2.1.3 GO、KEGG 分析及“药物-靶点-疾病-通路”网络模型 GO分析包括生物学过程(BP)、细胞组分(CC)和分子功能(MF)。84 个交集靶点的GO分析共富集到505 个条目,其中所涉及BP 为362条,CC 为53 条,MF 为90 条,Top 10 富集条目条形图如图3A 所示。GO 分析结果提示,AA 通过调控多种生物学过程发挥抗AS 作用,其中生物学过程主要涉及负调控脂质储存、正调控髓系细胞凋亡过程、负调控巨噬细胞源性泡沫细胞分化等方面;细胞组分主要涉及I-kappaB/NF-kappaB 复合体、MHCⅡ类蛋白复合体等;分子功能主要包括超氧化物歧化酶活性、NF-kappaB结合、类固醇激素受体活性等多个方面。
KEGG 信号通路富集分析共涉及86 条信号通路,Top 20 富集结果的动态富集气泡图如图3B。KEGG 分析结果提示,AA 可能通过作用于多条信号通路发挥抗AS 作用,主要涉及TNF、NOD 样受体、凋亡(Apoptosis)、PPAR 等信号通路。其中,TNF、CASP9、CASP8、CASP3、BCL2、CYCS、TP53、RELA、NFKBIA和NFKB1 等10个靶点显著富集在凋亡信号通路上。
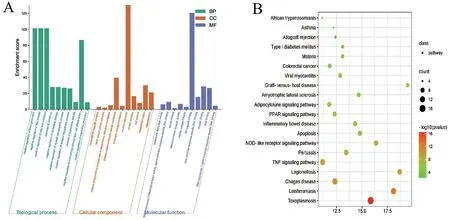
图3 GO(A)和KEGG通路(B)富集结果
构建的“药物-靶点-疾病-通路”网络模型如图4 所示,10个左侧节点代表AA抗AS作用的核心靶点,20个右侧节点表示AA抗AS作用的关键通路。
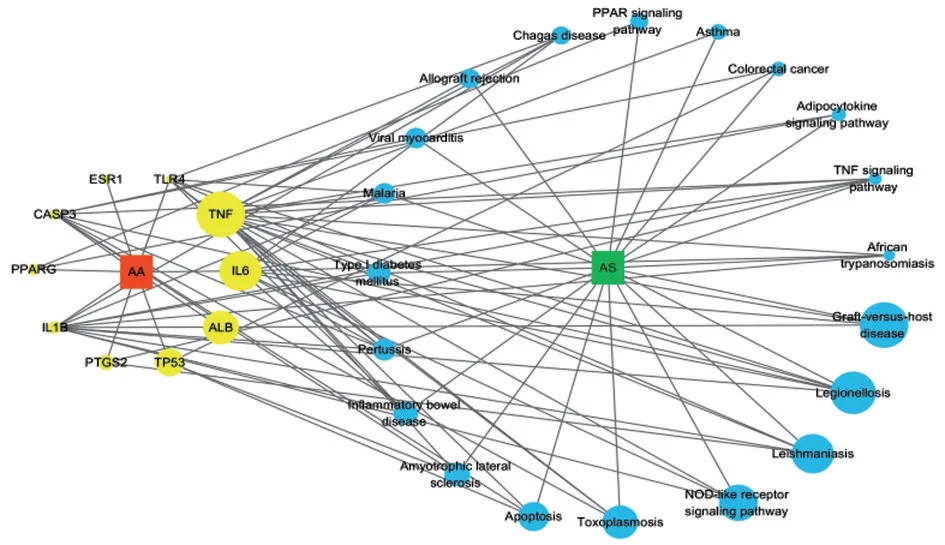
图4 “药物-靶点-疾病-通路”网络模型
2.2 细胞验证实验
2.2.1 AA 对LPS 诱导的RAW264.7 巨噬细胞释放TNF-α 的影响 与control 组相比,LPS 组炎症因子TNF-α 的含量增高(P<0.01);与LPS 组相比,AA高、低剂量组TNF-α 含量均降低,并呈现一定的浓度依赖趋势(P<0.05,P<0.01),结果见图5。
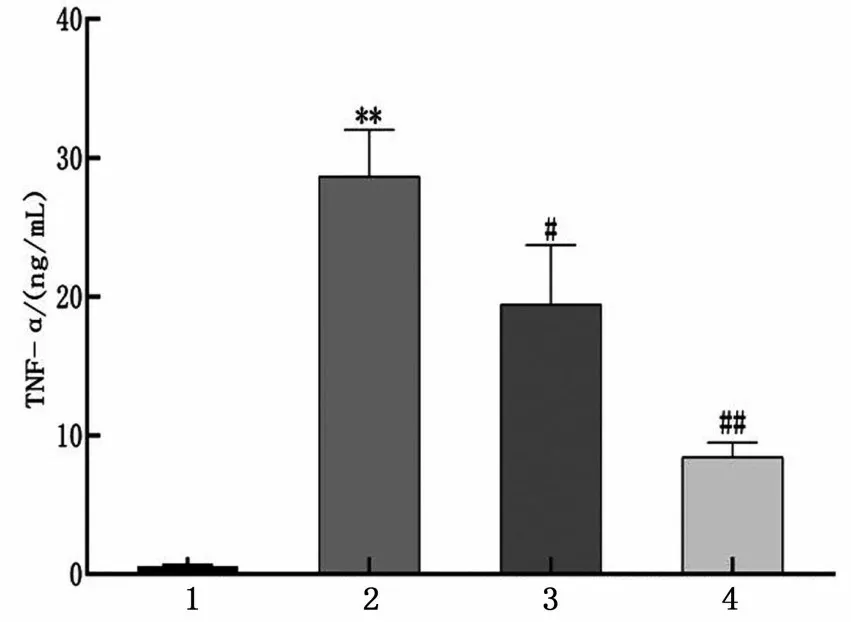
图5 AA 对LPS 诱导的RAW264.7 巨噬细胞释放TNF-α 的影响
2.2.2 AA 对LPS 诱导的RAW264.7 巨噬细胞凋亡率的影响
Annexin V-APC/7-AAD 双染色细胞凋亡检测结果表明,与control 组相比,LPS 组凋亡率均增加(P<0.05);与LPS 组比较,AA 高、低剂量组巨噬细胞凋亡率进一步提高,且凋亡率随着AA 浓度增加而升高(P<0.05,P<0.01),见图6。
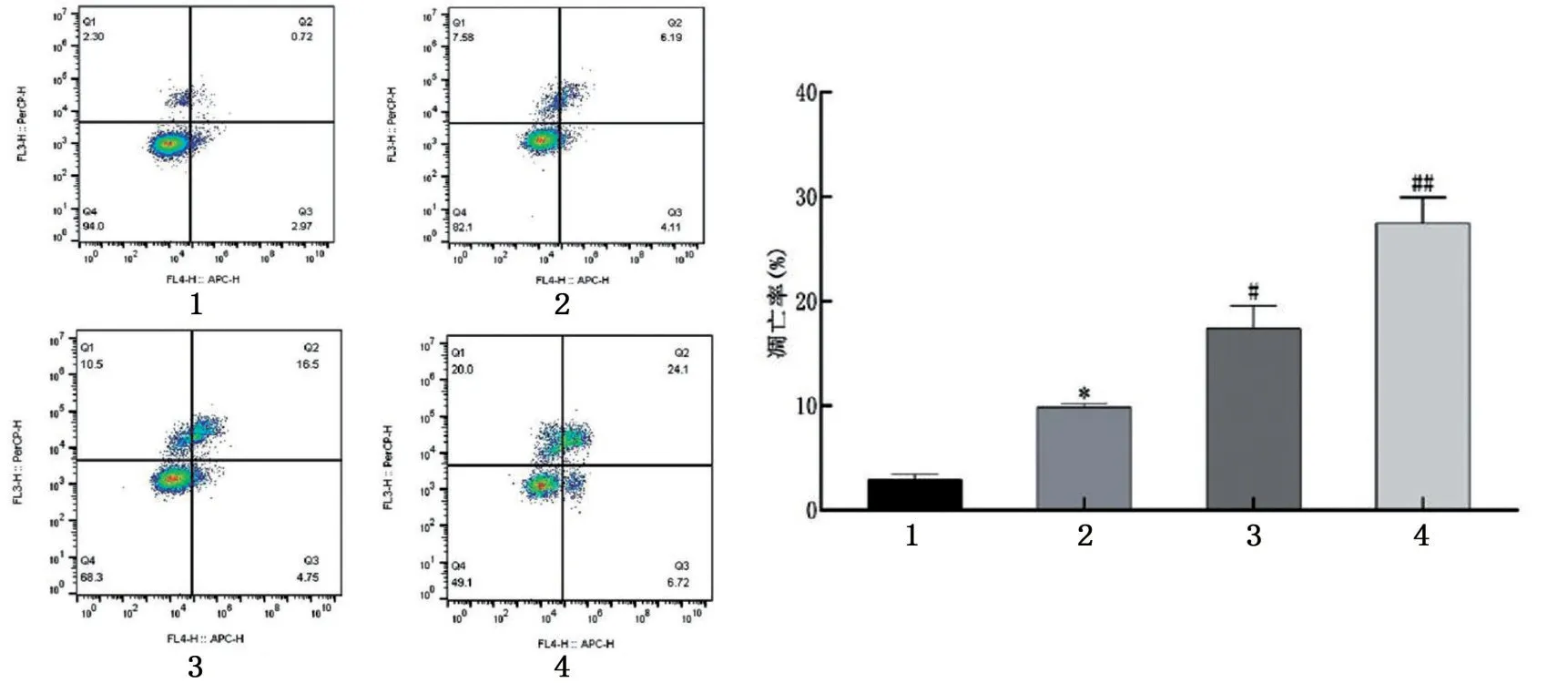
图6 AA对LPS诱导的RAW264.7巨噬细胞凋亡率的影响
2.2.3 AA 对LPS 诱导的RAW264.7 巨噬细胞凋亡相关蛋白表达的影响
Western blotting 实验结果显示,与control 组相比,LPS 组Bax 和Cyt C 蛋白表达增高而Bcl-2 表达下降(P<0.05,P<0.01);与LPS 组比较,AA 高、低剂量组进一步提高Bax和Cyt C表达和降低Bcl-2表达(P<0.05,P<0.01),结果见图7。
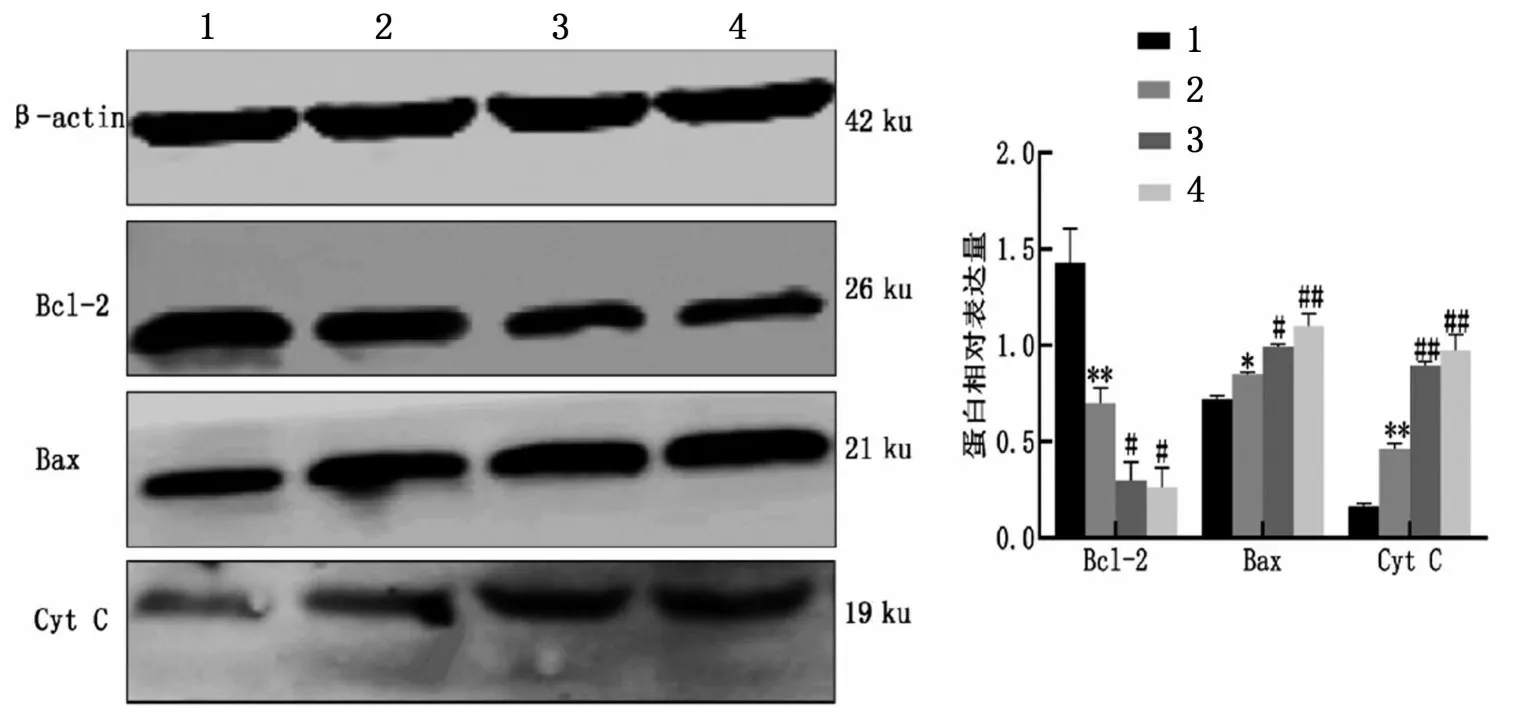
图7 AA对LPS诱导的RAW264.7巨噬细胞凋亡相关蛋白的影响
3 讨论
AS是一种慢性、连续性、进展性的疾病,其具体的分子机制非常复杂,涉及到炎症、氧化应激、细胞凋亡等多个方面。它们之间相互联系、相互促进、相互作用,共同促进AS向终末阶段发展[7]。在网络药理学分析中,共筛选出84 个AA 抗AS 的潜在作用靶点,PPI 网络进一步发现AA 抗AS 的核心靶点包 括TNF、IL1B、IL6、PPARG、TP53、PTGS2 和TLR4 等。进一步的GO 和KEGG 通路富集结果提示,AA 可能通过调控多种生物学过程和多个信号通路发挥抗AS作用,这与AA丰富的药理学活性相一致。其中,GO 富集分析主要涉及负调控脂质储存、正调控髓系细胞凋亡过程、负调控巨噬细胞源性泡沫细胞分化等条目;KEGG 分析则主要富集了TNF、NOD样受体、凋亡、PPAR等信号通路。
炎症反应贯穿AS 发病的各个阶段,可能是多种致AS因素致病机制的共同环节或通路[8]。AA可通过调控多种信号通路抑制炎症反应。在LPS 刺激的RAW264.7 巨噬细胞,AA 能够调控Notch 信号通路进而抑制TNF-α、IL-6、IL-1β 等炎症因子的表达[9]。AA还可以下调TLR4表达而抑制LPS诱导的肺部炎症反应[10]。PPAR 是核受体超家族的重要成员,其亚型PPARγ是连接炎症与脂质代谢的关键信号。荣霞等[5]报道,AA可通过抑制SIRT3/β-catenin/PPARγ 信号通路而减少TNF-α、IL-6 等炎症因子的释放,进而对急性心肌梗死大鼠心脏产生保护作用。AA也可抑制炎症因子PTGS2的表达进而改善肝损伤[11]。本研究中,在LPS 诱导建立的巨噬细胞炎症模型,AA 可浓度依赖地抑制炎症因子TNF-α的释放,表明AA具有明显的抗炎作用。
愈来愈多的研究结果表明,巨噬细胞凋亡在AS的病理机制中起着重要的作用:在AS早期,巨噬细胞凋亡可吞噬清除炎性因子以及凋亡坏死细胞从而抑制斑块的进展,通过增加早期AS 斑块中的巨噬细胞凋亡可以有效治疗AS;在AS晚期,巨噬细胞凋亡可释放炎症因子以及脂质蛋白、胆固醇等成分,增加易损斑块的不稳定性[12]。研究已证实,AA对多种肿瘤细胞具有诱导凋亡的作用[13],如AA 可诱导p53依赖的线粒体途径的凋亡而起到抗口腔鳞状细胞癌作用[14]。KEGG富集分析结果中,CASP9、CASP8、CASP3、BCL2、CYCS、TNF、TP53 等10 个靶点显著富集在凋亡信号通路上。其中,Bax、Cytc C 是重要的促凋亡蛋白,Bcl-2 属于抗凋亡蛋白,三者对细胞凋亡具有重要的调控作用。当细胞受到凋亡信号刺激时,Bax可通过增强线粒体膜通透性,改变跨膜电位,从而促使线粒体内细胞色素C 释放到细胞质中引起Caspase 的级联反应,引发细胞的凋亡[15]。在LPS 诱导的巨噬细胞炎症模型上,本研究发现AA 可进一步提高炎症巨噬细胞的凋亡率,上调Bax、Cyt C 和下调Bcl-2 蛋白表达,表明AA 具有促凋亡作用。
综上所述,AA可能通过多靶点、多通路发挥抗AS 作用,上调Bax、Cyt C 和下调Bcl-2 蛋白表达诱导巨噬细胞凋亡和抑制TNF-α 炎症因子释放可能是AA 抗AS 作用机制之一。研究结果为进一步研究AA抗AS作用机制提供了新的思路和实验依据,但仍需进一步深入研究并在动物层面进行验证。
