秦皮苷对脂多糖诱导的巨噬细胞极化的影响*
2022-05-29蒋春兰覃再嫩
韦 虹,蒋春兰,覃再嫩△,郑 立△
(1.广西医科大学再生医学与医用生物资源开发应用协同创新中心,南宁 530021;2.广西组织器官修复医用生物材料工程技术研究中心,南宁 530021)
巨噬细胞是机体重要的免疫细胞,参与机体固有的免疫应答和适应性免疫应答反应。越来越多的证据表明,巨噬细胞在炎症反应发挥了关键的作用[1]。巨噬细胞(RAW264.7)的激活状态和M1/M2比值与炎症的严重程度高度相关,其中M1 巨噬细胞分泌几种促炎细胞因子,包括白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、诱导型一氧化氮合酶(iNOS)和肿瘤坏死因子-α(TNF-α)等,可导致基质降解和炎症发生[2-3];M2 型巨噬细胞可以分泌一系列抗炎因子,如白细胞介素-10(IL-10),CD206,Arg-1 等来发挥抗炎作用和免疫抑制反应[4]。有研究发现,过度表达的活性氧(ROS)会引起机体内发生氧化应激反应,从而破坏组织稳态,加重炎症的进展[5-6],且过量的ROS 也会导致巨噬细胞向M1 型极化,促进炎症性因子的产生,加剧炎症[7-8]。因此,清除过量表达的ROS和调控滑膜巨噬细胞的极化状态,减少有害细胞因子的分泌,可以促进组织修复并延缓炎症的进程。
秦皮苷提取自秦皮,是秦皮的活性成分,有抗菌、抗炎、抗氧化、镇痛、抗病毒、抗高尿酸血症和利尿等功效[9-10]。有研究发现,秦皮苷可以通过降低氧化应激的水平,在体内外均表现出有效的肝保护作用[9]。然而,关于秦皮苷通过调控巨噬细胞极化控制炎症方面的研究目前仍较少。因此,本文旨在通过体外建立M1 型巨噬细胞极化模型,探讨秦皮苷对巨噬细胞M1/M2极化的影响,为秦皮苷治疗炎症方面的应用提供理论基础。
1 材料和方法
1.1 试剂和仪器
1.1.1 试剂 秦皮苷(纯度≥95%)(麦克林,中国);胎牛血清、DMEM 培养基(Gibco,美国);PBS、脂多糖(LPS)、青链霉素混合液(100×)、总RNA 提取试剂盒、实时荧光定量聚合酶链反应(RT-qPCR)试剂盒、ROS 检测试剂盒[二氯二氢荧光素二氢乙酸酯(DCFH-DA)](索莱宝,中国);细胞活力检测试剂盒(CCK-8试剂)(Biosharp,中国);逆转录试剂盒(Fermentas Company,美国);引物(金开瑞,中国);钙黄绿素-A/碘化丙啶(Calcein-AM/PI)(Sigma-Aldrich,美国);免疫荧光染料FITC-IgG(博士德,中国);CD206 一抗、iNOS 一抗(Gibco,美国);封闭用山羊血清(中杉金桥,中国);4’,6-二脒基-2-苯基吲哚(DAPI)(Solarbio,中国);1.1-二苯基-2-苦肼基(DPPH)(梯希爱,中国)。
1.1.2 仪器 超净工作台(苏州金燕净化设备有限公司,中国);二氧化碳恒温培养箱、核酸蛋白检测仪(Thermo Scientific,美国)、全波长酶标仪(Molecular Devices,美国)、ProFlex™PCR 系统(Thermo Fisher Scientific,美国);离心机(Eppendorf,德国);正置荧光显微镜(OLYMPUS,日本);Light-Cycler96实时定量PCR 仪(Roche,瑞士),流式细胞分析仪(BD Accuri C6,美国)。
1.2 DPPH试剂检测秦皮苷的自由基清除能力
称取一定量的DPPH,用无水乙醇配制成0.2 mmol/L的DPPH溶液。分别取400 μL不同浓度(0 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、100 μg/mL、160 μg/mL)的秦皮苷溶液,加入400 μL DPPH 溶液,混合均匀,室温放置30 min 后,10 000 r/min 离心5 min。取上清液于540 nm处测吸光度值,计算秦皮苷的自由基清除能力[自由基清除率=(1-各实验组的吸光度值/零浓度的吸光度值)×100]。
1.3 细胞培养
小鼠巨噬细胞系RAW264.7 细胞,购自中国科学院细胞库。细胞用含10%胎牛血清和1%双抗的DMEM 培养基,并置于条件为37oC、5%CO2的细胞培养箱中培养隔天换液,待细胞密度达到90%时即可传代。
1.4 CCK-8 试剂检测秦皮苷对RAW264.7 细胞的毒性
RAW264.7 细胞以5×103个/孔的密度种在96孔板中,待细胞贴壁后,加入不同浓度的秦皮苷溶液(0 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL、160 μg/mL)孵育24 h,用CCK-8 检测细胞活力,用全波长酶标仪测定孔板在450 nm处的吸光度值,计算细胞活力(细胞存活率=处理组吸光度值/对照组吸光度值×100)。
1.5 细胞分组与干预
将实验分为3 组,分别为对照组(未处理)、模型组(LPS)和实验组(LPS+秦皮苷),对照组加入完全培养基,模型组加入含10 μg/mL LPS 的完全培养基,实验组加入含10 μg/mL LPS和20 μg/mL秦皮苷的完全培养基。
1.6 Calcein-AM/PI染色检测秦皮苷对LPS 诱导的RAW264.7细胞活性的影响
将RAW264.7 细胞以2×105个/孔的密度种于含有爬片的6 孔板上,待细胞贴壁后,加药处理24 h,弃去培养基,用PBS 洗涤细胞3 次,加入含0.5%Calcein-AM 和2%PI的染色液,并在黑暗条件37oC下孵育5 min。用正置荧光显微镜观察并拍照,用Image J软件分析各组的活死细胞数,并分别计算各组活细胞比例(活细胞比例=活细胞数/活死细胞总数×100)。
1.7 DCFH-DA 荧光探针检测RAW264.7 细胞内过氧化氢水平
按照1∶1 000 的比例用无血清培养基稀释DCFH-DA 荧光探针,使终浓度为10 μmol/L。弃去细胞培养基,加入1 mL DCFH-DA 荧光探针稀释液,细胞置于37oC 的CO2培养箱中避光孵育20 min,用无血清培养基洗涤3 遍,在正置荧光显微镜下观察细胞的荧光强度,用Image J软件分析荧光强度的平均值。采用流式细胞仪检测细胞内过氧化氢的定量水平。
1.8 RT-qPCR检测秦皮苷对LPS诱导的RAW264.7细胞相关基因的表达
根据说明书,使用总RNA 分离试剂盒提取各组样品中的RNA,用逆转录试剂盒逆转录RNA 样品为cDNA。使用Light Cycle 96 系统进行DNA扩增,反应条件为:95oC 10 min,变性;95oC 15 min,退火;60oC 60 s,共45 个循环。GAPDH作为内参基因,采用2-ΔΔCT方法计算相对基因表达量。每个基因重复3次实验。基因引物序列见表1。

表1 RT-qPCR 的引物序列
1.9 免疫荧光染色评估RAW264.7 细胞内CD206和iNOS的表达水平
将RAW264.7 细胞以2×105个/孔的密度接种于6 孔板上,待细胞贴壁后,加药处理并在37oC、5%CO2的培养箱中继续培养24 h。弃培养基,PBS 洗涤3 次,用4%多聚甲醛室温固定15 min,PBS 洗涤3 次,每次2 min。用3% H2O2孵育15 min,PBS 洗涤3 次,每次2 min;然后用封闭用山羊血清处理15 min,倒掉血清,勿洗。分别加入一抗iNOS、CD206(1∶200),并在4oC 冰箱孵育过夜或37oC 冰箱孵育4 h,PBS 洗涤3 次,每次2 min,然后在室温下加入二抗(anti-goat IgG-FITC,1∶200),在37oC的黑暗条件下孵育1 h,PBS 洗涤3 次,每次2 min 钟;用DAPI(1 μg/mL)染色,黑暗条件下孵育10 min,PBS洗涤3次,每次2 min。然后用抗荧光淬灭剂封片,最后用荧光显微镜观察并拍照。
1.10 统计学方法
采用SPSS 20.0软件对数据进行统计分析。定量资料采用均数±标准差(±s)表示,多组间比较进行单因素方差分析(one-way analysis of variance,ANOVA),组间两两比较采用LSD-t检验,两者间线性关系采用趋势性检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 秦皮苷自由基清除能力检测
当秦皮苷浓度为20 μg/mL时,其自由基清除率约为34%;随着秦皮苷浓度的增加,自由基清除率增加(P<0.001),见图1。
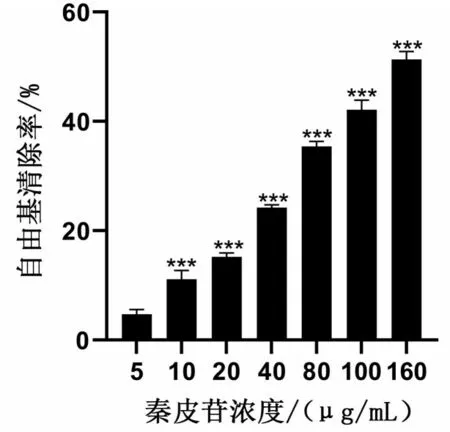
图1 DPPH检测秦皮苷的总抗氧化能力
2.2 秦皮苷对RAW264.7细胞的毒性作用
当秦皮苷的浓度为20 μg/mL 时的细胞活力最好(P<0.05),见图2;表明秦皮苷的浓度为20 μg/mL 时RAW264.7 细胞的增殖作用最明显。因此,将20 μg/mL 作为后续实验研究的有效浓度。
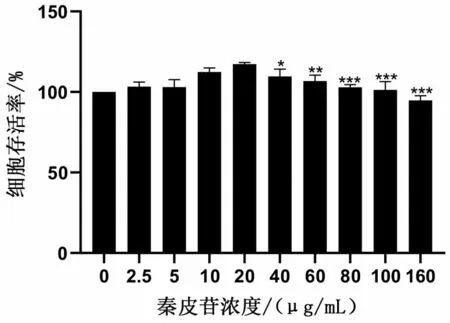
图2 秦皮苷对RAW264.7细胞活性的影响
2.3 秦皮苷对LPS 诱导的RAW264.7 细胞活性的影响
与对照组相比,模型组活细胞数目减少,死细胞数目增多,细胞活力降低(P<0.01)。与模型组相比,实验组活细胞数目增多,死细胞数目减少(P<0.01),见图3。
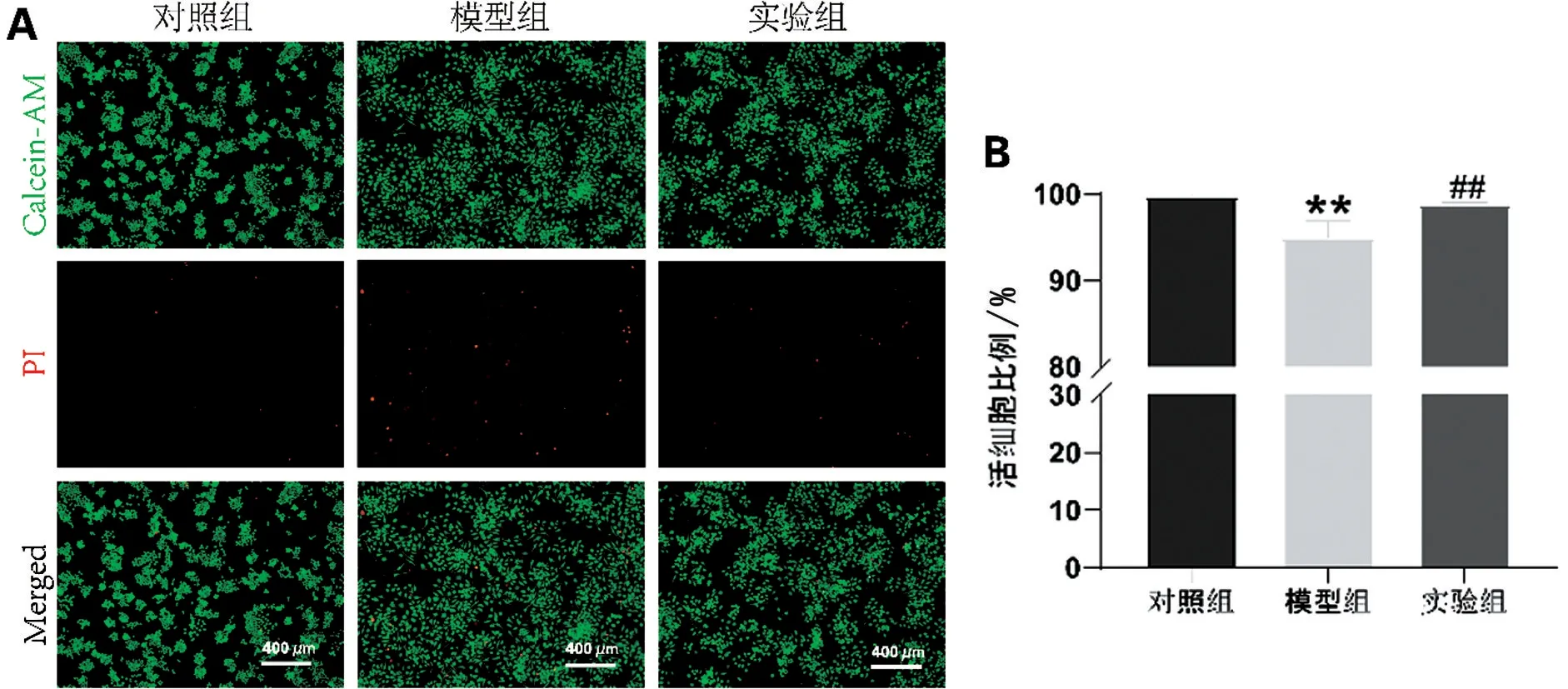
图3 Calcein-AM/PI 染色检测细胞活性
2.4 秦皮苷对RAW264.7 细胞内ROS 的水平的影响
与对照组相比,模型组的细胞荧光强度增强(P<0.001),而加入秦皮苷处理后,细胞荧光强度下降(P<0.001),见图4。同时,进一步通过流式细胞仪检测细胞内ROS 产生情况,与对照组相比,模型组的ROS含量增加了28.9%,而与模型组相比,实验组的ROS含量降低了25.7%,见图5。
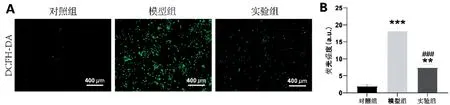
图4 秦皮苷对RAW264.7细胞内ROS的影响
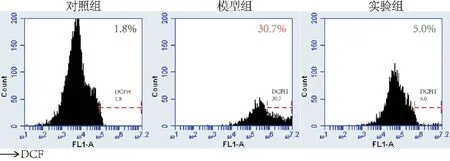
图5 流式细胞仪检测RAW264.7细胞内ROS的水平
2.5 秦皮苷调控RAW264.7细胞的极化
与对照组相比,模型组中RAW264.7 细胞iNOS、IL-6、IL-1β、TNF-α和CD86等M1型相关基因表达增加(均P<0.05);与模型组相比,实验组中RAW264.7细胞iNOS、IL-6、IL-1β、TNF-α和CD86表达下降,Arg-1、IL-10和CD206等M2 型相关基因表达增加(均P<0.05),见图6。
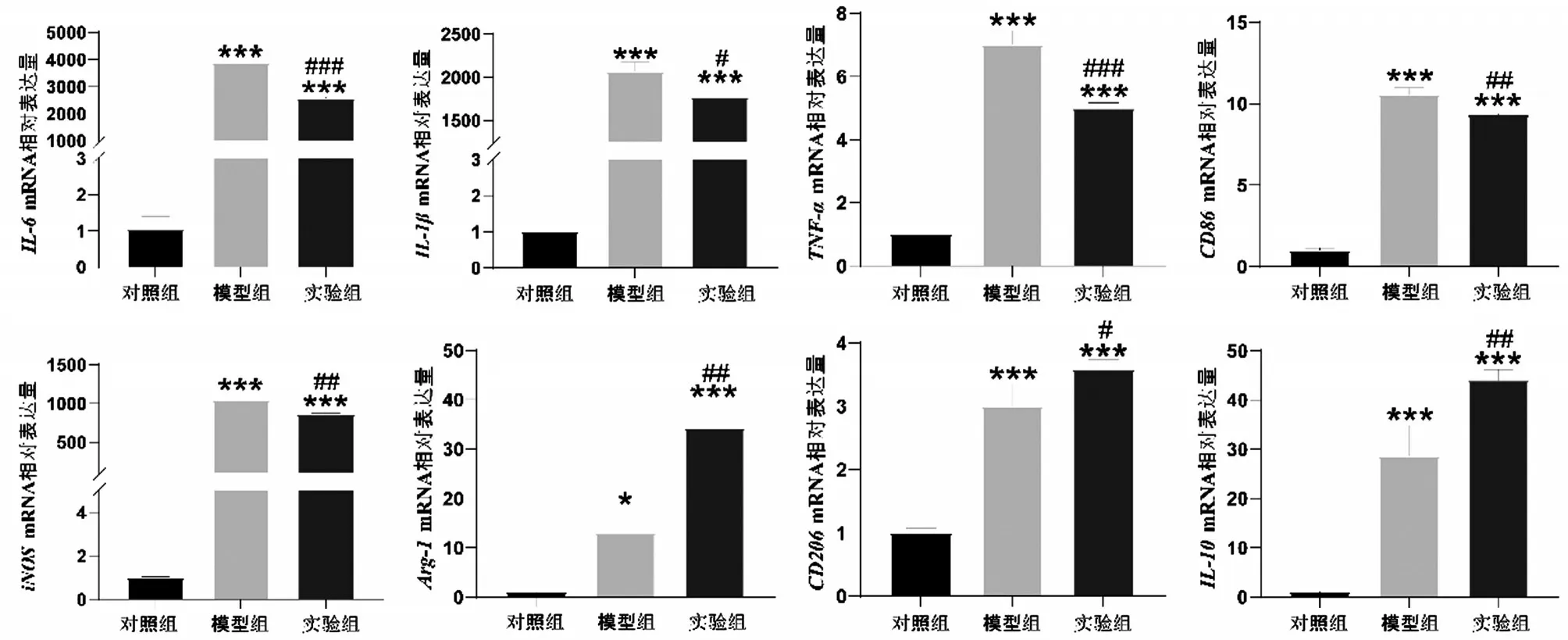
图6 秦皮苷对RAW264.7细胞相关基因表达水平的影响
2.6 秦皮苷对LPS 诱导的RAW264.7 细胞相关蛋白表达的影响
与对照组相比,模型组中M2 型巨噬细胞相关标志物CD206 的染色荧光强度较弱(P<0.001);与模型组相比,实验组细胞荧光强度增强(P<0.001);与对照组相比,模型组中M1型RAW264.7细胞相关标记物iNOS的染色荧光强度较强(P<0.001),与模型组比较,实验组细胞荧光强度下降(P<0.001),见图7。
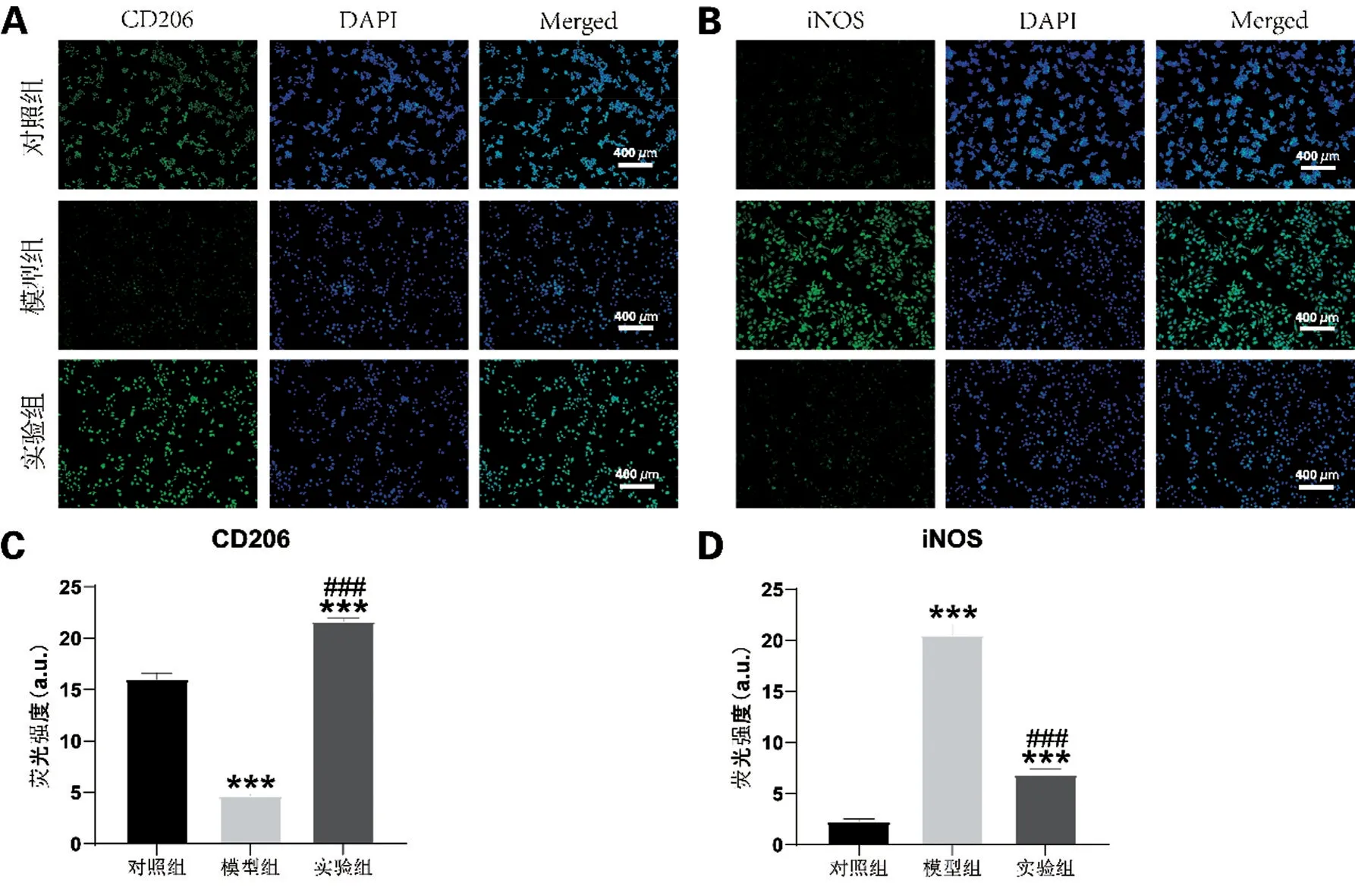
图7 免疫荧光染色检测RAW264.7细胞相关蛋白的表达水平
3 讨论
巨噬细胞是吞噬性白细胞,在先天免疫反应中发挥重要作用[11]。由感染、炎症或损伤引起的组织稳态紊乱会显著改变组织局部环境,影响巨噬细胞活化状态和新陈代谢。在持续刺激的情况下,巨噬细胞可被激活并向M1 型极化,这将会促进组织损伤和疾病[12]。秦皮苷是一种香豆素类化合物,是中草药秦皮的主要成分[10],已知具有抗炎、抗氧化、抗病毒等作用[9-10]。本文就秦皮苷通过诱导巨噬细胞向M2 极化并抑制巨噬细胞的M1极化来减缓炎症的进展进行探讨,有望通过抗炎和抗氧化的作用减缓炎症的发生和进展。
秦皮苷具有生物相容性良好的优点,即便较大剂量也不会影响细胞的增殖[13]。Calcein-AM/PI 染色结果显示,经LPS 处理后的巨噬细胞数量减少,而经秦皮苷处理后的巨噬细胞数量增加,说明秦皮苷对巨噬细胞具有保护作用。有研究发现,ROS在炎症反应中高表达,通过清除细胞内的ROS 抑制氧化应激,对炎症的治疗起着关键的作用[14]。本研究中DPPH结果显示,随着秦皮苷浓度的增加,其自由基清除能力逐渐增强,表明其具有良好的总抗氧化能力。由于进入细胞的非荧光DCFH-DA可被细胞内ROS 氧化成荧光DCF,其荧光强度与ROS 水平成正比[15],因此,利用DCFH-DA 荧光探针可以检测细胞内的ROS。本研究结果也表明了秦皮苷具有清除巨噬细胞内ROS、抑制氧化应激的作用。
研究表明,在炎症反应过程中,活化的巨噬细胞分泌相关的细胞因子和趋化因子会促进炎症的发生和发展[16-18]。因此,抑制炎症因子的过度表达可以延缓炎症的进展。本研究发现,经LPS 处理后,巨噬细胞分泌的相关炎症因子如iNOS、IL-1β、TNF-α、CD86和IL-6表达升高,向M1 型极化并加重炎症反应。而经秦皮苷处理后,相关炎症因子表达下降,抗炎因子如Arg-1、IL-10和CD206表达上升,巨噬细胞向M2型极化发挥抗炎作用。同时,巨噬细胞的显著特征是M1 表型的iNOS 特异性表面受体和M2 表型的CD206 表面受体[19-20]。本研究结果显示,经LPS 诱导后,M1 型巨噬细胞相关蛋白(iNOS)表达升高,M2 型巨噬细胞相关蛋白(CD206)表达下降,经秦皮苷处理后,M1 型相关蛋白的表达受到抑制,M2型相关蛋白表达升高,这些结果与上述巨噬细胞相关基因表达水平结果一致,说明秦皮苷的处理可以逆转LPS诱导的不良反应,促使巨噬细胞从促炎M1型向抗炎M2型极化,从而发挥抗炎作用。这些结果都表明了秦皮苷能够抑制LPS诱导发生的炎症。
综上所述,秦皮苷能够清除细胞内的ROS,降低细胞内的氧化应激反应,同时抑制巨噬细胞向促炎M1 表型极化,并促进其向抗炎M2 表型极化,从而分泌相关抗炎因子发挥抗炎作用,促进炎症转归,但其作用机制有待进一步研究。
