基于DWI和FLAIR的机器学习预测急性脑卒中发病时间的研究
2022-05-28郭静丽彭明洋王同兴陈国中殷信道刘浩
郭静丽,彭明洋,王同兴,陈国中,殷信道,刘浩
作者单位:南京医科大学附属南京医院(南京市第一医院)医学影像科,南京210006
醒后卒中是指入睡前无明显异常而起床后发现神经功能缺损症状的卒中,是缺血性卒中的一个亚型,约占缺血性卒中的14%~25%[1-2]。由于发病时间不确定,目前大多数醒后卒中被排除在静脉溶栓治疗之外。因此,准确预测卒中发病时间对患者的治疗至关重要。以往的研究认为弥散加权成像(diffusion weighted imaging,DWI)和液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)不匹配可显示缺血组织的发展情况,进而选择可能受益于溶栓治疗的醒后卒中患者[3-4]。然而,DWI-FLAIR 不匹配敏感度低、主观性强,可能会高估实际发病时间,因此排除了太多可能从溶栓治疗中获益的患者。近年来,影像组学和机器学习的发展为醒后卒中发病时间的预测提供了新的方法。影像组学可从图像中提取高维的定量特征(包括人类肉眼看不见的特征)[5],机器学习能够从数据集中自动学习这些特征,进而构建预测模型,实现精准诊断及预测[6]。以往的研究显示醒后卒中患者的早期影像学特征与已知发病时间的脑卒中患者相似。因此,本研究基于发病时间明确的急性脑卒中患者的DWI 和FLAIR 图像,利用影像组学和机器学习方法构建预测卒中发病时间的预测模型,为醒后卒中发病时间预测提供指导。
1 资料与方法
1.1 研究对象
本研究经过南京医科大学伦理委员会批准[批准文号:(2019-664)],免除受试者知情同意。回顾性分析2017 年1 月至2020 年12 月在南京市第一医院就诊的急性脑卒中患者的临床及影像资料。入组标准:(1)发病时间明确;(2)发病24 h以内;(3)治疗前行MRI检查。排除标准:(1)存在脑出血、肿瘤、外伤或手术史;(2)参与其他研究,接受额外药物或治疗;(3)图像伪影或其他因素影响图像评估。最终共有188 例患者纳入本次研究,其中男109 例,女79 例,年龄(74.15±13.28)岁。根据发病至图像采集时间,将患者分为发病时间≤4.5 h 组(91 例)和>4.5 h 组(97例)[7]。采用随机分层抽样法将患者随机分为训练集131例,测试集57例。
1.2 检查方法
采用Philips Ingenia 3.0 T MRI 扫描设备。扫描参数如下:DWI采用自旋回波序列:TR=2501 ms,TE=98 ms,FA=90°,视野=230 mm×230 mm,矩阵=152×122,层厚6 mm,18 层,层间距1.3 mm,b=0、1000 s/mm2;FLAIR 采用反转恢复序列:TR=9000 ms,TE =120 ms,TI=2600 ms,矩阵=356×151,视野=230 mm×230 mm,FA=90°,层厚6 mm,层间距1.3 mm。
1.3 影像分析
DWI-FLAIR不匹配定义为DWI图像上责任血管供血区高信号且ADC 为低信号区域在FLAIR 图像相应区域未表现为高信号。由2 名具有6 年工作经验的神经放射学诊断医师采用双盲法进行评估,意见不一致时与另一位具有10年工作经验的神经放射学诊断医师共同商定。
1.4 影像组学特征提取及筛选
影像组学特征提取及筛选分为感兴趣区分割、特征提取及特征筛选三个步骤,具体步骤如下:(1)感兴趣区分割:使用ITK-SNAP 软件(版本3.4.0,http://www.itksnap.org)手动分割DWI 高信号急性脑梗死区和对应的FLAIR 急性梗死区作为感兴趣区(region of interest,ROI) (图1)。由1 名有10 年神经影像诊断经验的放射科医师进行ROI 的勾画。(2)特征提取:使用人工智能应用平台(artificial intelligent kit,A.K.) (人工智能工具包V3.0.0.R,GE Healthcare)对图像进行图像插值、强度归一化和灰度级离散化预处理。再分别对DWI和FLAIR的ROI进行特征提取,包含一阶特征(First Order)、灰度共生矩阵特征(gray-level co-occurrence matrix,GLCM)、灰度相关矩阵(gray-level dependence matrix,GLDM)、灰度游程矩阵(gray-level run length matrix,GLRLM)、灰度尺寸区域矩阵(gray-level size zone matrix,GLSZM)、相邻灰度差分矩阵(neighboring gray tone difference matrix,NGTDM)等共396 个特征。(3)特征筛选:使用方差分析、Spearman 相关性检验及最小绝对收缩与选择算子算法(least absolute shrinkage and selection operator,LASSO)逐步进行特征筛选,通过构造惩罚函数得到一个较为精练的模型,压缩一些回归系数,并设定一些回归系数为零,同时采用十折交叉验证对模型参数进行最优化。
图1 DWI和FLAIR感兴趣区分割示意图。Fig.1 Schematic diagram of region of interest segmentation on DWI and FLAIR images.
1.5 模型构建
应用支持向量机(support vector machine,SVM)分类器,对筛选的特征进行机器学习,构建模型。SVM采用线性核,应用五折交叉验证进行模型训练。
1.6 统计学方法
临床数据应用SPSS 26.0软件进行统计学分析。应用Kolmogorov-Smimov 检验计量资料是否符合正态分布,正态分布的计量资料以均数±标准差表示并用独立t检验分析;计数资料采用例数(百分率)表示并用卡方检验分析。P<0.05 为差异有统计学意义。应用Kappa 检验进行观察者间一致性分析,Kappa 值大于0.75 表示一致性好。应用ROC 曲线评估DWI-FLAIR预测发病时间的准确度。LASSO回归模型、SVM 分类器分别基于“glmnet”、“e1071”程序包完成。应用Sklearn (http://scikit.learn.org/stable/) 机器学习模块的受试者操作特征(receiver operating characteristic,ROC)曲线分析评估模型预测卒中发病时间的预测效能。获得受试者工作特征曲线下面积(area under curve,AUC)、准确度、敏感度、特异度、阳性预测值、阴性预测值等模型评价指标。人工识别与机器学习模型效能间比较采用Delong检验。P<0.05为差异有统计学意义。
2 结果
2.1 人工识别DWI-FLAIR不匹配预测发病时间结果
共188例患者纳入分析,发病时间≤4.5 h组患者共91例,其中45例(49.45%)患者表现为FLAIR高信号,DWI-FLAIR 不匹配46 例(50.55%),观察者间一致性为k=0.95 (95%CI:0.92~0.99)。发病时间>4.5 h组患者97例,其中74例(76.29%)患者表现为FLAIR高信号,DWI-FLAIR不匹配23例(23.71%),观察者间一致性为k=0.93 (95%CI:0.91~0.97)。发病时间≤4.5 h组与发病时间>4.5 h组患者间性别、年龄、入院时美国国立卫生院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分、闭塞血管情况、高血压、糖尿病、高脂血症及高同型半胱氨酸差异均无统计学意义(P>0.05) (表1)。ROC 分析显示人工识别DWI-FLAIR 不匹配预测急性脑卒中发病时间的AUC 为0.634,敏感度和特异度分别为0.667、0.622 (表2)。

表1 发病时间≤4.5 h组和发病时间>4.5 h组的临床基线资料比较Tab.1 Comparison of basic clinical data between onset time ≤4.5 h and onset time >4.5 h

表2 人工识别及机器学习方法预测急性卒中发病时间的效能Tab.2 Efficacy of human readings and machine learning methods in predicting onset time of acute stroke
2.2 机器学习模型预测发病时间结果
DWI 和FLAIR 分别提取了396 个特征,通过方差分析+秩和检验后剩下168 个特征,Spearman 相关性检验后剩下56 个特征,最后使用LASSO 降维后选择的特征数为10 个,包含7 个DWI 特征(3 个GLCM、1 个GLRLM、2 个GLSZM、1 个First Order)和3 个FLAIR 特征(1 个GLCM、1 个GLRLM、1 个First Order)。影像组学特征的LASSO 系数分布图见图2,筛选的最佳影像组学特征热图见图3。基于所得的最佳影像组学特征构建急性卒中发病时间的预测模型。ROC 曲线分析显示训练集患者预测发病时间的AUC 为0.975,敏感度和特异度分别为0.932、0.950,准确度为0.939;测试集患者预测发病时间的AUC 为0.915,敏感度和特异度分别为0.868、0.852,准确度为0.862 (图4)。人工识别与机器学习模型间比较差异有统计学意义(人工识别vs.训练集:Z=0.771,P=0.001;人工识别vs.测试集:Z=1.336,P=0.003)。

图2 影像组学特征降维LASSO 系数收敛图。每条曲线代表了不同惩罚系数对应的自变量系数的变化轨迹,虚线为最小惩罚系数。LASSO:最小绝对收缩与选择算子算法。Fig. 2 The distribution of LASSO coefficients of radiomics. Each curve represents the change track of independent variable coefficients corresponding to different penalty coefficients, and the dotted line is the minimum penalty coefficient. LASSO: least absolute shrinkage and selection operator.

图3 最佳筛选的10 个特征的相关性热图。每个小方块代表第j 列患者对应第i 行特征的权重值经过Z-score 转换后的值对应的颜色大小,其中红色代表高,绿色代表低。Fig. 3 The correlation heatmap of the best screened 10 features. Each small square represents the color size corresponding to the weight value of the characteristic of row i corresponding to the patient in column j after Z-score conversion,in which red represents high and green represents low.
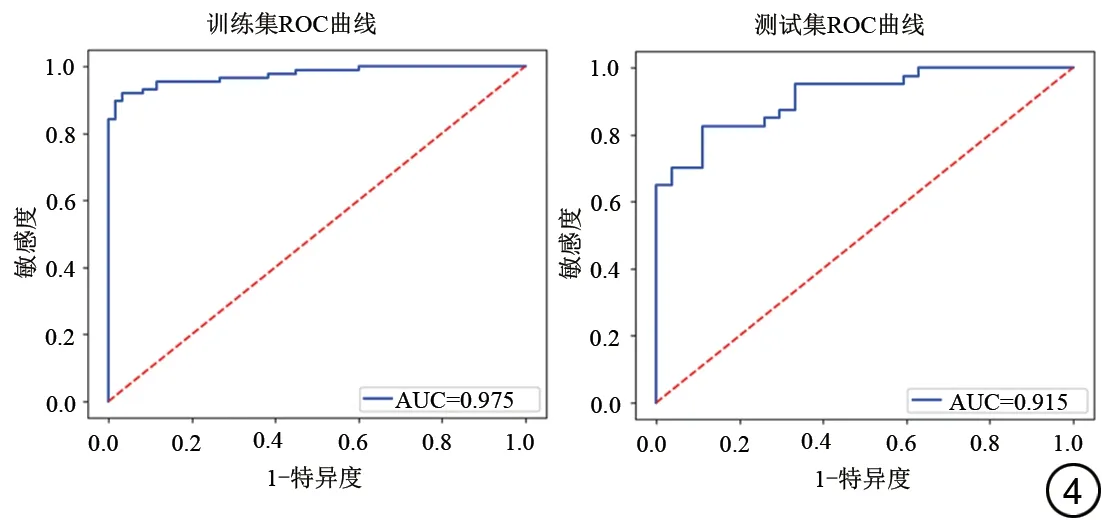
图4 训练集和测试集用于急性脑卒中发病时间预测的ROC曲线。Fig. 4 Receiver operating characteristic curve of training set and test set for predicting onset time of acute stroke.
3 讨论
本研究对188例DWI和FLAIR的影像组学特征进行筛选、降维,共筛选出与醒后卒中发病时间密切相关的10 个影像组学特征,包含7 个DWI 特征(3 个GLCM、1个GLRLM、2个GLSZM、1个First Order)和3个FLAIR 特征(1 个GLCM、1 个GLRLM、1 个First Order)。经机器学习建模后,结果显示该模型预测醒后卒中时间窗的效能明显优于传统人工识别。本研究结果可有效克服由于人工识别的主观性及可变性带来的主观误差及低敏感性。通过构建的模型可使临床医生能够通过模型快速准确地判断醒后卒中的发病时间,指导临床个性化的溶栓治疗。
3.1 醒后卒中发病时间传统预测方法
醒后卒中患者常不能提供准确的发病时间,给溶栓治疗带来了困难。影像学检查在患者发病时间的评估和治疗中具有重要的作用。DWI 对细胞源性水肿敏感,而FLAIR 对血管源性水肿敏感[8-9]。脑卒中发生的几分钟内便可检测到病变区域的表观扩散系数降低,即DWI 信号增强,随着卒中的发展,血管源性水肿在1~4 h 内发生,随后可观察到FLAIR 增强[10]。因此,目前研究推荐采用DWI 和FLAIR 不匹配征象识别发病时间≤4.5 h 的患者,从而指导临床治疗[11]。
以往已有较多研究显示DWI-FLAIR 不匹配可预测急性脑卒中发病时间[12-14]。耿文等[15]研究显示DWI-FLAIR 不匹配预测卒中发病时间(<180 min、180~270 min、≥270 min)的AUC 为0.753,当临界值为181.5 min 时,其预测敏感度和特异度分别为84.6%、55.1%。Emeriau 等[16]发现DWI-FLAIR 不匹配虽然可预测卒中发病4.5 h以内的患者,但其敏感度较低(0.55),特异度较低(0.60)。本研究结果显示DWI-FLAIR 预测卒中发病时间的AUC 为0.634,敏感度和特异度分别为0.667、0.622。与以往的研究结果一致。人工识别的敏感度和特异度较低的原因可能为DWI-FLAIR评估方法仅通过DWI和FLAIR匹配与否,而不考虑病灶的其他特征。Emeriau 等[16]的研究中约有44.5%的患者在4.5 h内FLAIR信号可发生变化,而本研究中约49.45%患者在4.5 h内FLAIR表现为高信号,这就严重影响了DWI-FLAIR不匹配的预测效果。此外,Duchaussoy等[17]发现T2弛豫时间差异、比率、绝对T2 弛豫时间及FLAIR 信号强度比与卒中发病时间相关,T2指标可能成为具有轻微FLAIR高信号的醒后卒中发病时间评估工具。以往的研究显示病变摄水率是一种基于CT 的成像生物标志物,可反映血管源性水肿,可在一定程度上评估卒中的发病时间[18-19]。然而,这些评估方法仍存在敏感度低、参数不统一、主观性强等不足,临床上应用这些指标筛选受益于溶栓治疗的卒中患者仍十分谨慎。
3.2 醒后卒中发病时间机器学习预测方法
近年来,影像组学的发展为急性脑卒中发病时间的预测提供了新的契机。它可挖掘图像中肉眼无法感知的信息,提取高通量的纹理特征,从而促进疾病的识别和分类[20]。目前在急性脑卒中的诊断、治疗及预后评估中已有较多研究[7,21-22]。本研究基于DWI和FLAIR 的影像组学特征提取和筛选,最终筛选出10 个与发病时间密切相关的特征,包含7 个DWI 特征和3 个FLAIR 特征。一阶特征可以定量的方式描述图像中体素分布;灰度共生矩阵特征可反映病变的同、异质性;灰度游程矩阵特征可反映图像纹理的方向性和粗糙程度等信息[23]。这些特征可为预测急性卒中发病时间提供更多肉眼无法识别的信息。
机器学习模型能够利用和学习数据来进行预测,因其较好的分类效能已广泛应用于医疗领域。本研究基于以上筛选的最佳影像组学特征进行机器学习构建模型,结果显示其预测效能明显优于人工识别的结果。Lee 等[24]利用DWI 和FLAIR 每个序列的89 个影像组学特征进行机器学习预测发病时间,结果显示机器学习方法同样优于人工识别。但本研究较Lee等研究提取了更多的影像组学特征,较多的特征可能为预测发病时间提供更多的信息。Ho 等[25]基于FLAIR、DWI 和灌注成像进行深度学习预测发病时间,敏感度为79%,特异度为61%。该模型需要完整的MRI 序列(包括灌注成像序列)。然而,大部分患者由于症状较重或基层医院条件受限,可能无法完成灌注成像。本研究的模型仅使用了常规的FLAIR和DWI序列来预测发病时间,具有更普遍的适用性。
3.3 局限性分析
本研究仍存在一定的局限性。首先,本研究为单中心回顾性研究,为确保两组样本均衡,在样本选择时可能存在偏倚。其次,本研究仅以4.5 h为分界预测卒中患者发病时间,但有研究认为静脉溶栓的时间窗可延长至6 h。因此本研究模型会使部分发病时间在4.5~6 h并可进行静脉溶栓的患者排除在外。此外,本研究未做外部验证。
综上所述,基于DWI 和FLAIR 影像组学的机器学习,能够较为准确地预测急性脑卒中患者的发病时间,为临床静脉溶栓治疗的选择提供影像指导。
作者利益冲突声明:全部作者均声明无利益冲突。
