水稻AP2/ERF转录因子基因OsERF096启动子克隆及活性分析
2022-05-27陈悦陈茜董伟峰才晓溪沈阳杨珺凯贾博为孙明哲孙晓丽
陈悦,陈茜,董伟峰,才晓溪,沈阳,杨珺凯,贾博为,孙明哲,孙晓丽
(黑龙江八一农垦大学 农学院 作物逆境分子生物学实验室,黑龙江 大庆 163319)
0 引 言
水稻(OryzasativaL.)是世界上最主要的粮食作物之一[1]。由于水稻起源于热带和亚热带地区,因此相比其他谷类作物,水稻对冷胁迫更敏感。低温对水稻的伤害主要表现为种子发芽缓慢、幼苗萎蔫或黄化、孕穗期及抽穗开花期花药不开裂、花粉不能正常发育等,导致结实率降低,产量下降[2]。低温冷害严重制约我国水稻生产,世界水稻主产区也普遍存在低温冷害问题[3]。因此,解析水稻耐冷调控机制,提高水稻耐冷性对保障水稻高产、稳产具有重要的现实意义。
AP2/ERF(APETALA2/ethylene-responsive factor)是一类植物中广泛存在的转录因子,该家族蛋白含有一个保守的 AP2/ERF DNA结合结构域[4]。AP2/ERF家族依据蛋白结构域相似性可分为 AP2(APETALA2)、ERF(Ethylene-responsive)、DREB(Dehydration-responsive element binding proteins)、RAV(Related to ABI3/VP1)和 Soloist共5个亚家族[5]。已有研究表明,AP2/ERF转录因子可结合 GCC-box(AGCCGCC)、DRE/CRT(A/GCCGAC)或 GT-1(GAAAAA)等元件,调节下游靶基因表达,最终引起生理生化变化,帮助抵抗外界逆境胁迫[6]。其中,DREB亚家族蛋白被证明是植物冷胁迫应答网络的核心组分,又称CBF(C-repeat binding factor)[7-9]。OsDREB1A-C在水稻冷胁迫期间被显著诱导表达,可通过与 GCC-box 结合激活靶基因表达参与水稻冷胁迫应答[10]。遗传学证据显示OsDREB1A、OsDREB1B、OsDREB1D和OsDREB1F过表达增强了转基因水稻和拟南芥对冷胁迫的耐受性[11-13]。但目前对ERF亚家族参与冷胁迫的研究报道较少。
启动子作为基因表达的重要调控元件,能够控制基因转录,决定基因的表达水平,是表达载体的重要组成部分[14]。已有多个研究报道,水稻AP2/ERF启动子中存在多种顺式作用元件,并鉴定了其上游的转录因子/蛋白。ERF 亚家族蛋白OsDERF1(Drought-responsive ERF genes)和 OsERF109 可直接与OsERF3和OsAP2-39启动子中的GCC-box或DRE/CRT元件结合,激活其基因表达,负调控水稻耐旱性[15-16]。研究发现,光敏色素相互作用因子OsPIL16(Phytochrome interacting factor-like protein)能够直接与OsDREB1B启动子区的 N-box(CACGC/AG)结合,激活OsDREB1B基因表达从而正调控水稻耐冷性[17]。
课题组前期研究发现一个水稻AP2/ERF转录因子OsERF096,其表达显著受冷胁迫诱导,并已证实其负调控水稻耐冷性[18]。为了探究冷胁迫诱导OsERF096表达的转录调控机制,本研究克隆了OsERF096启动子序列,根据顺式作用元件分布情况设计4个不同长度的启动子片段。通过对转基因拟南芥株系的GUS组织化学染色和qRT-PCR定量分析发现,冷胁迫处理前后GUS染色程度和基因转录水平没有显著差异。该结果为深入阐释OsERF096基因表达调控及功能研究提供了重要线索,为启动子功能对调控外源基因在转基因植物中的表达具有重要意义。
1 材料与方法
1.1 植物材料培养
本研究所用野生型拟南芥为哥伦比亚生态型(Col-0)。选取饱满的Col-0种子,用5%的NaClO溶液消毒5~8 min,灭菌ddH2O冲洗5~7次,4 ℃春化3 d,播种于1/2MS培养基,置于人工气候培养室 22 ℃-Light-14 h/22 ℃-Dark-10 h培养。
1.2 OsERF096基因启动子序列获得及克隆
通Phytozome网站(http://www.phytozome.net/)获取OsERF096基因转录起始点上游1 500 bp序列作为启动子序列。利用Primer 5.0软件选取合适位置设计PCR扩增引物POsERF096-1215-F/POsERF096-1215-R(表1)。

表1 本研究所用引物
采用Axy PrepTMGenomic DNA purification kit(Axygen)提取水稻幼苗叶片的基因组DNA,利用1%琼脂糖凝胶电泳检测DNA质量,NanoVue Plus测定DNA浓度。以提取的水稻叶片DNA为模板,采用KOD高保真聚合酶(TOYOBO)PCR扩增,克隆OsERF096启动子。PCR反应体系如下:2×KOD Mix 25 μL,上游和下游引物(10 μM)各1 μL,ddH2O 13 μL及gDNA 10 μL。PCR 反应条件如下:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火5 s,68 ℃延伸10 s,30 个循环。扩增产物与pEASY-Blunt Cloning Vector(TransGen Biotech)连接,转化DH5α,经菌落PCR鉴定后将阳性克隆送交公司测序。
1.3 OsERF096启动子顺式作用元件预测
对上述克隆获得的OsERF096启动子序列,利用New PLACE(https://www.dna.affrc.go.jp/PLACE/action=newplace)和Plant CARE(http://intra.psb.ugent.be:8080/PlantCARE/)工具进行顺式作用元件预测,筛选与冷胁迫及参与冷胁迫应答的激素相关的元件。
1.4 OsERF096启动子缺失片段克隆及表达载体构建
根据OsERF096启动子(POsERF096-1215)顺式作用元件预测结果,进行 5′端缺失片段设计,并设计3条上游序列(表1),扩增不同长度的OsERF096启动子片段。利用EcoRⅠ/NcoⅠ酶切和T4DNA连接酶连接,将获得的4条启动子序列分别替换pCAMBIA3301载体上的35S启动子,构建4个GUS基因表达载体POsERF096-1215-GUS、POsERF096-1102-GUS、POsERF096-827-GUS、POsERF096-501-GUS。
1.5 拟南芥侵染及鉴定
采用冻融法,将上述4个启动子载体分别转化农杆菌菌株LBA4404,并进行农杆菌菌落PCR鉴定,利用花序侵染法转化到Col-0中。将收获的T0代种子播种于含有15 mg·L-1草铵膦的1/2 MS培养基筛选抗性苗,采用启动子序列特异引物进行PCR鉴定。
1.6 GUS组织化学染色
将转基因拟南芥幼苗或组织完全浸没GUS染色液中,于37 ℃过夜孵育,移至75%乙醇中脱色后观察GUS染色情况,并拍照保存。试验选取3个T2转基因株系,每个株系取5株用于GUS染色。GUS染色液配方如下:200 mM NaH2PO4、200 mM Na2HPO4、100 mM Na2EDTA、5 mM K3[Fe(CN)6]、5 mM K4[Fe(CN)6]、X-Gluc、TritonX-100[19]。
1.7 qRT-PCR检测GUS基因表达
采用Trizol(Invitrogen)试剂法提取总RNA,经gDNA wiper(Vazyme)清除基因组DNA,利用HiScriptIIIRT Super Mix(Vazyme)反转录合成cDNA。以稀释5倍的cDNA为模板,以Actin2基因为内参进行qRT-PCR检测。qRT-PCR反应体系15 μL:2×Top qMix 7.5 μL、上游和下游引物(10 μM)各0.3 μL、ddH2O 4.9 μL、cDNA 2 μL。PCR反应条件:94 ℃预变性30 s;94 ℃变性4 s,60 ℃退火15 s,72 ℃延伸20 s,40个循环。采用 2-ΔΔCt方法计算基因相对表达量,Ct值取3次技术重复平均值,相对表达量取三次生物学重复平均值。使用Prism 8.0软件进行绘图,采用Duncan检验方法进行多重比较及差异显著性检验。
2 结果与分析
2.1 OsERF096启动子克隆与顺式作用元件分析
通过Phytozome网站获取OsERF096基因转录起始点上游1 500 bp作为启动子序列,选取合适位置设计特异性引物。以日本晴水稻基因组DNA为模板,采用高保真DNA聚合酶进行 PCR 扩增(图1),PCR产物连接T-vector后送交测序。测序结果显示成功克隆OsERF096启动子序列(1 215 bp),将其命名为POsERF096-1215。
注:M:DNA分子量标准DL8000; OsERF096-1215:OsERF096启动子扩增产物。
利用New PLACE和PlantCARE在线软件,对获得的OsERF096启动子序列进行顺式作用元件预测(图2),发现该序列中包含多个参与低温应答及逆境相关的激素信号应答的元件,如低温响应元件MYCCONSENSUSAT(CANNTG),脱落酸响应元件ABRERATCAL(MACGYGB)、RYREPEATBNNAPA(CATGCA)、PROXBBNNAPA(CAAACACC)、MYB1AT(TAACCA),水杨酸响应元件WBBBOXATNPR1(TTGAC),赤霉素响应元件HVAL21(TATCCAC)、MYBGAHV(TAACAAA)等(表2)。上述结果暗示OsERF096表达可能响应激素和低温胁迫。

注:图中箭头代表DNA正/反链的5′方向。

表2 OsERF096启动子序列顺式作用元件分析
2.2 OsERF096启动子片段缺失设计及GUS表达载体构建
为分析OsERF096启动子中响应冷胁迫的关键区域,根据顺式作用元件分布情况,设计了 4个不同长度的OsERF096启动子片段。如图3A所示,POsERF096-1215-GUS含有 7 个与逆境胁迫相关的顺式作用元件(MYCCONSENSUSAT、ABRERATCAL、PROXBBNNAPA、MYB1AT、WBBBOXATNPR1、HVAL21、MYBGAHV);POsERF096-1102-GUS缺失了2个5′端ABA和GA响应元件(ABRERATCAL和MYBGAHV);POsERF096-827-GUS进一步缺失了 SA 响应元件(WBBBOXATNPR1);POsERF096-501-GUS只包含3种低温和ABA响应元件(WBBBOXATNPR1、PROXBBNNAPA和MYB1AT)。分别扩增4个OsERF096启动子片段(图3B),利用EcoRⅠ和NcoⅠ限制性内切酶连接至pCAMBIA3301植物表达载体,替换载体上的35S启动子。测序结果显示成功构建4个OsERF096启动子功能分析载体,分别命名为POsERF096-1215-GUS、POsERF096-1102-GUS、POsERF096-827-GUS、POsERF096-501-GUS。
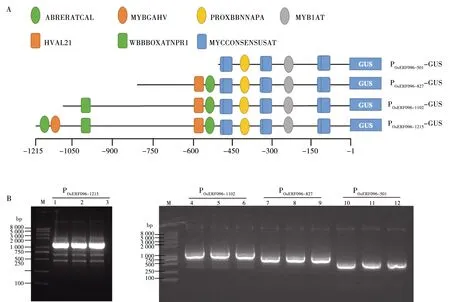
注:A:OsERF096启动子5′端缺失片段示意图。B:OsERF096启动子5′端缺失片段克隆电泳图。M:DNA分子量标准DL8000;1~3:POsERF096-1215克隆;4~6:POsERF096-1102克隆;7~9:POsERF096-827克隆;10~12:POsERF096-501克隆。
2.3 OsERF096启动子功能分析载体转化拟南芥
为了快速分析不同启动子片段对OsERF096基因表达的作用,本研究将上述构建的4个载体POsERF096-1215-GUS、POsERF096-1102-GUS、POsERF096-827-GUS、POsERF096-501-GUS分别转化Col-0。利用启动子特异性引物对T1抗性植株进行PCR检测(图4),以转化不同启动子片段的拟南芥植株DNA为模板,均扩增到与阳性对照目的带大小相一致的条带,说明OsERF096不同启动子片段均成功整合到Col-0基因组中。
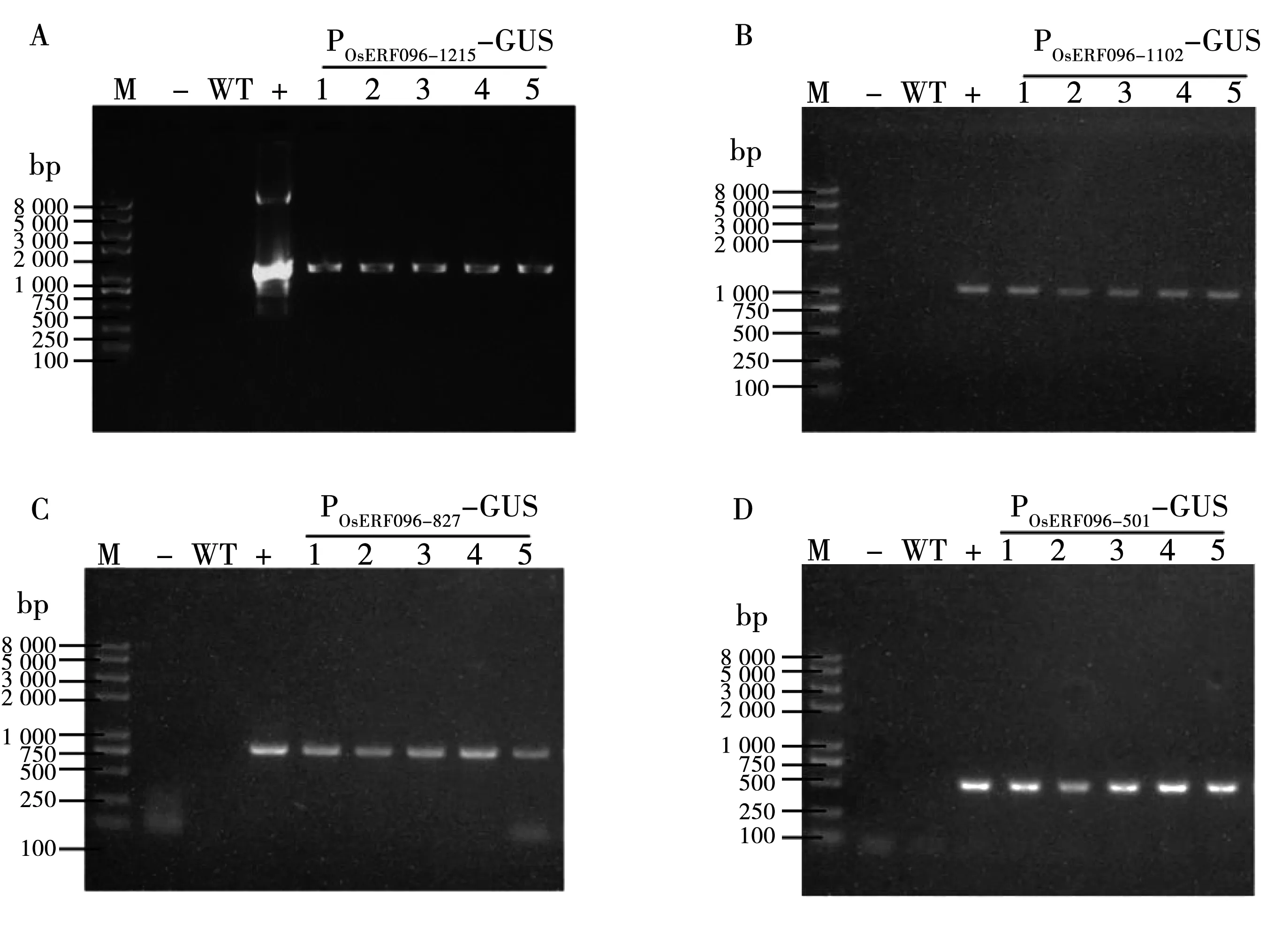
注:A:转POsERF096-1215-GUS拟南芥PCR鉴定;B:转 POsERF096-1102-GUS拟南芥PCR鉴定;C:转POsERF096-827-GUS拟南芥PCR鉴定;D:转POsERF096-501-GUS拟南芥PCR鉴定;M:DNA分子量标准DL8000;-:水对照;WT:野生型对照;+:质粒对照;1~5:T1代glufosinate抗性苗。
2.4 OsERF096启动子片段驱动GUS基因表达检测
为了快速鉴定OsERF096启动子片段是否成功驱动GUS基因表达,本研究首先对T1代转基因拟南芥植株的叶片进行 GUS染色(图5A)。每个片段均染色3个以上株系,得到相似结果。图5A所示为两个单株的染色情况。结果表明,POsERF096-1215-GUS株系叶片染色最深,颜色由深至浅依次是:POsERF096-1215-GUS> POsERF096-827-GUS> POsERF096-501-GUS>POsERF096-1102-GUS。两个染色较深的株系POsERF096-1215-GUS和POsERF096-827-GUS在叶脉和叶肉均有染色,POsERF096-501-GUS叶片染色呈现仅在叶脉,而POsERF096-1102-GUS仅以点状形式分布在5个叶齿。上述发现说明OsERF096基因在叶脉表达水平较高。
本研究进一步对处于2叶期和4叶期的T2代幼苗进行GUS染色分析(图5B/C)。结果显示POsERF096-1215-GUS和POsERF096-827-GUS株系幼苗的叶片和根系染色程度均较大,而POsERF096-1102-GUS和POsERF096-501-GUS株系中GUS染色则主要分布在子叶叶脉。以上结果说明相比POsERF096-1102和POsERF096-501,POsERF096-1215和POsERF096-827可以驱动GUS基因以较高水平表达。
为了验证GUS染色结果,本研究进一步采用灵敏度较高的qRT-PCR分析GUS基因转录水平,来验证不同片段长度的OsERF096启动子的活性(图5D)。POsERF096-1215-GUS、POsERF096-827-GUS、POsERF096-501-GUS、POsERF096-1102-GUS株系中GUS表达水平分别为0.98、0.32、0.24和0.06,POsERF096-827-GUS和POsERF096-501-GUS中GUS表达水平显著低于POsERF096-1215-GUS,POsERF096-1102-GUS极显著低于POsERF096-1102-GUS,与GUS染色结果一致。综上结果说明POsERF096-1215启动子活性相对较高,在-1 102 bp~-1 215 bp区间存在保证OsERF096基因以较高水平表达的DNA序列元件,而-827 bp~-1 102 bp区间内存在抑制其表达的序列。
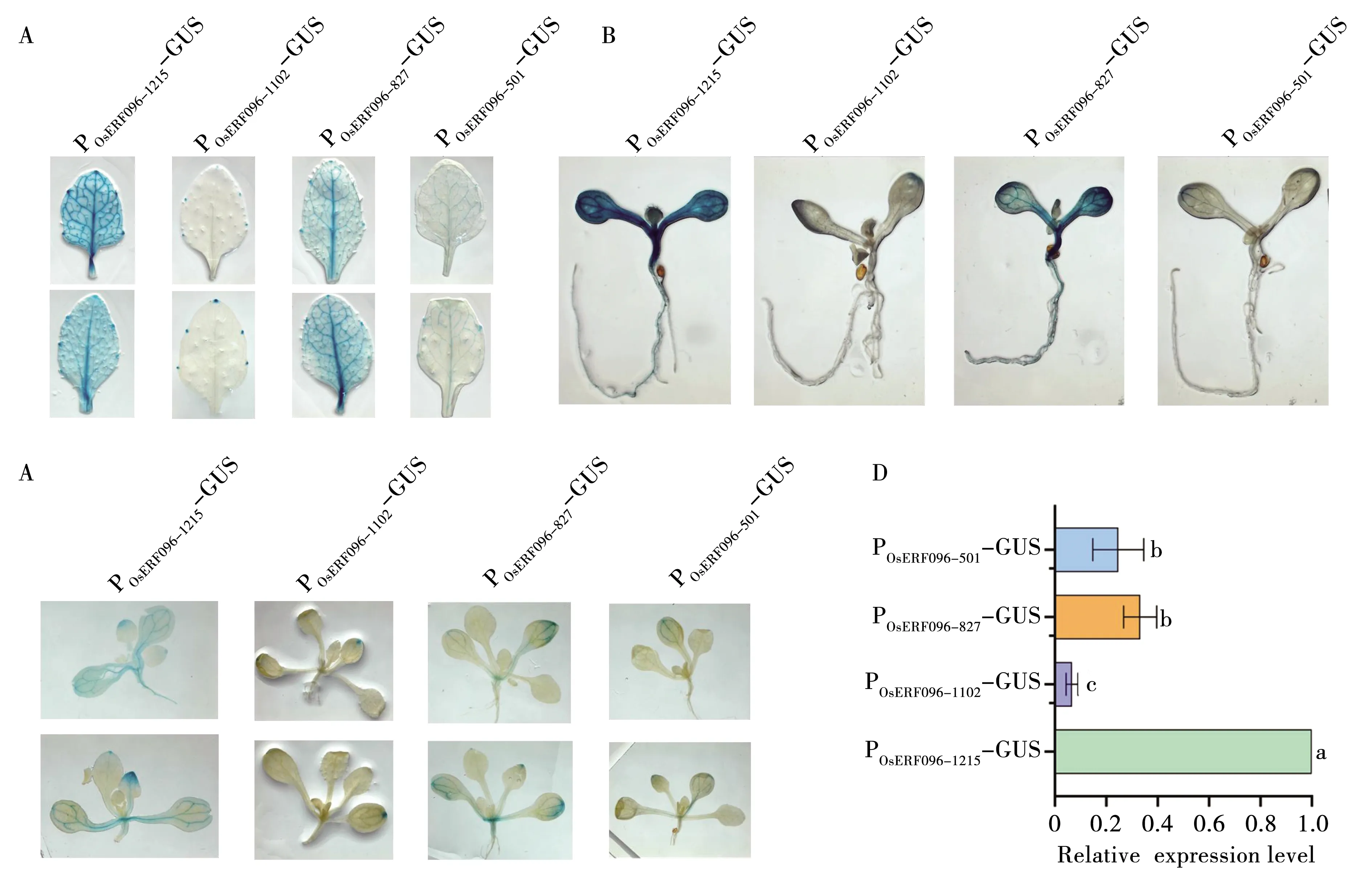
注:A:T1代转基因拟南芥叶片GUS染色分析;B:T2代转基因拟南芥2叶龄幼苗GUS染色分析;C:T2代转基因拟南芥4叶龄幼苗GUS染色分析;D:不同启动子片段转基因株系中GUS基因表达 qRT-PCR 分析。
2.5 冷胁迫对OsERF096启动子活性的影响
为了研究冷胁迫对OsERF096启动子活性的影响,对上述转基因拟南芥株系4叶龄幼苗进行4 ℃处理12 h,观察冷处理前后GUS染色强度(图6A)。正常生长条件下,不同启动子片段的转基因幼苗染色情况与上述结果一致。令人意外的是,对比不同片段长度的拟南芥幼苗冷处理前后的GUS染色情况发现,冷处理并未导致GUS染色程度明显加强。这与我们前期qRT-PCR发现冷胁迫下OsERF096基因表达显著上调相矛盾。
为证实GUS染色结果,本研究通过qRT-PCR分析了冷胁迫处理下GUS基因转录水平。结果显示,与未处理相比,冷处理后不同启动子片段的拟南芥株系中GUS基因表达均未发生显著变化(图6B)。综上结果证实,本研究所获得的不同OsERF096启动子片段驱动的GUS基因表达,在冷胁迫处理下均未发生显著差异。
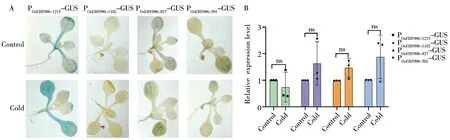
注:A:冷处理前后T2代转基因拟南芥4叶龄幼苗GUS染色分析;B:冷处理下不同启动子片段转基因株系中GUS基因表达qRT-PCR分析。
3 讨论
启动子是基因的一个重要组成部分,其中存在调控基因转录的DNA序列,即顺式作用元件,通过与反式作用因子(即转录因子)结合,调控基因转录水平的表达。因此,对启动子功能的研究是基因表达调控研究的重要内容。
诸多研究表明,AP2/ERF转录因子在水稻逆境应答中发挥重要作用[20]。正常条件下,AP2/ERF转录因子以较低水平表达,在干旱、高盐和低温等非生物胁迫下其表达大幅度增加[6]。如水稻冷胁迫应答通路下游的核心成员DREB/CBF转录因子(OsDREB1s)的表达,显著受冷胁迫诱导[21]。ICE1 可识别并与OsDREB1s启动子中E-box(MYCCONSENSUSAT)结合,激活OsDREB1s基因表达,进而提高对非生物胁迫的耐受性[22-23]。此外,研究人员发现,干旱胁迫促进OsERF109基因表达,OsERF109蛋白通过识别,并结合OsERF3启动子中的GCC-box或DRE元件激活其表达,最终负调控水稻耐旱性[24]。因此,鉴定基因启动子中逆境应答的关键区域或DNA元件,对揭示植物响应逆境的分子机制尤其重要。
课题组前期研究发现,冷胁迫处理下OsERF096基因表达显著提高。本研究克隆了OsERF096基因启动子,软件预测发现其中包含多个响应低温及激素信号转导相关元件[25-27]。然而,通过OsERF096启动子转基因拟南芥GUS染色和GUS基因qRT-PCR发现,在冷胁迫处理后,OsERF096启动子驱动的GUS基因未出现预期的显著上调。我们推测冷胁迫下OsERF096基因表达上调可能来源于转录后水平调控,如miRNA介导的mRNA降解。我们通过psRNATarget软件预测,发现6个靶向OsERF096基因Mrna序列的miRNA,包括OsmiR1320、OsmiR5809、OsmiR5541、OsmiR2927、OsmiR5075和OsmiR5526[28-32]。同时,异源表达也可能造成上述差异。本研究将OsERF096启动子在Col-0异源系统中表达,可能Col-0中缺乏相应的转录因子与OsERF096启动子结合,或异源系统中OsERF096启动子附近DNA甲基化或组蛋白修饰发生改变,导致表观遗传修饰发生改变。例如,苹果MYB10基因启动子区DNA甲基化可以调节MYB10基因表达[33]。我们已将OsERF096启动子分析载体转化水稻,后续将对转基因水稻中GUS基因表达情况进行检测。此外,本研究中OsERF096启动子克隆片段较短,缺失了重要冷应答元件,也是造成冷胁迫下OsERF096启动子活性与OsERF096基因qRT-PCR检测结果矛盾的原因之一。Duan等[34]发现高盐胁迫可诱导OsRAV2基因,而OsRAV2启动子区GT-1元件缺失则不会产生盐胁迫应激反应。后期研究中我们将进一步克隆更长片段的OsERF096启动子进行鉴定。
通过对比不同启动子片段驱动GUS基因表达情况发现,4个不同长度的启动子中,POsERF096-1215启动子活性最高,而POsERF096-1102最低。这一结果说明在-1 102 bp~-1 215 bp区间存在保证OsERF096基因以较高水平表达的DNA序列元件,而-827 bp~-1 102 bp区间内存在抑制其表达的序列。我们前期研究发现OsERF096负调控水稻耐冷性,后续研究中可通过操纵OsERF096启动子抑制其表达,从而调控水稻耐冷性。此外,OsERF096启动子中还存在多个与逆境应答相关的激素响应元件,暗示其可能参与激素信号转导。因此,后续研究有必要分析不同激素处理下OsERF096启动子活性是否发生变化。
4 结 论
本研究克隆了OsERF096基因启动子,其中包含多个冷胁迫及激素相关顺式作用元件。通过5′截断试验发现,在-1 102 bp~-1 215 bp区间存在保证OsERF096基因以较高水平表达的 DNA 序列元件,而-827 bp~-1 102 bp区间内存在抑制其表达的序列。冷处理下OsERF096启动子活性未发生显著变化。
