高密度脂蛋白3与维持性血液透析患者血管钙化关系的研究
2022-05-27李东昀
李东昀,孙 伟,温 玉,邹 杨,3
( 1.电子科技大学医学院,四川 成都 610072;2.四川省资阳市人民医院肾脏内科,四川 资阳 641301;3.四川省医学科学院·四川省人民医院肾脏内科,四川 成都 610072)
终末期肾脏病(end stage renal disease,ESRD)是全世界的公共卫生问题且形式严峻,达美国人口的0.2%,在中国则达到200万[1,2],其年死亡率约20%[3],接受维持性血液透析(maintenance hemodialysis,MHD)治疗的ESRD患者5年生存率仅49%[4]。心血管疾病(cardiovascular disease, CVD)是ESRD患者的首要死亡原因,23~50%[4,5]。血管钙化(vascular calcification,VC)与ESRD患者的CVD发生和全因死亡率密切相关[6,7]。健康人群中研究显示高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)与降低CVD相关,而在ESRD患者中的研究显示确并非如此,尚存在争议[8,9]。因此,本研究旨在分析HDL-C及其亚型(HDL2-C,HDL3-C)与MHD患者VC的关系。
1 资料与方法
1.1 一般资料2019年6月至2020年1月在四川省资阳市人民医院接受MHD治疗的患者90例,纳入标准:①ESRD患者,接受规律性MHD治疗至少≥90天;②同意参加本研究。排除标准:①18岁以下患者;②接受MHD治疗<90天者;③联合腹膜透析患者;④具有活动性肿瘤患者;⑤急性炎症患者;⑥合并严重肝脏相关疾病患者;⑦90天内有住院史者;⑧妊娠者;⑨无法配合腹部X射线片检查者。
1.2 方法
1.2.1一般资料收集 收集纳入的MHD患者一般人口学资料:性别、年龄、身高、体重指数(BMI)、透析龄、吸烟史、原发疾病、合并症、用药情况等。
1.2.2实验室检查 均为透析前空腹采血,在纳入患者行腹部侧位X射线片当天进行采血。由四川省资阳市人民医院检验科进行检测。包括血肌酐(Cr)、尿素氮(BUN)、尿酸(UA)、胆固醇(CHOL)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、糖(GLU)、钾(K)、钠(Na)、钙(Ca)、磷(P)、白蛋白(Alb)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)。高密度脂蛋白及其亚型的检测:采用微流控芯片电泳检测仪(MICEP-30, 广州国盛医学)进行HDL-C亚型的检测,计算机对微流控芯片检测仪所得数据自动处理分析得出HDL-C及亚型HDL2-C及HDL3-C结果。
1.3 评估标准腹主动脉钙化(AAC)可反映VC的情况。本研究选择腹部侧位X射线平片作为评估AAC检测手段。根据Kauppila评分标准计算AAC评分(AACS),以L1-L4所对应的AA管壁的钙化范围,得出相应评分[10]:无钙化为0分;钙化0~1/3为1分;钙化1/3~2/3为2分;钙化2/3~1为3分。各个节段得分相加可得到0~24分,经两位放射科医师评估,所取得的钙化评分取平均值。
1.4 统计学方法应用SPSS 22.0统计学软件进行数据分析。计量资料符合正态分布数据以均数±标准差表示,偏态分布数据以M(Q1,Q3)表示,组间比较采用t检验或秩和检验;计数资料以n(%)表示,组间比较采用卡方检验或Fisher精确概率法。采用Logistic多元回归分析AAC的影响因素;Spearman相关分析AAC与HDL-C3的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 无钙化组与钙化组临床特征比较根据MHD患者是否合并AAC分为钙化组与无钙化组。两组年龄、是否合并糖尿病、血HDL3-C、GLU、K、Na、P指标比较,差异有统计学意义(P<0.05)。见表1。
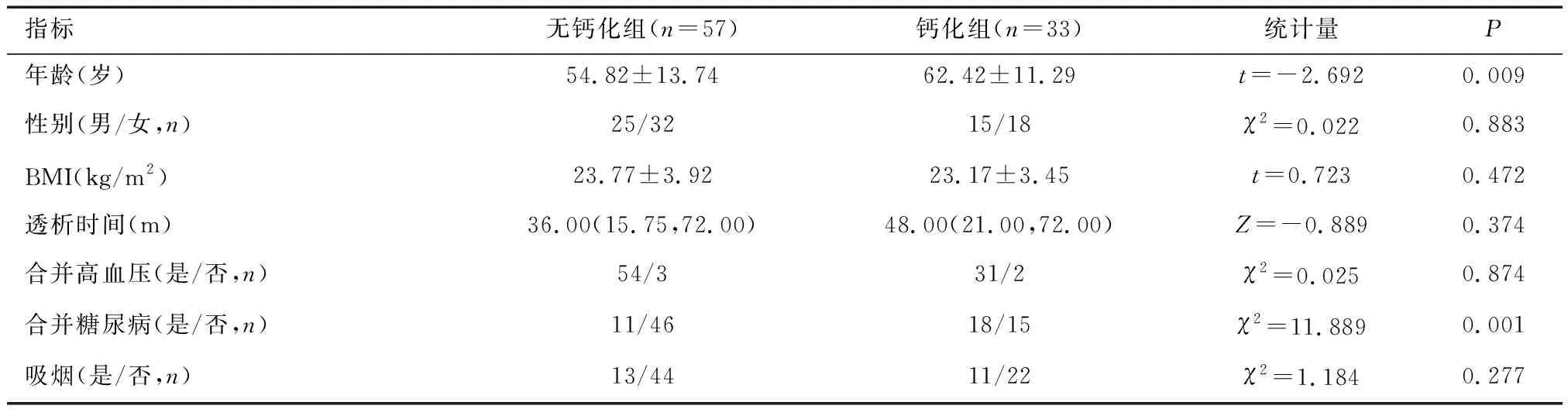
表1 无钙化组与钙化组临床特征比较

指标无钙化组(n=57)钙化组(n=33)统计量PHDL-C(mmol/L)0.96±0.271.09±0.37t=-1.9980.049HDL2-C(mmol/L)0.68±0.220.69±0.20t=-0.2230.824HDL3-C(mmol/L)0.26(0.24,0.32)0.31(0.24,0.52)Z=-2.2650.024HDL2-C/HDL3-C2.67±1.201.08±0.28t=1.4400.153Cr(μmol/L)910.49±279.68827.46±309.89t=1.2930.200BUN(mmol/L)20.68±6.5922.37±5.81t=-1.2090.230UA(mmol/L)429.13±109.34406.77±75.41t=1.0270.307CHOL(mmol/L)3.65±0.934.03±1.41t=-1.5580.123TG(mmol/L)1.56(1.13,2.16)1.28(0.81,3.14)Z=-0.7200.471LDL-C(mmol/L)1.73(1.42,2.48)2.00(1.68,2.31)Z=-1.1050.269GLU(mmol/L)6.85(5.50,8.44)9.77(7.30,12.82)Z=-3.2530.001K(mmol/L)4.44±0.754.97±1.06t=-2.7450.007Na(mmol/L)138.70±3.06136.73±4.03t=2.5860.011Ca(mmol/L)2.22±0.222.20±0.23t=0.3250.746P(mmol/L)1.77±0.642.10±0.72t=-2.1980.031ALb(g/L)39.85±3.2938.76±3.32t=1.5000.137ALT(U/L)10.60(6.88,19.28)8.95(5.85,13.60)Z=-1.8460.065AST(U/L)19.70(14.65,25.15)19.00(15.90,20.58)Z=-1.2390.215ALP(U/L)105.08±56.3891.79±32.98t=1.2330.221iPTH(pg/ml)335.85(120.13,631.75)305.65(143.20,576.10)Z=-0.800.937使用钙剂或活性维生素D(是/否,n)38/2123/10χ2=0.2650.607
2.2 MHD患者发生AAC的影响因素分析HDL3-C、P是MHD患者发生AAC的独立危险因素(P<0.05),见表2。
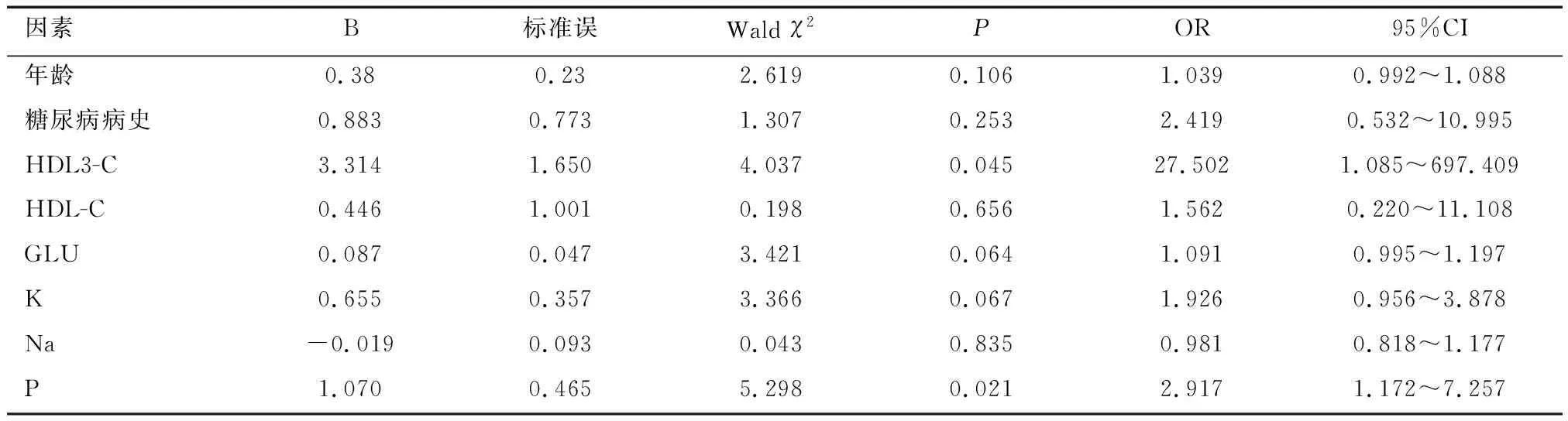
表2 MHD患者发生AAC的影响因素分析
2.3 AAC与HDL-C3的相关性分析AAC与HDL3-C呈正相关(r=0.209,P<0.05)。
3 讨论
VC是指发生在心血管系统的异常矿化,可发生在血管的内膜、中膜和/或心脏瓣膜,ESRD患者的VC常常发生在中膜(平滑肌层),是ESRD患者的常见并发症[6]。一项荟萃分析显示透析患者VC率非常高,达51%~93%[11],而HD患者的VC则更为突出[12]。作为VC传统危险因素之一的血脂紊乱却在ESRD患者中扮演与健康人群中不一样的角色。在健康人群中,大量的流行病学、临床研究均显示HDL-C升高与降低心血管事件密切相关[13],而在ESRD人群中的相关报道却并非如此。一项纳入15859例HD患者的研究中显示升高的HDL-C与改善CVD及降低全因死亡率没有相关性[8];在另一个纳入412例HD患者的队列研究中发现高HDL-C反而与增加CVD相关[9]。有研究指出在ESRD环境中,可能由于肾功能减退,尿毒症毒素及炎症状态的存在等因素导致HDL-C的促胆固醇外流、抗氧化应激和抗炎症等功能减退,甚至可能反而转变为具有促CVD的作用[3]。
HDL-C本身是一种复杂颗粒,具有比如众所周知的胆固醇逆转运,促胆固醇外流,以及阻止血管壁氧化损伤,抑制低LDL-C氧化及巨噬细胞分泌细胞因子,刺激内皮细胞一氧化氮的合成以促进血管舒张等抗动脉粥样硬化的能力[12]。大体来说,HDL-C包括2种亚型:脂蛋白含量较低、胆固醇含量高、密度较低、直径较大的HDL2-C(成熟颗粒),而HDL3-C则脂蛋白含量较高、胆固醇含量较低、密度较高、直径较小(颗粒小而密的不成熟颗粒)[14]。HDL2-C和HDL3-C不仅直径不同,还具有不同的生化、生理和代谢功能,但亚型之间是可以相互转换的。HDL3-C向成熟的HDL2-C转换过程中涉及一关键酶:磷脂-胆固醇酰基转移酶(Lecithin cholesterol acyl transferase, LCAT)[13]。
Calabresi等研究显示HD患者的LCAT活性明显降低[15],推测此导致HD患者中HDL-C成熟延迟,因此HD患者中HDL2-C降低,HDL3-C水平升高[16]。而Lee等则报道HDL3-C亚型比例与增加MHD患者的冠心病及脑中风等大血管事件风险相关[17]。本研究显示MHD患者合并AAC组的HDL2-C/HDL3-C低于非钙化组,由于Michael等研究显示HDL2-C/HDL3-C与胆固醇外流能力呈正相关,因此可以解释HD合并VVC组患者的胆固醇外流能力降低,增加VC风险[13]。
目前越来越多证据显示CKD患者的HDL-C的功能,比如抗炎症,抗氧化和内皮保护等均减弱[17]。结合HD患者中HDL-C成分以HDL3-C为主,推测与HDL3-C相关[15],本研究发现MHD合并AAC患者的HDL3-C浓度显著高于未合并患者,与既往研究一致[16]。Logistic回归分析发现HDL3-C是VC的独立危险因素,且呈正相关。据报道在健康人群中的研究显示HDL3-C其实具有更强的抗氧化能力,但在ESRD环境下,可能会导致这些颗粒反而变为促动脉粥样硬化的颗粒[18]。推测与ESRD中对氧磷酶1(PON1)活性降低有关。PON1是脂质依赖酶,依赖apoA-Ⅰ发挥抗氧化作用。在ESRD的尿毒症毒素、炎症和氧化应激等环境下,HDL3-C具有潜在修饰apoA-Ⅰ甲基化的能力,因此PON1与apoA-Ⅰ连接减弱,最终将导致PON1活性降低,抗氧化能力降低,从而增加VC风险[18]。
本研究亦存在一定的局限性,电子束CT(EBCT)及多层螺旋CT(MSCT)敏感性和特异性高,是心血管钙化诊断的金标准。我国一项前瞻性队列研究显示20%的患者存在冠状动脉钙化,但无心脏瓣膜及腹主动脉钙化[19]。因此,本研究采用的腹部侧位X射线片检测会低估MHD患者的VC发生率。综上,MHD患者增高的血清HDL3-C与腹主动脉钙化相关,此为临床VC的防治提供理论依据。
