凤丹白牡丹EIN3/EIL 家族基因的克隆与表达分析
2022-05-27徐玲霞曹小迎张光琴
韩 波,徐玲霞,曹小迎,张光琴
(1. 徐州生物工程职业技术学院,江苏 徐州 221006;2. 江苏师范大学 生命科学学院,江苏 徐州 221116)
牡丹(Paeonia suffruticosa)是集观赏、药用和油用为一身的重要经济植物[1]。凤丹白(Paeonia ostticv.‘Phoenix White’)为牡丹野生种杨山牡丹(P.ostii)的栽培品种,是目前油用牡丹最主要的品种[2],具有结籽量大、出油率高、生长势强等特点,并且耐干旱、耐瘠薄、耐高寒,具有很强的适应性[3]。凤丹白籽油中含有丰富的不饱和脂肪酸,如亚麻酸、亚油酸和油酸,具有抗肿瘤、抗炎、改善心血管和调节免疫等医疗保健功能,具有极高的研究价值[4]。凤丹白根皮有镇痛、解热、抗过敏、消炎、免疫等作用,与白芍、菊花、茯苓并称为安徽四大名药[5]。凤丹所含的化学成分有芍药苷、丹皮酚、丹皮苷、丹皮多糖、苯甲酸、甾醇、挥发油等多种物质,其中丹皮酚含量是检验丹皮品质优劣的主要指标[6]。
目前在所有的植物激素中,乙烯的信号转导通路是研究较为清楚的通路之一。EIN3/EIL 家族基因是乙烯信号转导途径中一类重要的核转录因子,定位于细胞核内,在乙烯信号途径中与下游基因启动子结合启动基因的表达[7]。目前已经从多种高等植物中分离得到EIN3/EIL 家族基因,包括水稻[8]、拟南芥[9]、棉花[10]和丹参[11]等。基因功能研究表明,EIN3/EIL 参与乙烯信号的转导[12-13],参与花的开放、衰老和凋谢过程[14-15],参与果实成熟软化调控[16-18],参与抗逆境胁迫调控[19-21],与MYC2 交叉互作[22],同时还转录激活次生代谢物生物合成途径中关键酶基因的表达。如丹参毛状根中的EIN3 基因的过表达可促进丹参酮和丹酚酸合成途径中部分关键酶基因的上调表达[17]。猕猴桃果实中的EIN3/EIL 转录因子可以转录激活萜类合成酶基因AaTPS1的表达[23]。目前,洛阳红牡丹(Paeonia suffruticosa)乙烯信号转导基因EIN3/EIL 有克隆和表达分析的报道[24-25],而凤丹白作为牡丹中开花较早的一个品种,EIN3/EIL 家族基因序列的相似度及表达情况还不是很清楚。
鉴于此,从NCBI 数据库中搜索得到洛阳红的3个EIN3/EIL 基因,通过同源克隆,从凤丹白中克隆到3 个EIN3/EIL 基因(PoEILs)全长cDNA 序列,并对其进行信息学分析,研究其在不同组织及不同花期的表达水平和表达模式,为研究凤丹白抗逆性、提高丹皮中活性成分及调控花期提供候选基因。
1 材料和方法
1.1 试验材料
供试材料是凤丹白,生长于徐州生物工程职业技术学院牡丹种植园。开花期取凤丹白的根、茎、叶,以及不同开花时期(S1—S5期)的花瓣,包括破绽期(S1)、初开期(S2)、盛开期(S3)、盛开末期(S4)、谢花期(S5),取S3 的花瓣、雄蕊、子房、花柱、花托、萼片。液氮速冻后保存于-80 ℃冰箱用于提取RNA。
1.2 试验方法
1.2.1 凤丹白EIN3/EIL 基因的克隆 采用艾德莱生物公司的EASYspin 通用植物RNA 快速提取试剂盒提取各组织、各花期样品的总RNA。用诺唯赞生物科技有限公司的HiScript Ⅱ1st Strand cDNA Synthesis Kit(+gDNA wiper)按照最终反转录量为1µg,对各样品的RNA 进行cDNA 合成,反应体系20µL。反转录产物保存于-20 ℃备用。根据NCBI数据库中洛阳红的EIL1—EIL3 序列设计引物进行PCR,扩增凤丹白茎的EIL1—EIL3 的编码区序列(CDS)。3 对 引 物 序 列 见 表1。PCR 反 应 体 系(25µL):10 µmol/L 上、下 游 引 物 各0.5 µL,2×Phanta Max Master Mix(诺唯赞)12.5µL,茎的cDNA 1 µL,其余用ddH2O 补足。PCR 扩增程序:95 ℃预变性1 min;95 ℃变性10 s,58 ℃退火15 s,72 ℃延伸2 min,30 个循环;最后再72 ℃延伸5 min。PCR 产物用1%的琼脂糖凝胶电泳,利用DNA 凝胶回收试剂盒(诺唯赞)回收目的DNA,并连接至平末端克隆载体,转化大肠杆菌DH5α感受态细胞,经菌液PCR鉴定后送生工生物工程有限公司测序。

表1 凤丹白EIL基因克隆及表达分析所用引物Tab.1 Primers for PoEILs cloning and expression analysis
1.2.2 凤丹白EIL基因家族的生物信息学分析 利用NCBI 中的BLAST 进行序列相似度分析,ORF 进行开放阅读框预测;利用在线分析软件Protparam 进行理化性质分析;使用MEGA 7 以及Clustal X 软件进行系统进化树分析;EIN3/EIL 家族蛋白质保守基序分布使用在线软件MEME(https://meme-suite.org/meme/tools/meme)进行分析。
1.2.3 凤丹白EIL 基因定量表达分析 以Tubulin基因作为标准化内参基因。引物信息如表1 所示。采用ChamQ SYBR qPCR Master Mix(诺唯赞)进行qPCR,反应在StepOnePlus qPCR(ABI,USA)荧光定量PCR仪上进行。共进行3组生物学重复,每组5次技术重复。使用2-ΔΔCT方法计算基因表达水平的相对变化。反应体系和反应程序参照试剂盒说明书。
2 结果与分析
2.1 凤丹白EIL基因克隆
以牡丹拉丁名Paeonia suffruticosa搜索NCBI 上nucleotide 数据库,获得3 条EIL 基因序列(GenBank登录号为JQ771469.1、JQ771470.1、JQ771471.1),以拟南芥的EIN3/EIL 家族基因序列在NCBI网站上分别比对牡丹和凤丹白转录组数据库,结果未搜索到其他的EIN3/EIL 基因片段。推测牡丹中EIN3/EIL基因家族只有这3 个基因。以牡丹的这3 个EIL 基因序列设计引物扩增凤丹白EIL 基因的CDS,得到了预期大小的电泳条带(图1)。经克隆测序得到3条片段CDS 长度,PoEIL1为1 833 bp,PoEIL2为1 824 bp,PoEIL3为1 959 bp。序列已提交NCBI 数据库,GenBank 登陆号为MZ648327—MZ648329。这3 条CDS 序列与数据库中的牡丹EIL 相似度为99%以上,仅有5~10 个碱基的差异,推断分别编码610、607、652个氨基酸。
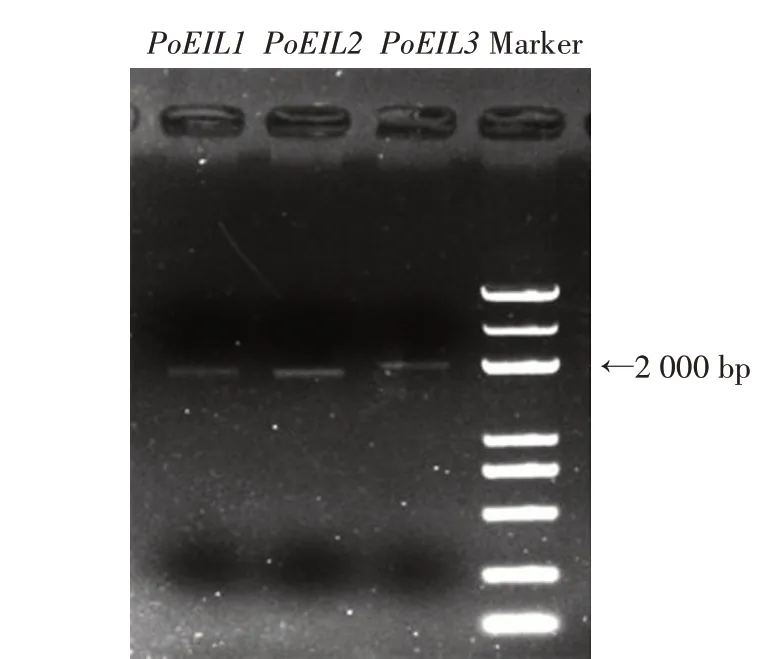
图1 凤丹白3个EIL基因CDS扩增产物Fig.1 CDS amplification products of three PoEILs
2.2 3个基因氨基酸序列的生物信息学分析
利用在线分析软件Protparam 对PoEIL1—PoEIL3基因编码蛋白质的理化性质进行分析,结果表明,PoEIL1基因编码蛋白质分子式为C2955H4669N847O942S24,原子总数为9 437 个,分子质量67.90 ku,理论等电点为5.57,亲水性平均值为-0.722,不稳定指数为54.30,预测为不稳定亲水蛋白;PoEIL2基因编码蛋白分子式为C3003H4650N844O933S39,原子总数为9 469 个,分子质量68.76 ku,理论等电点为5.69,亲水性平均值为-0.757,不稳定指数为47.37,预测为不稳定亲水蛋白;PoEIL3基因编码蛋白质分子式为C3241H5017N879O1006S34,原子总数为10 177 个,分子质量73.48 ku,理论等电点为5.31,亲水性平均值为-0.673,不稳定指数为56.80,预测为不稳定亲水蛋白。
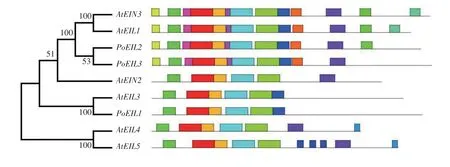
用MEGA 7 软件构建3 个凤丹白EIL 和拟南芥EIL 家族系统发生树。用最大似然法(Maximum likelihood)选择自举检验(Bootstrap test)并设定重复次数为1 000 次,获得的系统发生树(图2)中各EIN3/EIL 蛋白序列在大多数节点的可信度都较高,表明该家族基因在进化中高度保守。凤丹白的PoEIL1与拟南芥的AtEIL3聚为一支,推断PoEIL1的功能可能与AtEIL3类似。PoEIL2和PoEIL3与拟南芥的AtEIN3和AtEIL1聚在一起,AtEIN3和AtEIL1基因同源性最高,且存在功能冗余,推测PoEIL2和PoEIL3功能类似于拟南芥的AtEIN3和AtEIL1。凤丹白中没有基因与AtEIL2、AtEIL4和AtEIL5聚在一起。
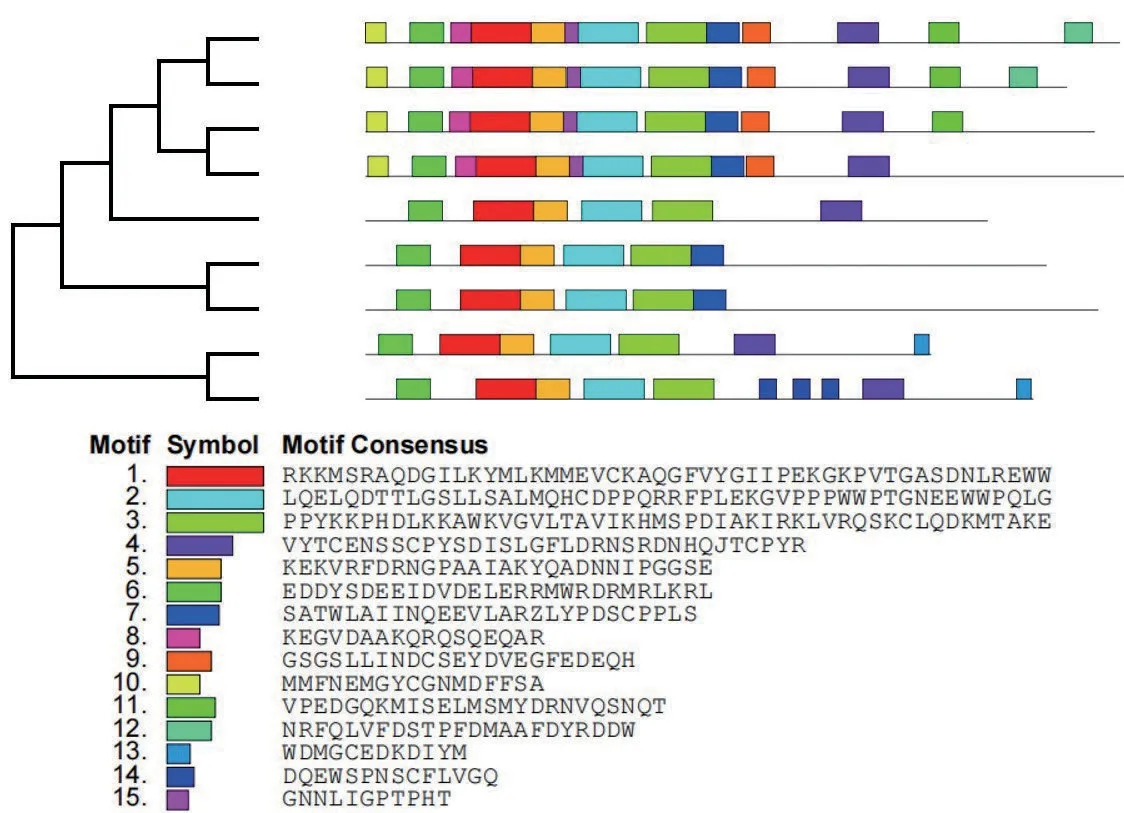
图2 凤丹白和拟南芥EIN3/EIL基因家族系统发生及蛋白质保守基序分析Fig.2 Phylogeny and conserved motifs analysis of EIN3/EIL family genes in Paeonia ostti cv.‘Phoenix White’and Arabidopsis
利用MEME 在线分析软件对以上构建系统发育树的几个基因保守基序(Motif)进行分析,结果(图2)显示,每条序列至少存在5个相同位置的保守基序,并且分布顺序完全一致,说明该基因家族具有高度保守的结构域,这与前人研究结果相符[26]。PoEIL1与AtEIL3基序的数量和位置一致,预测PoEIL1的功能可能与AtEIL3类似。
2.3 凤丹白EIL基因在不同器官及花发育过程的表达分析
为了明确凤丹白各EIL 基因的组织表达情况,利用qRT-PCR 技术对EIL 在凤丹白根、茎、叶、花托、子房、花柱、萼片、花瓣和雄蕊中的表达进行分析(图3)。结果表明,PoEIL1在叶中表达量非常低,几乎没有表达,其他2 个EIL 在各个部位均有表达。PoEIL1在茎、花柱和子房中的相对表达量较其他2个EIL 高,PoEIL2在根中的表达量较其他2 个EIL高,PoEIL3在叶和盛开期萼片、花托、花瓣、雄蕊中的表达量相对较高。这些结果表明,PoEIL1可能参与凤丹白花的器官形态建成,而PoEIL3可能同时参与花和叶片的器官形态建成。
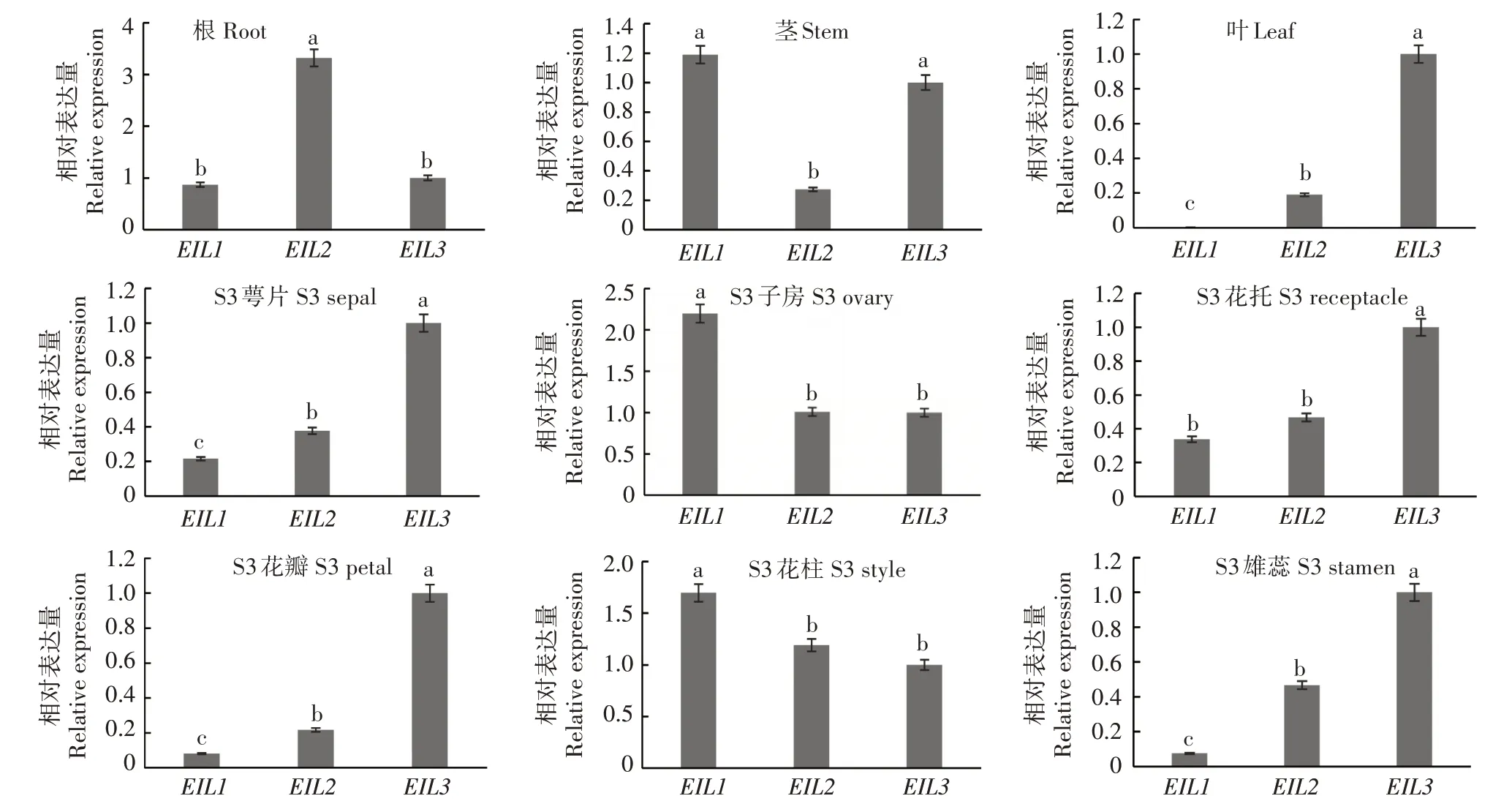
图3 凤丹白3个EIL基因在不同器官中的表达情况Fig.3 Relative transcript levels of three PoEILs in different tissues
对凤丹白不同开花时期EIL基因的相对表达量进行检测分析,结果表明,凤丹白各EIL基因在不同开花时期的表达丰度差异很大(图4)。3 个基因都在破绽期(S1)相对表达量最低。PoEIL1基因在花开放过程中相对表达量逐渐增高,在盛开末期(S4)相对表达量达到最大,随后相对表达量又迅速降低。PoEIL2基因在初开期相对表达量达到最大,随后下降,在盛开末期(S4)有点回升,随后又下降。PoEIL3基因在初开期相对表达量达到最大,随后相对表达量一直在这个水平波动。

图4 凤丹白3个EIL基因在5个开花时期的表达情况Fig.4 Relative transcript levels of three PoEILs in 5 flower opening stages
3 结论与讨论
EIN3/EIL 家族基因作为乙烯信号转导途径中比较重要的核转录因子,越来越受到研究者的重视。本研究以NCBI 数据库中牡丹的3 个EIN3/EIL基因为参照设计引物,获得凤丹白的3 个基因的开放阅读框序列。这3 个基因序列与牡丹的3 个EIL基因序列分别有5~10个碱基的差异,推测EIN3/EIL基因在牡丹的不同种的变异不大。以拟南芥AtEIN3基因为探针,从NCBI 转录组数据库凤丹白转录组测序数据中筛选具有EIN3 结构域的基因序列。结果表明,除了已经扩增的3 个EIL 基因序列,未发现凤丹白中有其他的EIN3/EIL基因。
将凤丹白和拟南芥的EIN3/EIL 家族基因一起构建进化树,结果显示,凤丹白的PoEIL1与拟南芥的AtEIL3聚为一支,PoEIL2和PoEIL3与拟南芥的AtEIN3和AtEIL1聚在一起,但凤丹白中没有基因与AtEIL2、AtEIL4和AtEIL5聚在一起。有研究表明,拟南芥中EIN3和EIL1的功能重叠,同时EIN3和EIL1是乙烯信号传导的主要成员[27],本研究中PoEIL2和PoEIL3基因与拟南芥的AtEIN3和AtEIL1基因保守基序的数量和顺序基本一致,预测其功能也类似于拟南芥的AtEIN3和AtEIL1基因。EIL3 是乙烯调控基因表达的关键转录因子,还是参与植物对生物和非生物应激反应的信号网络的一部分[28]。凤丹白EIL1与AtEIL3基因的保守基序的数量与顺序完全一致,预测PoEIL1也参与了凤丹白的应激反应。
不同器官中各基因的表达分析结果显示,凤丹白EIL 基因在不同的器官中表达情况不一致,这与高等植物EIN3/EIL 转录因子家族成员间显示不同的表达特性及调控模式结论一致[29]。PoEIL1在叶、花瓣(S3)和雄蕊(S3)中的相对表达量较低,而在茎、子房(S3)和花柱(S3)中的相对表达量较高。PoEIL2在根中的相对表达量最高,而PoEIL3在各组织中的相对表达量都不低。凤丹白不同开花时期EIL 基因的相对表达量分析结果显示,PoEIL1随着花的盛开相对表达量增加,至盛开末期相对表达量达到最大,在谢花期相对表达量下降,推测PoEIL1与花的发育有关,可以通过调控PoEIL1的表达来调控花期。
本研究克隆了凤丹白中3 个EIN3/EIL 基因,初步明确了3 个基因在各组织及不同花期的表达模式,为今后进一步揭示凤丹白中这3 个基因各自的功能及分子机制奠定了基础。
