冬季两种舍饲模式对羔羊生长性能、免疫和抗氧化功能的影响
2022-05-26郭文亮郭燕菲吴玮琪郭世伟石璐璐史彬林
郭文亮 郭燕菲 吴玮琪 郭世伟 石璐璐 金 晓 史彬林
(内蒙古农业大学 动物科学学院,呼和浩特 010018)
温度是影响动物健康和生存的重要环境因素。冬季冷暴露是北方畜牧养殖中非常普遍的问题。冷暴露会降低动物的生长性能和饲料转化效率,并增加维持的能量消耗[1-2]。急性冷暴露可提高机体适应能力,但长期慢性冷暴露会使机体处于冷应激状态,干扰代谢和生理平衡,增加机体活性氧(ROS)的产生,引起氧化失衡[3-6],并降低免疫细胞因子水平和免疫球蛋白分泌,造成动物的免疫功能下降[7-9]。长期冷暴露还会引起热休克蛋白(HSP)水平提高,HSP是体内重要的分子伴侣蛋白,可通过维持细胞结构和信号转导保护机体,缓解炎症反应和氧化失衡状态,其水平的高低通常是衡量应激大小的重要指标[10-12]。
内蒙古地区冬季严寒,平均夜间温度约为-28 ℃。在冬季为绵羊提供羊舍抵御降雪和冷风等恶劣环境条件,可以缓解低温应激,提高动物福利[13]。Scholtz等[14]研究发现,在冬季和春季将母羊放在温暖的棚舍里可以提高羔羊的出生率、初生重和成活率[14]。也有研究者指出,绵羊适应性较强,在冬季饲养时需提供运动场保证绵羊充足的户外活动时间和运动量来满足生长发育需求[15],北方的集约化牧场在冬季大多使用半开放式畜舍来保证舍内通风与温度[16],在高寒地区的冬季,多数牧民只使用舍外放牧即可满足绵羊生长需求[17]。且有研究发现,适宜的冷刺激不仅不会降低生产性能,还会提高机体免疫球蛋白的水平和抗急性冷应激的能力[18]。因此,北方牧民和养殖场主要采用两种羔羊舍饲方式:一种是将羔羊饲养在封闭式羊舍内,不设运动场(封闭式舍饲方式),可保持舍内温度;另一种是将羔羊饲养在设有舍外运动场的封闭式羊舍内,舍门敞开供羔羊自由出入(开放式舍饲方式),可保证其运动量与舍内通风量。这两种饲养方式均为羔羊提供了抵御恶劣环境条件的羊舍,但哪一种饲养方式更有利于羔羊的健康与生长,目前尚未见系统的研究报道。
本研究即以杜蒙杂交母羔羊为试验动物,分析比较上述两种舍饲方式对羔羊生长性能、血液热休克蛋白、免疫和抗氧化功能的影响,为北方地区寒冷天气条件下绵羊羔羊的科学舍饲管理提供理论依据。
1 材料与方法
1.1 试验设计
本研究于2019年12月20日—2020年1月17日期间在内蒙古呼和浩特市土默特左旗境内内蒙古农业大学实验农场进行。选取30只健康的2月龄、体重相近((16.42±2.52) kg)的杜泊×蒙古羊杂交母羔羊,随机分为2个处理组,每组5个重复,每个重复3只羊,2个处理组如下:(1)封闭式舍饲组(Closed house feeding group, CHG),羔羊圈养在有窗羊舍内(羊舍面积4 m×5 m),不设舍外运动场;(2)开放式舍饲组(Opened house feeding group, OHG),羔羊饲养在设有舍外运动场的有窗封闭式羊舍内(羊舍面积4 m×5 m,运动场面积4 m×5 m),舍门全天敞开供羔羊自由出入。试验期28 d,每天分两次(在08:00和16:00)给试验羔羊定量上料,每日早晨称取剩料重,并记录剩料量,全期自由饮水。于试验第1天(IWB)和第28天(FWB)给试验羊称重,计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F∶G)。试验羊饲料配方根据(NRC2007)制定,如表1所示。

表1 试验羔羊的饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental lambs (Air-dried basis)
1.2 环境指标的测定
每天在08:00、14:00和20:00分别使用小叶片风速仪(testo 416小叶轮风速计,Testo SE&Co. KGaA,美国西切斯特)记录3次两组舍内和舍外的风速。于羊舍中部和羊舍外距地面1 m高处(畜体高度)悬挂日记型自记式温湿度记录仪(ZJI-2A型,上海隆拓仪器设备有限公司),分别监测并计算试验期内两组舍内及舍外平均空气温度和相对湿度。每周分别在08:00、14:00和20:00时间点采集3次两组舍内及舍外气体,使用100 mL注射器采用五点法于舍内畜体高度吸取100 mL气体匀速通过氨气和二氧化碳气体检测管(气体检测管,北京北科绿洲安全环境科技有限公司),静置1 min后准确读数并记录两组舍内和舍外的氨气与二氧化碳含量,具体操作参照牛壮等[19]方法。
1.3 样品采集
在试验期第7、14、21和28天的06:00使用非抗凝真空采血管和含乙二胺四乙酸(EDTA)的抗凝采血管在空腹状态下对试验羊随机选取10只进行颈静脉采血。静置约30 min后将血样以3 000 g离心20 min后分别收集血清和白细胞[7],血清-20 ℃ 保存,待血清免疫抗氧化指标测定。白细胞中加入1 mL Trizol,混匀后静置3~5 min,随后转入-80 ℃保存,进行后续提取RNA,待免疫抗氧化相关基因表达分析。
1.4 血清热休克蛋白、免疫及抗氧化指标的测定
血清胰岛素(INS)、热休克蛋白70(HSP70)、热休克蛋白90(HSP90)、白细胞介素1(IL-1)、白细胞介素4(IL-4)、肿瘤坏死因子-α(TNF-α)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)使用绵羊特异性ELISA试剂盒(中国泉州瑞星生物科技有限公司),根据制造商的说明书进行测定。血清中总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(T-SOD)酶活性和脂质过氧化产物丙二醛(MDA)含量采用试剂盒比色法测定(南京建成生物工程研究所)。
1.5 总RNA提取和定量RT-PCR分析
使用Trizol试剂(Invitrogen,Carlsbad,CA,美国)提取血液中白细胞中的总RNA,根据石璐璐[7]方法定量分离出总RNA。根据说明书使用PrimeScript RT试剂盒将RNA去除后,再用基因组DNA逆转录成cDNA(Takara Bio Inc.,Otsu,Japan)。使用qPCR TB Green Kit和Light Cycler 96进行实时荧光定量PCR反应。qRT-PCR使用10 μL反应体系进行,程序如下:95 ℃预变性30 s;95 ℃变性5 s,退火30 s,40个循环。表2列出了不同基因的最佳退火温度,引物由北京六合华大基因科技有限公司合成。将β-肌动蛋白作内参基因,使用2-ΔΔCt方法计算各基因mRNA相对表达量。

表2 本研究的引物序列信息Table 2 Primer Sequences information in this study
1.6 数据分析
数据使用Excel 2016 整理后,通过SAS 9.2软件进行t检验分析,结果表示为平均值±标准差。P<0.01时表示差异极显著,P<0.05时表示差异显著,P>0.05时差异不显著。
2 结果与分析
2.1 两组舍内及舍外空气环境参数测定
试验期两组舍内及舍外的温度、相对湿度、风速和氨气与二氧化碳含量如表3所示。CHG舍内温度、相对湿度、氨气和二氧化碳分别较舍外高9.5 ℃、13.92%、2.36 mg/m3和98.39 mg/m3。OHG舍内温度、相对湿度、氨气和二氧化碳分别较舍外高4.05 ℃、3.84%、0.70 mg/m3和38.62 mg/m3。CHG和OHG舍内均处于无风状态,风速分别为0.06 m/s 和0.07 m/s。

表3 两组舍饲方式舍内外全天平均温度、相对湿度、风速和氨气与二氧化碳含量Table 3 All-day mean values of two group indoor and outdoor temperature,relative humidity, wind speed, NH3 and CO2 content
2.2 舍饲方式对羔羊生长性能的影响
如表4所示,CHG羔羊的末体重高于OHG,但差异不显著(P>0.05),OHG羔羊的平均日增重显著低于CHG(P<0.05),料重比显著高于CHG(P<0.05),平均日采食量差异不显著(P>0.05)。此结果表明,开放式舍饲组的羔羊日增重显著降低,料重比增加。
2.3 舍饲方式对羔羊血清胰岛素及热休克蛋白的影响
如表5所示,在试验第28 天,OHG羔羊的血清胰岛素含量显著低于CHG(P<0.05),血清HSP90含量显著高于CHG(P<0.05),HSP70含量在两组间差异不显著(P>0.05)。此结果表明开放式舍饲组的羔羊受温度的影响更大,机体的应激水平较高。

表5 不同舍饲方式对羔羊血清胰岛素和热休克蛋白含量的影响Table 5 Effects of different housing models on serum contents of INS and HSP in lambs
2.4 舍饲方式对羔羊血清抗氧化指标的影响
如表6所示,在试验第14 天,OHG羔羊的血清MDA含量显著高于CHG(P<0.01)。在试验第21天,OHG羔羊的血清MDA含量极显著高于CHG(P<0.05),血清GSH-Px和T-SOD活性显著低于CHG(P<0.05)。在试验第28 天,OHG羔羊的血清 GSH-Px活性显著低于CHG(P<0.05),血清T-SOD活性极显著低于CHG(P<0.01),血清MDA含量极显著高于CHG(P<0.01)。此结果表明,开放式舍饲组的羔羊随着试验的进行,体内氧化应激逐渐增加。

表6 不同舍饲条件对羔羊血清抗氧化指标的影响Table 6 Effects of different housing condition on serum antioxidant index in lambs
2.5 舍饲方式对羔羊血清免疫指标的影响
如表7所示,在试验第21 天,OHG羔羊的血清IL-1β含量显著低于CHG(P<0.05)。在试验第28 天,OHG羔羊的血清IL-1β含量极显著低于CHG(P<0.05),血清IL-4含量显著低于CHG(P<0.05)。其余指标两组间差异不显著(P>0.05)。结果表明,开放式舍饲组的羔羊随着试验的进行,血清白介素均下降,免疫水平有所降低。
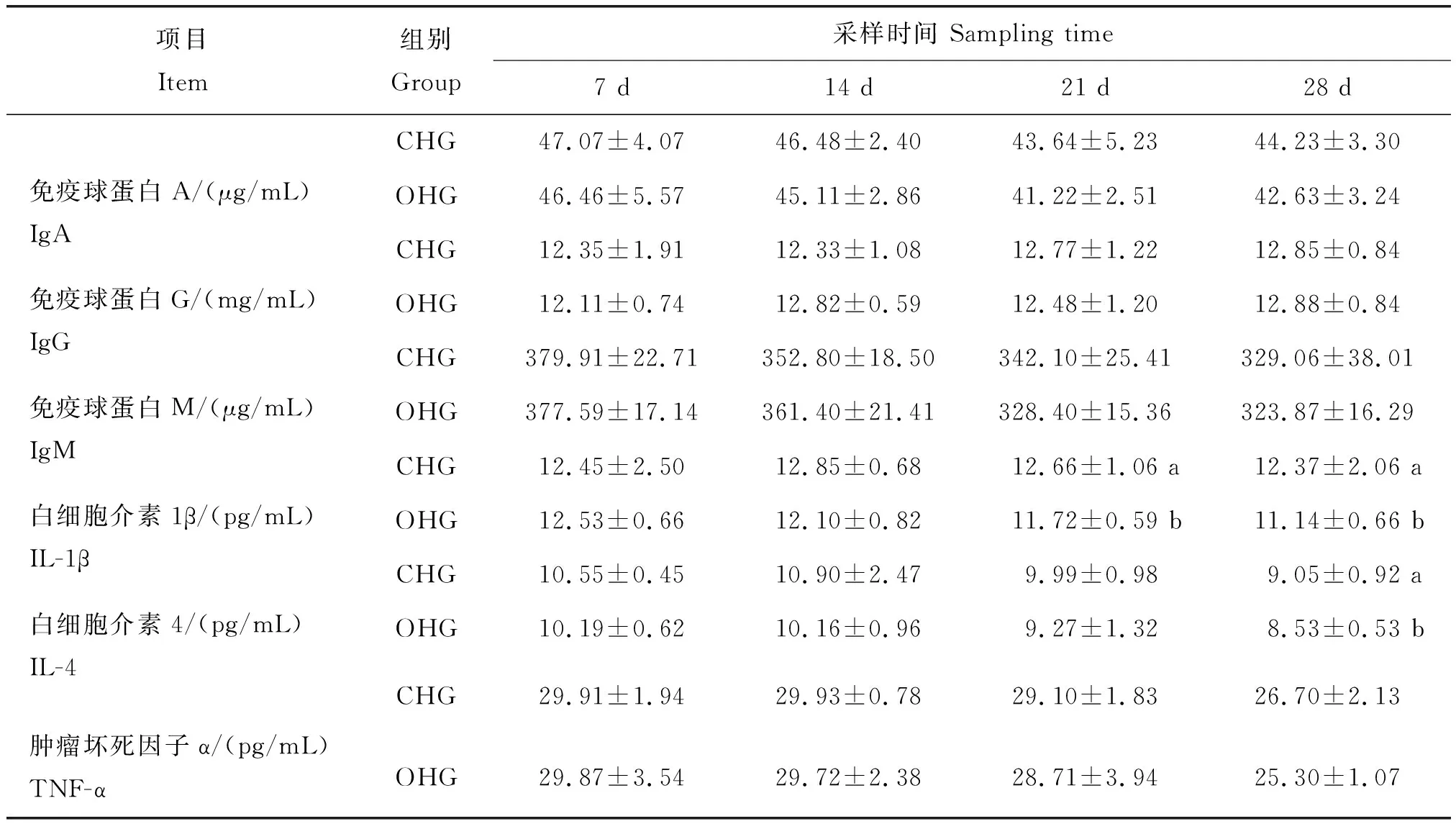
表7 不同舍饲方式对羔羊血清白介素和免疫球蛋白的影响Table 7 Effects of different housing models on serum interleukins and immunoglobulins in lambs
2.6 舍饲方式对羔羊血液白细胞中HSP、免疫抗氧化相关基因表达的影响
如图1和图2所示,在试验第14 天,OHG羔羊白细胞中抗氧化相关基因Nrf2和SOD1mRNA表达量显著高于CHG(P<0.05),免疫相关基因RIP2和NF-κBp65 mRNA 表达量显著低于CHG(P<0.05)。在试验第21天,OHG羔羊白细胞中HSP及抗氧化相关基因HSP90、Nrf2、GSH-Px和SOD1mRNA表达量显著高于CHG(P<0.05),免疫相关基因RIP2、NF-κBp50、NF-κBp65、IL-4和TNF-αmRNA表达量显著低于CHG(P<0.05)。在第28天,OHG羔羊白细胞中HSP及抗氧化相关基因HSF-1、HSP90、Nrf2、CAT、GSH-Px、SOD1和SOD2mRNA表达量显著高于CHG(P<0.05),免疫相关基因RIP2、NF-κBp50、NF-κBp65、IL-1β、IL-4 和TNF-αmRNA表达量显著低于CHG(P<0.05)。其余指标在两组间差异不显著(P>0.05)。结果表明,开放式舍饲组的羔羊随着试验的进行,其血液白细胞的HSP相关基因与抗氧化相关基因的转录水平均提高,免疫相关基因的转录水平均降低。

以第7天的封闭式舍饲组为对照,柱上不同上标a,b表明试验同一天两组间存在显著差异(P<0.05)。下同。CHG group of day 7 was taken as calibrator. The different superscripts on bar indicate a significant difference between the two groups on the same day (P<0.05). The same below.图1 不同舍饲方式对羔羊血液白细胞中HSP及抗氧化相关基因表达的影响Fig.1 Effects of different housing models on expression of HSP and antioxidant related genes in blood leukocytes of lambs

图2 不同舍饲方式对羔羊血液白细胞中免疫相关基因表达的影响Fig.2 Effects of different housing models on expression of immune related genes in blood leukocytes of lambs
3 讨 论
3.1 冬季两种不同舍饲方式对羔羊生长性能的影响
低温环境会增加机体热损失,动物会提高能量消耗来维持新陈代谢,造成生产性能降低。绵羊的下限临界温度为-3 ℃,在该温度下,每下降1 ℃,绵羊的日代谢能量需求就会增加0.14~0.64 MJ(60 kg的绵羊)[20]。研究发现,冬季舍外放牧的母羊相较于舍饲的母羊日增重减少了28.39 g/d[21]。韩国公牛在较冷三月份日增重和饲料效率均低于四月份[1]。本研究发现,封闭式舍饲组的舍内温度较开放式羊舍高了5.45 ℃,开放式舍饲组羔羊的表皮散热量增加,使其用于维持代谢需求的能量增多,降低了羔羊的日增重与饲料效率,且由于开放式舍饲组羔羊的日龄较小,长期的低温环境可能引起食欲下降,进而降低了开放式舍饲组羔羊的采食量和末体重,但二者均差异不显著,这可能由于组间温差较小和组内差异较大导致。有相似报道称,平均温度为-7.37 ℃的一月与平均温度为6.22 ℃的三月相比,韩国公牛的生长性能不受影响[2]。畜舍内的有害气体也是影响动物健康与生长的重要因素,我国氨排放的80%来源于畜禽养殖业,畜禽舍内大量NH3和CO2会引起动物呼吸道感染,降低动物免疫力[16]。本研究表明,封闭式舍饲组内NH3与CO2含量均高于开放式舍饲组内,且两组舍内NH3与CO2含量均高于舍外,但根据《畜禽场环境质量标准(NY/T 388—1999)》可知二者均处于正常畜禽场空气环境范围(NH3<20 mg/m3,CO2<1 500 mg/m3,本研究使用的是气体检测管法,与标准中使用的传统纳式试剂比色法虽有偏差,但也在合理范围内[22]),这可能是由于两组日均温度均处于0 ℃以下,排泄物被冻结,抑制了NH4+向NH3的转化[16],因此对机体的影响较小。
3.2 冬季两种不同舍饲方式对羔羊血液热休克蛋白的影响
HSPs是一类高度保守的分子伴侣蛋白,通过调节蛋白质的结构和功能参与信号转导[23],低温环境下机体会提高HSP转录和翻译水平适应外界环境的改变,是衡量应激大小的重要指标[24]。Banerjee等[12]研究发现冬季在低温条件下,山羊淋巴细胞中HSPA1A和HSPA8基因的表达显著增加。在本研究中,试验前三周两组羔羊血清的胰岛素、HSP70和HSP90含量影响并不显著,可能由于试验前三周两组均受到一定程度的冷暴露,试验期较短且温差不足以导致差异,但随着试验时间的延长,开放式舍饲组羔羊的血清HSP90含量和白细胞HSP90 mRNA表达水平提高,来维持细胞内结构和功能,帮助机体适应寒冷的环境。但是对HSP70却没有影响,可能由于急性冷暴露(在12 h内)会增加HSP70的表达,而慢性冷暴露(在24 h以上)会恢复其表达水平[25]。冷应激提高HSP的表达可能由于胰岛素的降低造成的。冷应激会激活交感神经,降低血清胰岛素水平和增加血清葡萄糖浓度来补偿机体能量消耗[8],而胰岛素的降低会通过类胰岛素受体衰变加速因子2(DAF-2)释放HSF-1进入细胞核并与热休克蛋白原件(HSE)结合增加HSP转录水平[26]。因此,开放式舍饲组的羔羊与封闭式舍饲组的羔羊相比,血清胰岛素含量更低,HSP水平更高,受到的应激更大。
3.3 冬季两种不同舍饲方式对羔羊血液抗氧化功能的影响
ROS是细胞线粒体氧化呼吸产生的自由基活性物质,在细胞抗氧化防御机制下通常保持在较低水平,但低温引起的代谢加强会产生大量的ROS[6],并氧化不饱和脂肪酸产生MDA,抗氧化酶系统可以清除MDA保护机体抵抗氧化应激[7]。研究发现冷暴露下的羔羊血清GSH-Px和CAT活性降低,MDA含量升高[3]。慢性冷应激使鸡心脏组织中CAT、GSH-Px和SOD活性降低[4]。本研究表明,开放式舍饲组的羔羊随着试验时间的延长其血清MDA含量增加,消耗并降低了血清抗氧化酶的活性,而封闭式舍饲组舍内的温度相对较高,MDA与抗氧化酶水平更为平衡。核因子E2相关因子2(Nrf2)是抗氧化酶基因转录的关键因子。冷应激引起机体氧化失衡时,过量的ROS与HSP90均可与Kelch样环氧氯丙烷相关蛋白1(Keap1)相互作用,解离Keap1-Nrf2复合物释放Nrf2进入细胞核激活其下游抗氧化基因的转录[10]。研究发现,低温处理的松鼠较常温饲养下的松鼠心脏组织中Nrf2 mRNA转录水平显著提高,Keap1 mRNA表达量显著降低[27]。本研究第7天两组间抗氧化酶基因相对表达量无差异,随着开放式舍饲组羔羊的低温暴露期增长,其血液白细胞的Nrf2及其下游抗氧化酶基因的转录水平均显著提高,这可能由于血液ROS的大量产生和白细胞HSP90 mRNA表达量的提高增加了HSP90-Keap1相互作用,激活了Nrf2及其下游抗氧化酶基因的转录。但值得注意的是,虽然抗氧化相关基因的表达上调,但血清抗氧化酶活性仍下降。这可能由于氧化应激会提高抗氧化相关基因的表达作为机体的代偿保护作用[28],加之抗氧化酶催化大量H2O2的产生,从而导致产物抑制了抗氧化酶的活性,有研究与本研究结果有类似发现,在氧化应激期间,大蒜提取物处理过的大鼠肝细胞中Nrf2 mRNA和蛋白的表达均增加,但抗氧化酶的活性仍低于正常水平[29]。血液在机体中起着运输营养物质等关键作用,在开放式舍饲组羔羊受到氧化应激时,体内各种组织产生的过量MDA会释放到血液中,造成血液MDA含量升高,而抗氧化酶会首先运输到心脏和肝脏等机体关键组织,导致了血液的抗氧化酶活性的降低。因此,开放式舍饲组羔羊抗氧化酶水平的降低说明其机体正处于氧化失衡,HSP90和Nrf2 mRNA的过表达是机体针对ROS损伤的保护机制。本研究表明,在冬季,开放式舍饲方式与封闭式舍饲方式的羔羊相比,血清抗氧化酶活性更低且MDA含量更高,提高舍内温度可缓解羔羊的氧化抗氧化失衡。
3.4 冬季两种不同舍饲方式对羔羊血液免疫功能的影响
血清免疫球蛋白是一类具有广泛免疫功能的蛋白质分子,它们可以与抗原特异性结合,激活补体并与细胞表面的Fc受体结合以获得特异性免疫,低温环境通常会使免疫球蛋白的分泌降低。石璐璐等[7]研究发现慢性冷应激显著降低绵羊血清IgG的含量,IgA与IgM含量也有所下降。本研究发现,随着试验的进行,两组羔羊的血清免疫球蛋白均呈下降趋势,这可能由于持续的低温降低了两组羔羊血清的免疫球蛋白分泌,且由于两组温差较小导致两组间差异不显著。血液中免疫细胞因子可以调控机体免疫反应,其含量高低可以反映机体免疫的状态,促炎细胞因子TNF-α和抗炎细胞因子IL-4分别是T淋巴细胞亚类Th1和Th2细胞分泌的细胞因子,两者的异常产生都会影响免疫和炎症反应。Wei等[4]研究发现,长期冷暴露显著降低鸡心脏组织中细胞因子的水平。本研究发现,随着试验时间的增加两组羔羊血清的细胞因子含量均呈下降趋势,这可能是两组舍内温度均低于羔羊的适宜生存温度,导致Th1和Th2平衡失调,进而降低了细胞因子IL-4和TNF-α的含量,且在试验后两周开放式舍饲组羔羊血清中促炎细胞因子IL-1β和抗炎细胞因子IL-4含量均低于封闭式舍饲组,说明开放式舍饲组Th1和Th2平衡失调更为严重,而IL-1β含量的降低可能是由于NF-κB调控其基因表达量下降而引起的。NF-κB是与免疫反应相关的关键转录因子,核苷酸结合寡聚结构域(NLR)家族成员NOD1可激活NF-κB途径提高免疫基因的转录[30],HSP90在冷应激期间可以维持NOD1的稳定性,使其处于抑制状态降低NF-κB的激活[11]。研究发现,冷应激期间,小鼠下丘脑细胞中的NF-κB和TNF-αmRNA表达量显著下调[30]。本研究表明,开放式饲养组内羔羊处于长期低温暴露下,HSP90 mRNA表达量增加,并通过NOD1抑制NF-κBmRNA表达,进而降低了IL-1β和TNF-αmRNA表达量。HSP的过表达可以帮助机体维持内环境稳态。HSP的上调不仅增加了Nrf2转录调控的抗氧化酶的表达[10],而且还降低了NF-κB转录调控的炎症和免疫反应[11],且Nrf2与NF-κB也互相影响,最近的研究表明,Nrf2通过增加抗氧化酶的转录水平来抑制NF-κB通路的激活,从而降低ROS介导的NF-κB的激活及炎症反应对机体的损伤[32]。本研究结果表明,冬季持续的低温环境使两组羔羊的血清免疫功能均受到一定程度的下降,导致免疫球蛋白的分泌和细胞因子含量呈下降趋势,且开放式舍饲组较低的环境温度使羔羊血清免疫功能显著降低。
4 结 论
本试验条件下,在冬季与封闭式羊舍相比,开放式羊舍会降低羔羊的日增重,增加料重比,引起羔羊的免疫水平降低和氧化应激,HSP表达水平的增加,可帮助维持机体内环境稳态。因此,由于羔羊保温与产热能力不足,冬季养殖比起运动量的增加更需要保温的作用。
