基于响应面法优化超声辅助提取青阳参苷元工艺
2022-05-25梁蕾蕾罗伊婷徐逍宣胡显光李永菲刘丹丹
梁蕾蕾,罗伊婷,徐逍宣,胡显光,李永菲,刘丹丹**
(1.昆明医科大学 基础医学院,云南 昆明 650500;2.昆明医科大学 药学院,云南省天然药物药理重点实验室,云南 昆明 650500;3.云南省食品药品监督检验研究院,云南 昆明 650000)
青阳参(CynanchumotophyllumSchnei)是萝藦科鹅绒藤属植物[1],其干燥根在云南少数民族中作药用.青阳参中化合物类型复杂多样,主要是C21甾体苷元与糖基结合而成的糖苷[2],药物学家证实了青阳参苷类化合物在抗癫痫、抗抑郁、抗肝脏纤维化和中枢镇静等方面有显著药理活性[3-7].
青阳参苷类化合物的甾体苷元大部分为青阳参苷元(Qingyangshengenin)(图1)和告达亭[8-9].过去的文献[10-12]以检测青阳参苷元含量反映青阳参苷类提取物或制剂的质量指标,缺乏对苷元单体的进一步探索.我们认为青阳参苷元在医药应用方面具备潜力,有进行结构修饰、药效学机制等研究的价值,而系统、重复、大量地获得青阳参苷元是开展研究的前提.

图1 青阳参苷元的结构Fig.1 Structure of Qingyangshengenin
提取青阳参苷元的报道鲜见.文献[5]采用回流提取法处理药品,操作繁琐、时间长;文献[13]以正交设计辅助优化了提取条件,但所得青阳参苷元提取率不甚理想.本研究通过盐酸水解糖苷游离出青阳参苷元,乙醇作提取溶剂,超声提取法处理,NaHCO3调节供试液pH 值,HPLC 法测定苷元含量.在单因素实验的基础上,结合Box-Behnken 实验设计和响应面法(RSM),对影响青阳参苷元提取率的主要因素及其交互作用进行分析探讨,确定了超声提取青阳参苷元的最佳技术参数,为青阳参苷元的分离制备奠定基础.
1 材料与仪器
1.1 材料青阳参苷元对照品(上海同田生物技术股份有限公司,批号:P1548443,纯度:HPLC 测定w≥98%);甲醇、乙腈(韶关高科祥高新材料有限公司,色谱纯);纯净水;其他试剂为分析纯.
青阳参药材购自昆明市菊花园中药材专业市场,经昆明医科大学药学院暨云南省天然药物药理重点实验室陆露研究员(研究方向为药用植物学)鉴定为青阳参(Cynanchum otophyllumSchnei)的干燥根,加工成0.172 mm(100 目)粉末备用.
1.2 主要实验仪器Waters e2695 型高效液相色谱仪(瑞士BUCHI 公司);SK3200H 型超声波清洗仪(宁波新芝生物科技股份有限公司);STARTER300型便携式pH 计(常州奥豪斯仪器有限公司);GR-202 型电子分析天平(日本AND 公司).
2 实验方法
2.1 超声处理法制备青阳参苷元供试液精确称取青阳参粉末5 g,置于100 mL 圆底烧瓶,加入乙醇和盐酸水溶液,使料液比为1∶10(g/mL),置于超声清洗仪中,以特定的超声功率、超声温度、超声时间进行提取.取出冷却,用饱和NaHCO3水溶液调节pH 至7~8,抽滤,滤液转移入容量瓶,用甲醇定容至100 mL,即得到青阳参苷元供试液.
2.2 含量测定
2.2.1 对照品溶液的配制 精密称取青阳参苷元对照品10 mg,置10 mL 容量瓶中.用甲醇定容至刻度,摇匀,即为1 mg/mL 的青阳参苷元对照品溶液备用.
2.2.2 色谱条件 色谱柱:Diamonsil C18(φ4.6 mm ×250 mm,5 μm),柱温25 ℃;流动相:乙腈(A)−水(B)梯度洗脱(体积比,0~10 min,30% A;10~15 min,30~38% A;15~20 min,38% A;20~28 min,38~43% A;28~36 min,43% A;36~38 min,43~56% A;38~46 min,56% A;46~64 min,56~74% A;64~72 min,74% A;72~73 min,74~90% A;73~75 min,90% A);流速:1 mL/min;进样量:10 μL;检测波长:259 nm(青阳参苷元最大吸收波长).
2.2.3 标准曲线的绘制 以“2.2.1”项中青阳参苷元对照品溶液,用甲醇定量稀释为0.001、0.025、0.050、0.125、0.250、0.500、1.000 g/L 的不同质量浓度溶液,按“2.2.2”项色谱条件测定.峰面积Y为纵坐标,质量浓度ρ(g/L)为横坐标回归处理,得回归方程Y=17 174 520ρ− 68 757(R2=0.999 9,n=7).结果表明,青阳参苷元质量浓度在0.001~1.000 g/L 与峰面积呈良好的线性关系.
2.2.4 精密度实验 取“2.2.1”项中青阳参苷元对照品溶液,连续测定6 次,测得峰面积的RSD=1.00%,证明进样精密度良好.
2.2.5 重复性实验 取“2.1”项中青阳参苷元供试液,连续测定6 次,测得峰面积的RSD=1.30%,证明此方法重复性良好.
2.2.6 稳定性实验 取“2.1”项中青阳参苷元供试液,24 h 内每隔3 h 测定1 次,测得峰面积的RSD=1.40%,表明供试品溶液在24 h 内稳定.
2.2.7 样品的测定 按“2.1”项制备青阳参苷元供试液,在“2.2.2”项色谱条件下,分别取供试液和对照品溶液进样.以峰面积按外标−标准曲线法测定含量,并计算青阳参苷元的提取率.
2.3 单因素实验精确称取青阳参粉末5 g,以料液比1 :10(g/mL)为工艺基础,分别研究提取溶液的盐酸浓度、乙醇体积分数、超声功率、超声温度和超声时间5 个单因素对供试液中青阳参苷元含量的影响,各因素的考察水平见表1.每个条件平行实验3 组,结果取平均值.
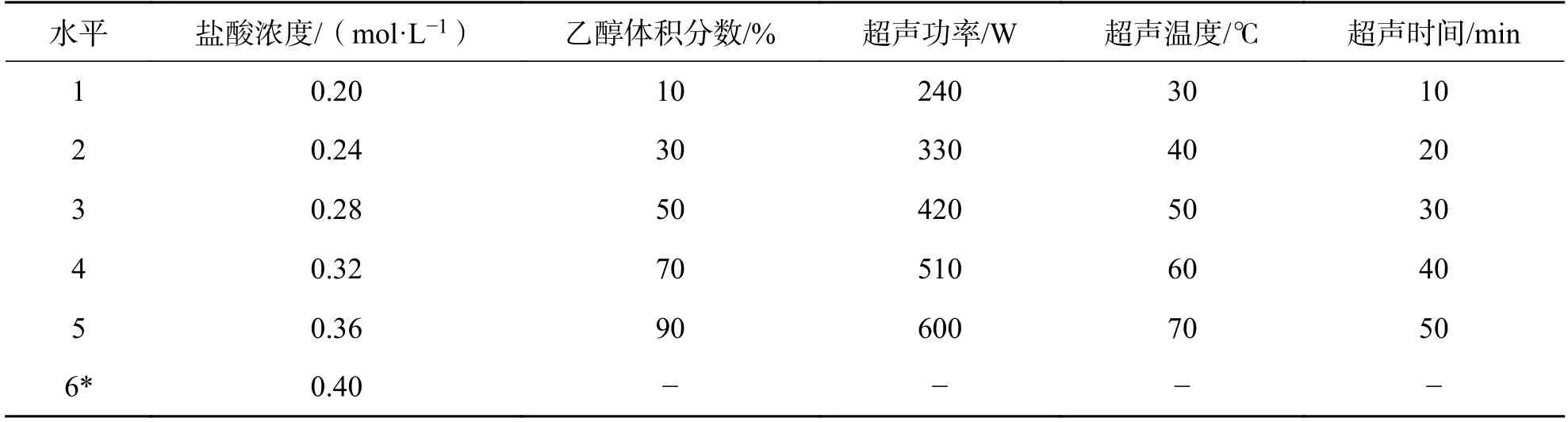
表1 单因素实验考察因素及水平Tab.1 The factors and levels of single factor experiment
2.4 响应面实验设计在单因素实验基础上,分析乙醇体积分数、超声温度、超声时间三因素对提取效果的影响.以青阳参苷元提取率为响应值,采用 Box-Behnken 设计和响应面法(RSM)优化青阳参中青阳参苷元的提取工艺参数,各因素水平见表2.每个条件平行实验3 组,结果取平均值.
3 结果与分析
3.1 单因素实验结果
3.1.1 提取溶液的盐酸浓度 首先按“2.1”项制备青阳参苷元供试液,在乙醇体积分数50%、超声功率420 W、超声温度50 ℃、超声时间30 min 的固定条件下,分别选取提取溶液的盐酸浓度为0.20、0.24、0.28、0.32、0.36、0.40 mol/L,并按“2.2.2”项和“2.2.7”项方法测定青阳参苷元的提取率.随着提取溶液的盐酸浓度增加,提取率升高后降低,盐酸浓度达到0.36 mol/L 时,提取率最高.盐酸浓度低,青阳参糖苷无法充分水解,同时溶液粘度很大难以抽滤.当盐酸浓度高于0.36 mol/L 时,可能发生化学反应破坏了青阳参苷元的结构,使提取率又显著下降.因此,后续实验提取溶液的盐酸浓度均确定在0.36 mol/L.
3.1.2 乙醇体积分数 在提取溶液的盐酸浓度0.36 mol/L、超声功率420 W、超声温度50 ℃、超声时间30 min 的条件下,分别选取乙醇体积分数为10%、30%、50%、70%、90%,测定青阳参苷元的提取率.随乙醇体积分数增加,提取率升高后降低,乙醇体积分数为50%时,提取率达到峰值,故将乙醇体积分数的多因素考察中心点定为50%.
3.1.3 超声功率 在提取溶液的盐酸浓度0.36 mol/L、乙醇体积分数50%、超声温度50 ℃、超声时间30 min 的条件下,分别选取超声功率为240、330、420、510、600 W,测定青阳参苷元的提取率.随超声功率增加,提取率不断升高.由于600 W 是所用超声仪的上限,是否还有更高的功率更有利于青阳参苷元的溶出,需要进一步的研究工作.因此,限于实验条件把超声功率确定在600 W,不将其作为多因素考察内容.
3.1.4 超声温度 在提取溶液的盐酸浓度0.36 mol/L、乙醇体积分数50%、超声功率600 W、超声时间30 min 的条件下,分别选取超声温度为30、40、50、60、70 ℃,测定青阳参苷元的提取率.随超声温度增加,提取率升高后呈下降趋势,超声温度为60 ℃时,提取率达到峰值,故将超声温度的多因素考察中心点定为60 ℃.
3.1.5 超声时间 在提取溶液的盐酸浓度0.36 mol/L、乙醇体积分数50%、超声功率600 W、超声温度60 ℃的固定条件下,分别选取超声时间为10、20、30、40、50 min,测定青阳参苷元的提取率.随超声时间增加,提取率升高后又下降,超声时间为30 min 时,提取率达到峰值,故将超声时间的多因素考察中心点定为30 min.
3.2 响应面实验(Response surface methodology,RSM)设计及结果
3.2.1 响应面法实验设计及结果 根据Box-Behnken 的统计设计原理,参考单因素实验结果,选择乙醇体积分数、超声温度和超声时间进行三因素三水平实验设计,实验方案及结果见表3.

表3 响应面实验方案及实验结果Tab.3 The experiment design and results of RSM
3.2.2 响应面法回归方程及方差分析 采用Design Expert 11 软件对实验数据进行多元回归拟合,得到以响应值为目标函数的二次回归方程为:Y=0.264 3+0.016 6A+0.007 7B+0.015 7C+0.003 1AB+0.021 0AC− 0.011 0BC− 0.031 3A2− 0.010 0B2− 0.034 2C2,式中Y为青阳参苷元提取率,A为乙醇体积分数,B为超声温度,C为超声时间.
回归模型的方差分析及显著性检验结果见表4.P值反映模型或因素对响应值影响的显著程度,P值越小表示越显著;F值反映模型或因素对响应值影响的具体程度,F值越大表示影响越大.模型的P<0.01,说明模型差异显著,具有统计学意义.A、B、C、AC、BC、A2、B2与C2为显著影响因素,即乙醇体积分数、超声温度、超声时间皆对青阳参苷元提取率影响大,并且乙醇体积分数与超声时间、超声温度与超声时间之间具有明显的交互作用.失拟项P=0.196 9,差异不显著,说明模型与实验数据拟合程度高,实验误差小.回归系数R2=0.982 5,调整确定系数RAdj2=0.951 1,表明响应值95.11%的变化可用该模型解释.RSD=3.19%小于10%,信噪比14.964 8 大于4,所以模型的稳定性、预测性均良好.

表4 回归模型方差分析结果Tab.4 Analysis resuIts of variance for quadric regression model
3.2.3 响应曲面分析 响应面图及等高线图直观反映了各因素及其交互作用对响应值的影响,响应面图中曲线越弯曲表示研究因素对响应值影响越大,等高线越呈椭圆形表示研究因素之间的交互作用越显著.利用Design Experts 11 软件将各因素两两进行拟合,得出相应的响应面图和等高线图,见图2.影响青阳参苷元提取率的显著因素为乙醇体积分数与超声时间,超声温度最小,并且乙醇体积分数与超声时间、超声温度与超声时间之间有显著的交互作用.结果表明,响应面图及等高线图与回归模型方差分析结果是一致的.

图2 各因素对青阳参苷元提取率影响的响应面图及等高线图Fig.2 Responsive surface and contour of effects of each factor on extraction rate of Qingyangshengenin
3.2.4 优化与验证 通过软件分析,乙醇体积分数57.60%、超声温度62.76 ℃、超声时间33.02 min为青阳参苷元最佳提取工艺参数,提取率预测值为0.271 0%.为了便于实际操作,将最佳参数调整为乙醇体积分数58%、超声温度63 ℃、超声时间33 min.以此条件进行3 次平行验证实验,青阳参苷元提取率平均值为0.274 5%,与预测值的RSD值为0.91%,说明模型预测性较好,有使用价值.
4 结论
本实验运用超声提取法处理、HPLC 法检测,首先考察了提取溶液的盐酸浓度、乙醇体积分数、超声功率、超声温度和超声时间对青阳参苷元提取率的影响,然后以乙醇体积分数、超声温度及超声时间作因素水平表,采用响应面法优化青阳参苷元超声提取的工艺.以青阳参苷元提取率为响应值,优化得出的最佳超声提取工艺参数为:提取溶液的盐酸浓度0.36 mol/L、料液比1∶10(g/mL)、乙醇体积分数58%、超声功率600 W、超声温度63 ℃、超声时间33 min,此条件下青阳参苷元提取率为0.274 5%.
超声提取法较其他常用的提取方法操作更简单,工艺运行成本低、能耗小,提取效率高;乙醇作提取溶剂可减少有毒溶剂残留和降低成本;同时,以弱碱NaHCO3代替NaOH 中和提取液酸性,确保青阳参苷元不会与强碱成盐损失而造成提取率下降,也避免了腐蚀性对人体和环境的不利影响.因此,本实验提供了一个高效、绿色的青阳参苷元提取方法,为青阳参苷元的分离制备、药理及构效关系研究等打下良好的基础.
