紫苏caleosin基因克隆及表达分析
2022-05-24史华平董书言周雅莉王计平李润植
王 超,史华平,董书言,邢 志,周雅莉,王计平*,李润植
(1. 山西农业大学农学院(作物科学研究所),太谷 030801; 2. 山西农业大学(山西省农业科学院)果树研究所,太谷 030815)
紫苏(Perilla frutescensL. Britt.)是唇形科紫苏属的一年生草本植物,又名香苏、红苏等[1],原产于中国中南部地区,在我国已有2000多年的栽培历史,现广泛分布于全国各地[2]。紫苏在我国北方主要用作油料作物,少部分作为药材来使用;在南方地区,紫苏以药用为主,食用为辅[3-4]。紫苏种子含油率高达45%~55%,其中不饱和脂肪酸含量丰富,占总含油量的90%以上,是日常食用油中不饱和脂肪酸含量较多的一种新型油料作物。
植物种子中储存着大量中性脂,主要成分为三酰甘油(triacylglycerol,TAG)。TAG在内质网膜中装配后向外凸起,磷脂单分子层结合在其外部形成大小不等的油体,油体融合成一定大小后,油体蛋白对其进行包裹便形成稳定的成熟油体,从内质网释放到细胞液中[5]。TAG主要为种子萌发及幼苗的生长提供碳源和能量,而油体是负责储存TAG的一个特殊细胞器[6]。油体蛋白主要分为三类:油质蛋白(oleosin)、油体钙蛋白(caleosin)和油体甾醇蛋白(steroleosin)[6]。caleosin和oleosin均能使油体更加稳定。Chen等[7]分析推测,在使用相同含量的TAG时,等量caleosin能比oleosin覆盖更多的油体面积,表明caleosin可以更有效地结合油体,是一种高效油体蛋白[8]。目前,在藻类植物[9]、蓖麻[10]、油菜[11]、小麦[12]、芍药[13]、水稻[14]、拟南芥[15]等物种中,caleosin基因均已被克隆并进行功能分析。
caleosin作为环化酶催化不饱和脂肪酸,形成环氧脂肪酸,而环氧脂肪酸与植物中氧脂素代谢相关,能调控植物抗逆性并产生自身免疫[16]。在干旱胁迫时,caleosin N端可以感受内质网膜腔内的Ca2+浓度变化,而C端发生磷酸化修饰,从而在干旱胁迫信号转导过程中起重要的调控作用[14]。在水稻[14]、雨生红球藻[9]、拟南芥[17]等研究中发现,caleosin基因参与了植物对环境胁迫的响应。本文从紫苏转录组数据库中筛选获得PfClo1基因的开放阅读框(open reading frame,ORF)序列,并对其进行分子克隆及生物信息学分析,通过实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)研究PfClo1基因在紫苏不同组织、不同品种及干旱胁迫处理幼苗中的表达特性,初步探讨PfClo1基因的生物学功能,为进一步深入研究PfClo1基因在紫苏油脂合成中的功能及对干旱胁迫的响应机制提供理论依据。
1 材料与方法
1.1 试验材料
紫苏品种为山西农业大学分子农业与生物能源研究所保存的‘晋紫苏1号’和‘并紫苏1号’。
1.2 试验方法
1.2.1 材料处理
选取均匀一致、籽粒饱满的‘晋紫苏1号’种子放入清洗干净的小烧杯中,用自来水冲洗20 min,置于10 mL离心管中,用无菌水冲洗3次(每次3 min),然后用75%的酒精消毒处理40 s,无菌水冲洗3次。准备好铺有滤纸的培养皿,加入自来水(浸湿滤纸即可),将处理好的紫苏种子整齐均匀地摆放到滤纸上常温暗培养。待紫苏长出2片子叶时光照培养(光照16 h、暗培养8 h、湿度80%),待长出4片真叶时选取长势良好的幼苗进行20%聚乙二醇(polyethylene glycol,PEG)干旱胁迫处理。分别在胁迫处理后0、3、6、9、12、24 h各取5株幼苗全株放入1.5 mL离心管中,做好标记后放入液氮中速冻,-80℃保存备用。
在大田中取不同油脂含量的紫苏品种(‘并紫苏1号’的含油率为35.6%,‘晋紫苏1号’的含油率为46.8%)的根、茎、叶、花及不同发育时期的种子(开花后10、20、30、40 d),液氮速冻,-80℃保存备用。
1.2.2PfClo1和PfClo2基因的鉴定及生物信息学分析
在运用高通量测序获得的紫苏转录组数据库(使用根、茎、叶、花、开花后10、20、30、40 d的种子混样测定)中筛选获得PfClo1和PfClo2两个基因片段。
通过NCBI-BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行同源序列比对后,使用在线分析软件对PfClo基因进行生物信息学分析。利用ProtParam在线分析软件(https//web.expasy.org/protparam/)对基因进行基本理化性质的分析;利用PSORT在线分析软件(https://Psort.hgc.jp/form2.html)对基因进行亚细胞定位预测;利用SOPMA在线分析软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白质二级结构的预测;利用SWISS-MODEL在线分析软件(https://swissmodel.expasy.org/interactive)构建蛋白质三级结构模型;利用NCBI-CDD在线分析软件(https://www.ncbi.nlmnih.gov/structure/cdd/wrpsb.cgi)分析基因的保守域和功能结构域;使用DNAMAN软件进行多序列比对分析,使用MEGA 7.0、Clustal W软件进行系统发育树的构建和分析。
1.2.3PfClo1和PfClo2基因在紫苏不同组织中的表达特性分析
使用艾德莱生物公司的EASYspin植物RNA快速提取试剂盒提取-80℃保存的紫苏材料的RNA,使用ABM反转录试剂盒进行反转录得到cDNA,稀释至100 ng/μL后-20℃保存备用。利用Primer 6.0设计荧光定量引物(表1),以Actin2作为内参基因。使用2×RealStar Green Power Mixture试剂盒(购自Genstar公司),通过荧光定量分析仪进行qRT-PCR扩增。qRT-PCR反应体系(20.0 μL):2×RealStar Green Power Mixture 10.0 μL、PfClo1/2F 0.5 μL、Pf-Clo1/2R 0.5 μL、cDNA模板 1.0 μL、ddH2O 8.0 μL。扩增程序:94℃ 10 min,95℃ 15 s,55℃ 1 min,40个循环。每个样品重复3次。通过表达谱分析,选取PfClo1基因进行后续研究。
1.2.4 引物设计
使用Primer 6.0软件设计PCR引物(表1)。
1.2.5PfClo1基因的克隆
通过表达谱分析,选取PfClo1基因进行克隆,利用Primer 6.0设计全长引物(表1),以紫苏叶片cDNA为模板,按照2ÍTS-INGKE Master Mix(北京擎科生物公司)试剂盒体系和程序进行PCR扩增,将PCR产物经琼脂糖凝胶电泳后使用SanPrep柱式DNA回收试剂盒(上海生工生物工程股份有限公司)回收,测定回收产物的质量浓度,连接到Pmd19-T载体中,转化大肠杆菌DH5α,涂板挑取单克隆,菌检为阳性后送至上海生工生物工程股份有限公司测序。
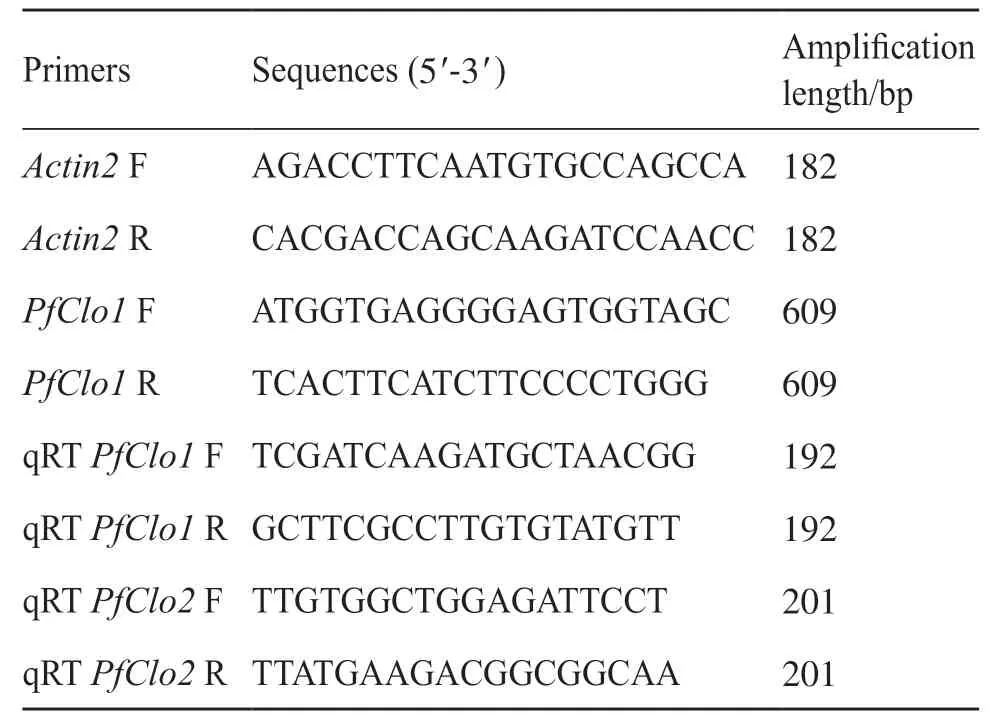
表1 引物信息Tab. 1 Primer information
1.2.6PfClo1基因在不同紫苏品种中的差异表达及对干旱胁迫响应分析
提取‘晋紫苏1号’和‘并紫苏1号’不同组织的RNA及‘晋紫苏1号’干旱胁迫处理后的叶片RNA,反转录成cDNA后通过荧光定量分析仪进行qRT-PCR扩增。
2 结果与分析
2.1 PfClo蛋白的理化性质分析
PfClo1蛋白的分子式为C1841H3075N609O780S121,相对分子质量为50100.54,理论等电点为5.19(呈酸性),不稳定系数为40.76,属于不稳定蛋白,脂肪酸系数为26.60,亲水性系数为0.678,属于疏水性蛋白。PSORT软件预测PfClo1蛋白定位于细胞质,属于胞内蛋白。PfClo2蛋白的分子式为C1755H2930N582O732S120,相对分子质量为47743.23,理论等电点为5.18(呈酸性),不稳定系数为40.28,属于不稳定蛋白,脂肪酸系数为29.73,亲水性系数为0.775,属于疏水性蛋白。PSORT软件预测PfClo2蛋白定位于细胞质,属于胞内蛋白。
2.2 PfClo蛋白的结构分析
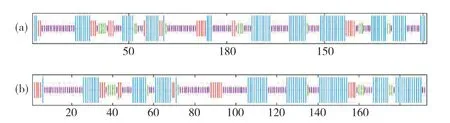
图1 紫苏PfClo蛋白二级结构Fig. 1 The secondary structure of PfClo protein in perilla蓝色线条:α-螺旋;红色线条:延伸链;绿色线条:β-折叠;紫色线条:无规则卷曲。Blue line: α-helix; Red line: Extended strand; Green line: β-sheet; Purple line: Random coil.
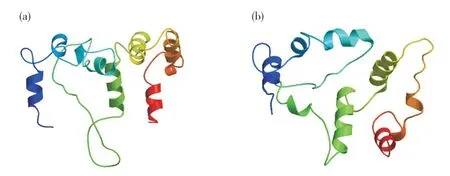
图2 紫苏PfClo蛋白三级结构Fig. 2 The tertiary structure prediction of PfClo protein in perilla(a)PfClo1蛋白;(b)PfClo2蛋白。(a) Pfclo1 protein; (b) Pfclo2 protein.
2.3 PfClo蛋白的多序列比对分析
利用在线软件进行紫苏PfClo基因编码氨基酸的多序列比对及功能结构域分析,结果如图3所示,PfClo蛋白与芝麻(Sesamum indicum,NM_001304394.1)、丹参(Salvia miltiorrhizaXM_042171389.1)、烟草(Nicotiana tabacum,XM_016615461.1)和拟南芥(Arabidopsis,AT4G26740.1)的caleosin家族成员具有相似结构,具有钙结合基序、酪蛋白激酶Ⅱ磷酸化位点等保守结构域。

图3 紫苏与其他物种caleosin的氨基酸序列比对Fig. 3 Amino acid sequence alignment of caleosin from perilla and other species钙结合基序和酪蛋白激酶II磷酸化位点的片段用红线标出,名称在底部标出。Pf:紫苏;Si:芝麻;Sm:丹参;Nt:烟草;At:拟南芥。The fragments of calcium binding motif and casein kinase II phosphorylation site are marked with red horizontal line and the names are marked at the bottom. Pf: Perilla frutescens; Si: Sesamum indicum; Sm: Salvia miltiorrhiza; Nt: Nicotiana tabacum; At: Arabidopsis thaliana.
2.4 PfClo蛋白的系统进化树分析
在NCBI数据库中使用Clustal W软件将紫苏PfClo蛋白与其他8种植物[芝麻(Sesamum indicum,NM_001304394.1)、丹参(Salvia miltiorrhiza,XM_042171389.1)、烟草(Nicotiana tabacumXM_016615461.1)、拟南芥(Arabidopsis,AT4G26740.1)、蓖麻(RicinuscommunisXM_002528321.3)、向日葵(Helianthus annuus,XM_022185293.2)、甘蓝型油菜(Brassica napus,NM_001315834.1)、花生(Arachis hypogaea,XM_025820922.2)]的caleosin序列进行多序列比对,并用MEGA7.0软件构建系统进化树(图4)。可以看出,PfClo1与丹参SmClo聚为一支,均属于唇形科植物,亲缘关系更为接近;PfClo2与蓖麻RcClo聚为一支,亲缘关系更为接近。

图4 紫苏与其他物种caleosin的系统进化树Fig. 4 Phylogenetic tree of caleosin from perilla and other species
2.5 PfClo1和PfClo2基因在‘晋紫苏1号’不同 组织中的表达特性分析
紫苏PfClo基因在不同组织中的表达谱分析表明(图5):PfClo1基因在根、茎、叶中基本不表达,在花中表达量较高,该基因主要在种子中表达,且随着种子的发育表达量不断增加,在开花后30 d表达量达到最高,是开花后10 d表达量的22.08倍;PfClo2基因仅在叶和花中微量表达,在根、茎、种子中均不表达。因此,本研究选取PfClo1基因进行后续试验。

图5 ‘晋紫苏1号’不同组织中PfClo1(a)和PfClo2(b)基因的表达特性Fig. 5 Expression characteristics of PfClo1 (a) and PfClo2 (b) genes in different tissues of ‘Jinzisu 1’不同小写字母代表P<0.05水平上的差异显著。R:根;S:茎;L:叶;F:花;10 d:开花后10 d的种子;20 d:开花后20 d的种子;30 d:开花后30 d的种子;40 d:开花后40 d的种子。下同。Different lowercase letters represent significant differences at the level of P<0.05 . R: Root; S: Stem; L: Leaf; F: Flower; 10 d: Seeds 10 days after flowering; 20 d: Seeds 20 days after flowering; 30 d: Seeds 30 days after flowering; 40 d: Seeds 40 days after flowering. The same below.
2.6 紫苏PfClo1基因的克隆
从紫苏转录组数据库中筛选并克隆获得Pf-Clo1基因(图6)。紫苏PfClo1基因的cDNA全长序列为609 bp,编码202个氨基酸残基(图7)。

图6 PfClo1基因克隆电泳图Fig. 6 PfClo1 gene cloning electrophoresisM:Marker DL2000。M: Marker DL2000.

图7 紫苏PfClo1的核苷酸序列和氨基酸序列Fig. 7 Nucleotide sequence and amino acid sequence of PfClo1起始密码子用红色框框出,终止密码子以星号指示。The start codon is framed in red, the end codon is indicated by an asterisk.
2.7 PfClo1基因在不同紫苏品种中的表达特性分析
紫苏PfClo1基因在不同紫苏品种中的表达特性分析表明(图8),PfClo1基因在‘并紫苏1号’种子中特异性表达,且开花后40 d表达量最高,但总体来说,相比高油品种‘晋紫苏1号’,其相对表达水平较低,可见编码caleosin的PfClo1基因在不同油脂含量的紫苏材料中存在正相关关系。
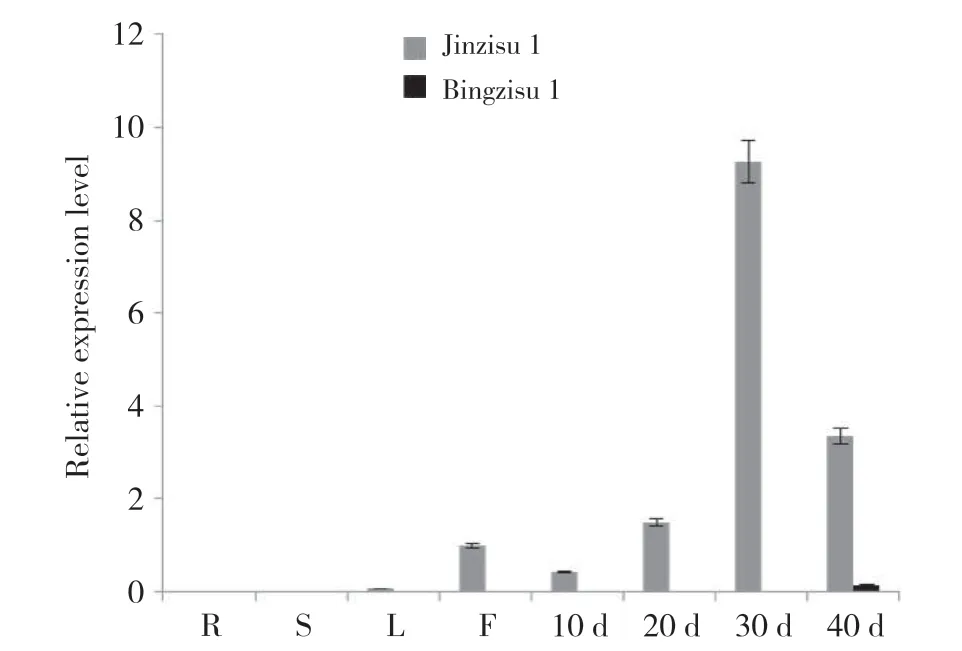
图8 PfClo1基因在‘晋紫苏1号’和‘并紫苏1号’中的表达特性Fig. 8 Expression characteristics of PfClo1 gene in ‘Jinzisu 1’ and ‘Bingzisu 1’ varieties
2.8 干旱胁迫条件下 PfClo1基因在‘晋紫苏1号’中的表达特性分析
PfClo1基因在20% PEG胁迫后的表达情况分析如图9所示:随着胁迫处理时间的延长,Pf-Clo1基因的表达量急剧上升,胁迫6 h时表达量是3 h表达量的9.92倍;随后表达量继续升高,12 h时PfClo1基因的表达量达到最高,为0 h表达量的6.78倍,3 h表达量的23.56倍,胁迫处理24 h时表达量开始下降。
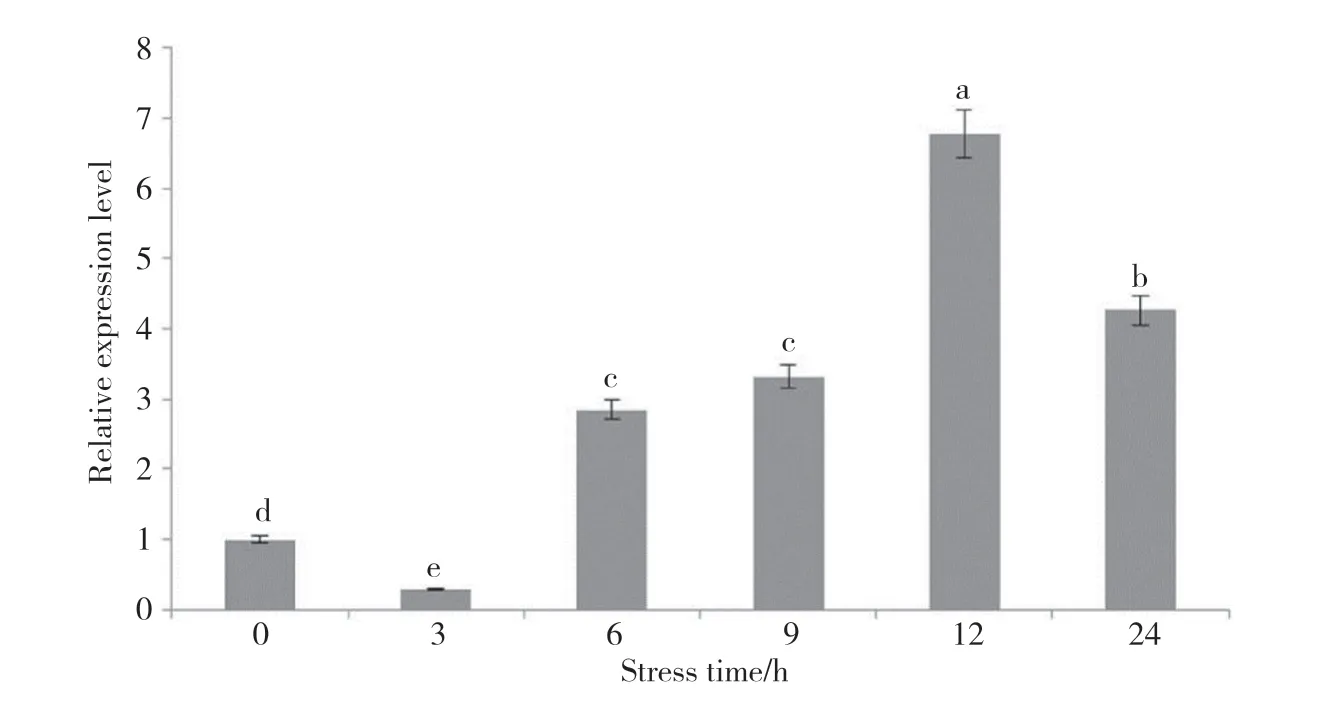
图9 PfClo1基因干旱条件下在‘晋紫苏1号’中的表达特性Fig. 9 Analysis of the expression characteristics of PfClo1 gene in ‘Jinzisu 1’ under drought conditions不同小写字母代表P<0.05水平上的差异显著。Different lowercase letters represent significant differences at the level of P<0.05.
3 讨论
油体钙蛋白基因caleosin在油体形成过程中起重要作用。Khalil等[18]、Marine等[19]研究发现,过表达caleosin基因有利于合成更多数量的油体。在酵母中过表达caleosin基因会使酵母油脂积累量、油体数量增加,且油体体积增大[10],表明caleosin基因超表达可以诱导油脂的合成积累。丁勇等[11]、魏征等[14]的研究结果表明:油体蛋白N端存在能够结合Ca2+的EF-hand区域,可能发挥调控信号转导途径的功能;中间部分存在疏水区域,能增加油体蛋白的疏水性,提高油体的稳定性;C端带有保守蛋白激酶磷酸化位点,能启动油体合成途径。紫苏PfClo1属于典型的caleosin家族,其C末端结构域含有酪蛋白激酶II(casein kinase II,CKII)磷酸化位点,可推测其在油体成熟时参与Ca2+信号转导,这与上述研究结果一致。多序列比对及系统进化分析验证了PfClo1与芝麻、丹参、拟南芥等植物的caleosin具有相似的结构域及较近的亲缘关系,推测该基因在紫苏中编码caleosin蛋白,调控油体合成,增加油体的稳定性。
caleosin基因在不同植物中的表达特性不同,在水稻不同组织中均有表达[14],在芍药[13]和芝麻[20]种子中其表达量呈先升高后降低的趋势。本研究通过分析紫苏不同组织及种子发育不同时期caleosin基因的表达特性,发现其在花和种子中均有表达,在种子发育后期表达量达到高峰,与油体形成时期相符,推测该基因高量表达与油体形成有关;通过分析不同紫苏品种的差异表达,发现低油品种‘并紫苏1号’的PfClo1基因表达量极低,推测编码油体钙蛋白的PfClo1基因的表达与紫苏油脂的形成存在一定的正相关关系。
为丰富滁河左岸堤顶路防浪墙景观效果,左岸景观中的防浪墙造型采用异形流线手法,蜿蜒在滁河岸边,而景墙则采用山水画卷图案刻画在异型混凝土上来显现。该材料在生产过程中一次成型,后期无需其他工序。所有工作均在工厂完成,只需运输至现场安装即可,整个过程实现PC化,即计算机雕刻模型,先做好路径,然后采用机器雕刻。
向兰舟等[17]在拟南芥中研究发现,在高盐、高温胁迫及脱落酸(abscisic acid,ABA)诱导条件下,AtCLO3基因表达均上调,其中高温胁迫下表达显著上调。魏征等[14]在水稻研究中发现,PEG6000模拟干旱胁迫时,OsCLO-3和OsCLO-6在各个组织中的表达水平均有所上调。本研究通过分析紫苏在干旱胁迫下caleosin基因的表达特性,可以看出在干旱胁迫6 h时表达量已明显升高,胁迫12 h时达到高峰,表明PfClo1基因具有干旱应答功能,能够快速响应干旱胁迫。
参考文献(References):
[1]回瑞华, 刁全平, 侯冬岩, 等. 紫苏籽中脂肪酸及主成分α-亚麻酸的分析[J]. 鞍山师范学院学报, 2016, 18(4): 24-27.
HUI Ruihua, DIAO Quanping, HOU Dongyan,et al. Fatty acids in perilla seed and principal component analysis of alpha linolenic acid[J]. Journal of Anshan Normal University, 2016, 18(4): 24-27.
[2]谭美莲, 严明芳, 汪磊, 等. 国内外紫苏研究进展概述[J]. 中国油料作物学报, 2012, 34(2): 225-231.
TAN Meilian, YAN Mingfang, WANG Lei,et al. Research progress onPerilla frutescens[J]. Chinese Journal of Oil Crop Sciences, 2012, 34(2): 225-231.
[3]王岚, 夏继成. 紫苏油的研究现状及应用[J]. 黑龙江科技信息, 2011(35): 1.
WANG Lan, XIA Jicheng. Research status and application of perilla oil[J]. Heilongjiang Science and Technology Information, 2011(35): 1.
[4]李鹏, 朱建飞, 唐春红. 紫苏的研究动态[J]. 重庆工商大学学报 (自然科学版), 2010, 27(3): 271-275.
LI Peng, ZHU Jianfei, TANG Chunhong. Research progress ofPerilla frutescensand perilla meal[J]. Journal of Chongqing Technology and Business University (Natural Science Edition), 2010, 27(3): 271-275.
[5]SCHMUTZ J, CANNON S B, SCHLUETER J,et al. Genome sequence of the palaeopolyploid soybean[J]. Nature, 2010, 463(7294): 178-183.
[6]沈玥. 油料作物酰基脂类代谢基因和转录因子及油体钙蛋白的基因组学分析[D]. 咸阳: 西北农林科技大学, 2016.
SHENG Yue. Genome-wide investigation of acyl-lipid metabolism and caleosin in oilcrops[D]. Xianyang: Northwest A&F University, 2016.
[7]CHEN M, CHYAN C L, LEE T,et al. Constitution of stable artificial oil bodies with triacylglycerol, phospholipid, and caleosin[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 3982-3987.
[8]JIANG P L, TZEN J T C. Caleosin serves as the major structural protein as efficient as oleosin on the surface of seed oil bodies[J]. Plant Signaling & Behavior, 2010, 5(4): 447-449.
[9]朱琴, 张宏江, 张春辉, 等. 雨生红球藻caleosin基因的克隆、 序列分析及表达特性[J]. 激光生物学报, 2020, 29(6): 529-537.
ZHU Qing, ZHANG Hongjiang, ZHANG Chunhui,et al. Molecular cloning, sequencing analysis and expression characteristics ofcaleosinfromHaematococcus pluvialis[J]. Acta Laser Biology Sinica, 2020, 29(6): 529-537.
[10]李传宝. 蓖麻Caleosin基因的克隆及功能验证[D]. 晋中: 山西农业大学, 2016.
LI Chuanbao. Cloning and function analysis ofCaleosingene fromRicinus communis[D]. Jinzhong: Shanxi Agricultural University, 2016.
[11]丁勇, 陈庆波, 徐春雷, 等. 油菜油体钙蛋白基因BnClo1的克隆和表达[J]. 作物学报, 2008,34(11): 1921-1928.
DING Yong, CHENG Qingbo, XU Chunlei,et al. Cloning and expression ofBnClo1gene fromBrassica napus[J]. Acta Agronomica Sinica, 2008, 34(11): 1921-1928.
[12]JAMME F, VINDIGNI J D, MECHIN V,et al. Single cell synchrotron FT-IR microspectroscopy reveals a link between neutral lipid and storage carbohydrate fluxes inS. cerevisiae[J]. PLoS One, 2013, 8(9): e74421.
[13]孟家松, 张夏燕, 方紫雯, 等. 芍药油体钙蛋白基因PlClo克隆及表达分析[J]. 植物生理学报, 2019, 55(3): 274-280.
MENG Jiasong, ZHANG Xiayan, FANG Ziwen,et al. Cloning and expression analysis of herbaceous peonycaleosingenePlClo[J]. Plant Physiology Journal, 2019, 55(3): 274-280.
[14]魏征, 马红, 葛晓春. 水稻油体钙蛋白家族的进化及对干旱胁迫的响应性分析[J]. 科学通报, 2011, 56(20): 1612-1621.
WEI Zheng, MA Hong, GE Xiaochun. Phylogenetic analysis and drought-responsive expression of the ricecaleosingene family[J]. Chinese Science Bulletin, 2011, 56(20): 1612-1621.
[15]SHEN Y, XIE J, LIU R D,et al. Genomic analysis and expression investigation ofcaleosingene family inArabidopsis[J]. Biochemical and Biophysical Research Communications, 2014, 448(4): 365-371.
[16]MOSBLECH A, FEUSSNER I, HEILMANN I. Oxylipins: structurally diverse metabolites from fatty acid oxidation[J]. Plant Physiology and Biochemistry, 2008, 47(6): 511-517.
[17]向兰舟, 胡娅晴, 谢涵, 等. 拟南芥油体钙蛋白基因CALEOSIN 3对胁迫环境及ABA诱导的响应[J/OL]. 分子植物育种: 1-12[2021-10-20]. http://kns.cnki.net/kcms/detail/46.1068.S.20210122.1218.004.html.
XIANG Lanzhou, HU Yaqing, XIE Han,et al. Response ofArabidopsisoil body protein geneCALEOSIN 3to stress environment and ABA induction[J/OL]. Molecular Plant Breeding: 1-12[2021-10-20]. http://kns.cnki.net/kcms/detail/46.1068.S.20210122.1218.004.html.
[18]KHALIL H B, BRUNETTI S C, PHAM U M,et al. Characterization of thecaleosingene family in the triticeae[J]. BMC Genomics, 2014, 15(1): 239-239.
[19]MARINE F, SABINE D, CELINE B,et al. Heterologous expression ofAtClo1, a plant oil body protein, induces lipid accumulation in yeast[J]. FEMS Yeast Research, 2009, 9(3): 428-438.
[20]CHEN J C F, TSAI C C Y, TZEN J T C. Cloning and secondary structure analysis of caleosin, a unique calcium-biding protein in oil bodies of plant seeds[J]. Plant & Cell Physiology, 1999, 40(10): 1079-1086.
[21]FRANDSEN G I, MUNDY J, TZEN J T C. Oil bodies and their associated proteins, oleosin and caleosin[J]. Physiologia Plantarum, 2001, 112(3): 301-307.
[22]NAESTED H, FRANDSEN G, JAUH G Y,et al. Caleosins: Ca2+-binding proteins associated with lipid bodies[J]. Plant Molecular Biology, 2000, 44(4): 463-476.
[23]周雅莉, 安茜, 任文燕, 等. 紫苏PfPDAT1基因序列及表达特性分析[J]. 山西农业大学学报 (自然科学版), 2018, 38(12): 44-49.
ZHOU Yali, AN Xi, REN Wenyan,et al. Analysis ofPfPDAT1gene sequence and expression characteristics inPerilla frutescens[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2018, 38(12): 44-49.
