双酚A 对小黄鱼幼鱼的急性毒性
2022-05-19魏福亮谢庆平
魏福亮,谢庆平,蔚 敏,詹 炜,刘 峰,楼 宝
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江省农业科学院水生生物研究所,浙江杭州 310021)
环境内分泌干扰物(environmental endocrine disrupting chemicals,EDCs)是一类影响生物内源激素正常合成和代谢,进而影响生物内环境稳态、生殖发育等正常生理活动的一类外源性化学物质[1]。EDCs 种类包括类雌激素物质、有机氯农药和重金属等[2]。BPA 是研究频率最高的EDCs 之一,具有良好的耐热性和可塑性,被广泛应用于高分子材料的生产,如塑料水桶、水杯和食品罐内壁涂料等[3],其结构与合成雌激素己烯雌酚相似[4],具有雌激素活性[5],BPA 可通过工业废水直接排放进水体[6],也可通过其制品残余物和垃圾渗滤液等间接进入空气、土壤中[7],通过参与物质循环分散到自然环境当中。在世界范围内的多个国家均有研究报告水体环境监测到BPA,浓度从0.05 μg·L-1至12 μg·L-1[8-11],我国近岸检测到的BPA 浓度最高达到1.4 μg·L-1[12]。BPA 能由食物链进入生物体内并与雌激素受体(ER)相互作用,干扰正常激素在机体内的产生、释放、运输、代谢等作用,从而影响生物的生殖、神经、免疫神经系统等功能[13-14],也可通过阻碍激素与受体结合,进而阻断激素信号传递引起功能丧失[15]。已有研究结果表明,BPA 摄入会导致男性精子数量降低,提高内分泌异常相关疾病(女性青春期提前等)[16]、肥胖[17]和癌症的发病率[18],在母体中积累会导致早产,提高胎儿畸形率[19]。在鱼类中,对BPA 的研究主要集中在对鱼类的毒性致死作用和对鱼类生殖系统的破坏性[20]。已有BPA 的急性毒性实验报道,BPA 对体长3.0±0.5 cm 的斑马鱼Danio rerio 96 h 急性毒性暴露的半致死浓度为6.3 mg·L-1[21];对大西洋银汉鱼Menidia menidia 的96 h 急性毒性半致死浓度为9.4 mg·L-1[22]。另一方面,低浓度BPA 长期浸浴导致雄性斑马鱼性腺成熟度以及成熟精子数显著下降[23],雌性斑马鱼的产卵量显著下降,且子代畸形率升高[24];同样,也会导致雌性鲤鱼Cyprinus carpio 闭锁卵泡数增多,雄性鲤鱼精巢小叶结构减少[25];对比目鱼Paralichthys olivaceus 用100 μg·kg-1含有BPA 的饲料投喂,会诱导群体出现雌性化[26]。
小黄鱼Larimichthys polyactis,又名小鲜、黄花鱼等,隶属于鲈形目Perciformes,石首鱼科Sciaenidae,黄鱼属Larimichthys,是我国“四大海产”之一[27],小黄鱼全人工繁养殖技术[28-29]的成功为保护小黄鱼种质资源,研究各种因素对小黄鱼的影响机制提供了保障。已有研究表明,小黄鱼在孵化后43~80 d 期间,雄性性腺中会先出现卵母细胞,而后凋亡退化,这一特殊的性腺发育模式被认为主要受遗传因素影响,但不能完全排除环境因素参与影响的可能[30]。在小黄鱼性别分化起始之前,通过长时期暴露外源17β-雌二醇(17βestradiol,E2,一种天然的雌激素),雄性主要表现为精巢发育受阻,卵母细胞未能出现数量上的增加。证明外源E2 并不是导致小黄鱼雄性雌雄同体阶段产生的原因[31]。另一方面,调查显示BPA 是我国沿海含量最高的环境内分泌干扰物,在我国近海沿岸海域浓度可达到1.4 μg·L-1[12],其环境中的含量远高于E2。因此,研究BPA 对小黄鱼生长和性腺发育的影响,对解释其特殊性腺发育模式的产生原因,保护小黄鱼野生资源具有重要意义。
由于BPA 对生物具有毒性作用,因此在进行相关研究时需要首先明确BPA 对研究对象的半致死浓度和安全浓度。本研究通过对孵化后25 d 的小黄鱼进行96 h 急性毒性实验,得到BPA 对小黄鱼的半致死浓度和安全浓度,对后续的相关研究提供了理论基础。
1 材料与方法
1.1 实验动物
实验所用代小黄鱼是浙江省农业科学院水生生物研究所象山港湾水产苗种有限公司养殖基地2021年繁殖培育的F7 代苗种,孵化后,养殖条件为水温17~20 ℃,盐度22~25,自然光照周期,孵化后4~15 d分别投喂轮虫和小球藻,孵化后12~22 d 投喂卤虫无节幼体,第16 d 开始使用商业饲料投喂驯化,至孵化后22 d 左右完成颗粒饲料驯化,每日投喂3 次。小黄鱼养至孵化后25 d 用于实验。实验鱼提前8 h 停止投喂,并转入总容积1 000 L 的表面光滑的蓝色玻璃钢水桶,实验开始后第48 h 投喂少量卤虫。动物实验按照浙江省农业科学院实验动物管理和使用委员会批准的《实验动物管理与使用指南》的规定进行。
1.2 实验用水中BPA 浓度的检测
为探明本研究实验用养殖水体BPA 水平,在BPA 浸浴实验前,从实验桶中随机抽取3 个样本的砂滤海水,各50 mL,分别标记为A、B、C,置于-20 ℃条件下保存备用。
采用液质联用法对实验用水中的BPA 浓度进行检测。实验方法如下:(1)称取BPA 固体,用含0.1%甲酸的甲醇配制为2 mg·mL-1的母液备用。用甲醇将BPA 母液稀释为2.0 μg·L-1浓度的标准溶液。(2)取水样加入0.1%氨水/甲醇溶液高速离心取上清。(3)液相色谱进样,质谱检测,完成数据采集。
1.3 BPA 浸浴急性毒性实验
在0~5 mg·L-1之间设计浓度梯度0、0.1、0.5、1.0、2.5、3.0、3.3、3.5、3.8、4.0、4.5、5.0 mg·L-1以及无水乙醇对照组(Control)各1 桶,对孵化后25 d 的小黄鱼进行急性毒性浸浴实验。实验进行时实验桶水量为500 L,水温17~20 ℃,盐度22~25,溶氧量8.5~10.5 mg·L-1,pH=8.05±0.05,持续曝气,在自然光照周期下浸浴96 h。根据所设浸浴浓度梯度,配制工作液,准确称量BPA 固体(Sigma,德国,CAS:80-05-7,≥97%),以无水乙醇为溶剂配制工作液(表1)。

表1 BPA 工作液的配制方法Tab.1 Preparation method of BPA working fluid
各浸浴浓度梯度组实验同时进行,每桶小黄鱼178~335 尾,提前8 h 从表面光滑的水泥池转移到蓝色玻璃钢水桶中并停止投喂,各浸浴组及Control 组分别加入10 mL 工作液,0 mg·L-1组不做处理,96 h 浸浴过程中不换水,由于实验浓度梯度较为密集,因此未设置平行对照,且因为实验鱼较小,为避免其因饥饿死亡,在实验进行至48 h 时适量投喂卤虫。
1.4 存活率统计
因小黄鱼对光线刺激敏感,使用光线刺激即可判断,所以未采用针刺法[32]。用强光照射后10 s 内无反应,即判定为死亡。实验过程中,每隔2 h 观察记录实验鱼是否出现身体不平衡、游动缓慢等中毒症状、并记录死亡数量及时捞出死鱼。实验结束后,清点每组小黄鱼剩余量,计算每组小黄鱼总量。最后通过死亡数量和存活数量计算出存活率。
1.5 数据分析
数据使用SPSS 23.0 统计软件中文版处理。建立样本总数、浸浴浓度和存活率3 个变量,选择分析-回归-概率,分别计算并获得24 h、48 h、72 h 和96 h 半致死浓度(LC50),并根据以下经验公式计算安全浓度。

式中:SC 为安全浓度(safe concentration),mg·L-1;LC50为半致死浓度,mg·L-1。
2 实验结果
2.1 液质联用法检测实验用水中的BPA 水平
通过液质联用方法定量检测A、B、C 3 个水样的总离子流图结果显示,标准品的峰值在3.31 min 出现(图1A),样品A 的峰值出现在4.45 min(图1B),样品B 的峰值出现在4.44 min(图1C),样品C 的峰值出现在4.41 min(图1D)。检测样本峰值出现时间与标准品峰值出现时间差别显著,而各标准品之间峰值出现时间接近。结果表明实验进行时所用海水未检测出BPA。
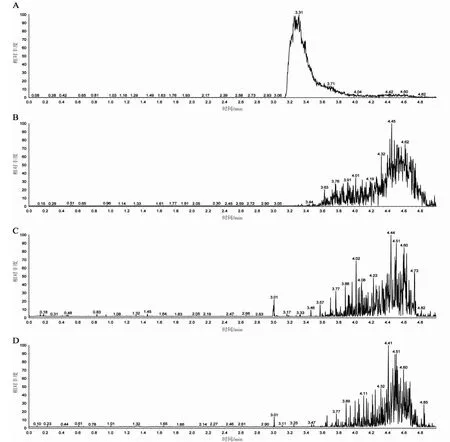
图1 标准样和实验用水样中BPA 的总离子流图谱Fig.1 Total ion current spectrum of BPA in standard and experimental water samples
2.2 中毒症状
为避免潜在应激作用的影响,实验鱼提前8 h 移入实验桶中适应环境。各实验组在加入BPA 工作液时,实验鱼立即出现反应,表现为迅速游向桶壁,做无规则游动,浸浴浓度越高,反应越强烈。此现象持续5 min 左右。0 mg·L-1组正常游动无异常,无水乙醇组有轻微应激反应,持续时间非常短。濒临死亡的小黄鱼行动迟缓,用强光刺激后反应迟钝,身体出现变形,泳姿为倾斜状,泄殖孔处有白色丝状异物,死后身体形态扭曲,一般沉入桶底或浮于桶壁周围。
2.3 急性毒性特征分析
统计不同浸浴浓度在24、48、72 和96 h 的存活率,实验结果表明,0 mg·L-1和Control 组出现个别死亡,且死亡状态与中毒症状不符。在对实验中24、48、72 和96 h 小黄鱼存活率的计算后发现,浸浴24 h后,0~4.0 mg·L-1浓度范围内,小黄鱼的存活率都在90%以上,而4.5 mg·L-1浓度组和5.0 mg·L-1浓度组的存活率出现了明显的下降,分别下降到69.26%和14.03%;浸浴48 h 后,0~3.3 mg·L-1浓度范围内的存活率依然在90%以上,3.5~5.0 mg·L-1浓度范围内存活率出现了明显下降,5.0 mg·L-1浓度组的小黄鱼全部死亡;浸浴至72 h 和96 h 的结果相似,即0~2.5 mg·L-1范围内,小黄鱼存活率处于较高水平,即使最低存活率也高达96.73%,3.00 mg·L-1时迅速由2.5 mg·L-1的98.04%下降到81.25%,之后随浸浴浓度升高,小黄鱼存活率下降,浓度达到5.0 mg·L-1时,小黄鱼全部死亡(表2)。
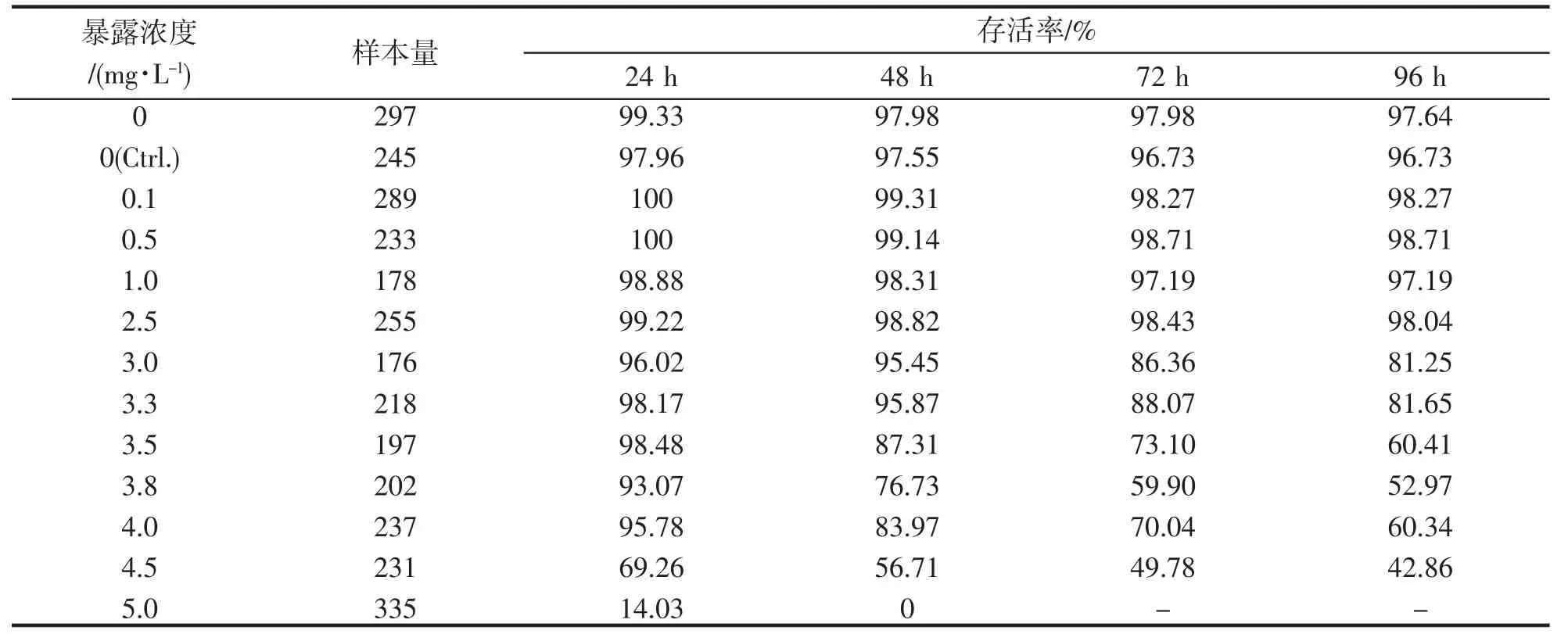
表2 小黄鱼在不同浓度BPA 中各时间段的存活率Tab.2 Survival rate of L.polyactis exposure to different concentrations of BPA at each time point
对小黄鱼96 h 不同浓度的BPA 浸浴存活率进行分析,结果表明,小黄鱼的存活率随浸浴浓度的升高大致可分为2 个阶段,即0~2.5 mg·L-1浓度范围的缓慢变化阶段和2.5~3.0 mg·L-1浓度范围的快速下降阶段(图2)。
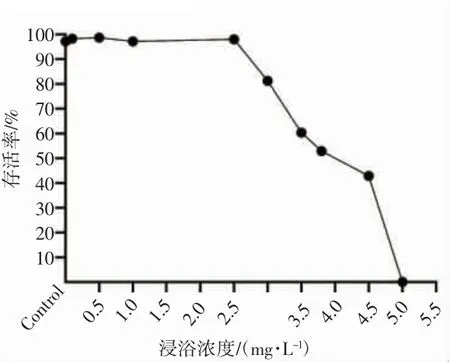
图2 不同浓度BPA 暴露96 h 后小黄鱼的存活率曲线Fig.2 Survival rate curve of L.polyactis exposure to different concentrations of BPA after 96 h
因此以2.5 mg·L-1为界限,分别对0~2.5 mg·L-1和2.5~5.0 mg·L-1范围存活率进行分析。2.5 mg·L-1以内,存活率高,且折线分布于0 mg·L-1组两侧,下降趋势较缓(图3A),当暴露浓度大于2.5 mg·L-1时,存活率下降趋势随浓度的提高而增加,且浓度在4.5 mg·L-1时存活率又出现了更加明显的下降(图3B),即浓度越高,存活率下降趋势越明显。

图3 不同浓度BPA 在各时间段对小黄鱼存活率的影响Fig.3 Effects of different concentrations of BPA exposure at each time point on the survival rate of L.polyactis
2.4 半致死浓度和安全浓度
根据表1 所统计的存活率,使用SPSS 23.0 软件进行概率分析,分别得到24、48、72 和96 h 的半致死浓度为4.68、4.29、4.09 和3.94 mg·L-1,并通过经验公式算得安全浓度为1.08 mg·L-1(表3),随实验时间增加,半致死浓度降低,说明BPA 毒性在小黄鱼体内有蓄积作用,且随暴露浓度升高,蓄积作用越明显。
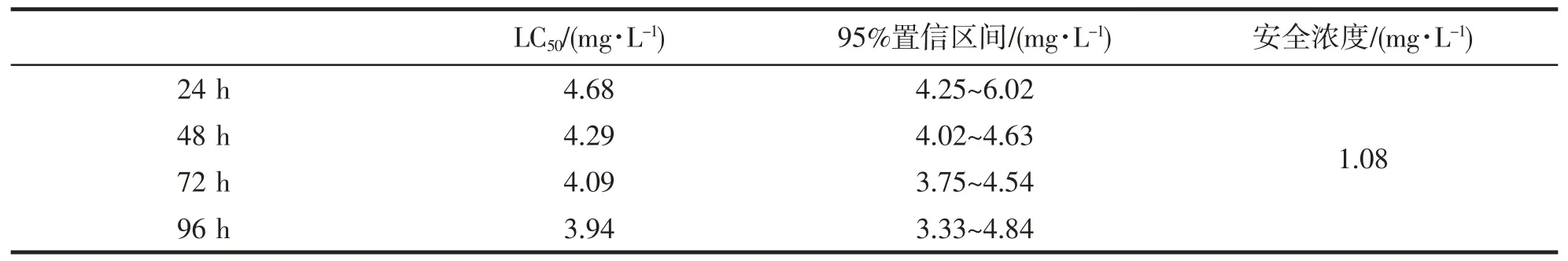
表3 小黄鱼BPA 暴露的半致死浓度和安全浓度Tab.3 The semi-lethal concentration and safe concentration of BPA exposure in L.polyactis
小黄鱼作用的安全浓度与对小黄鱼存活率的分析结果一致,而在2.5 mg·L-1浓度组小黄鱼的存活率依然高达98.04%,说明在此范围内,虽然已经超出安全浓度,但此范围的毒性蓄积作用并不明显,而此后存活率大幅度下降,表明此后的毒性蓄积作用增强,对小黄鱼的毒性作用更加明显,因此BPA 的毒性与浓度为非直线关系[33]。
3 讨论
3.1 BPA 对生物的影响
本实验对0~5.0 mg·L-1浓度范围内BPA 对小黄鱼存活率的影响做了详细研究,统计了不同浓度BPA暴露后,小黄鱼在不同时间段的存活率,通过SPSS 23.0 数据软件的分析和公式计算,我们获得了各时间段的半致死浓度以及安全浓度,结果表明,对孵化后25 d 的小黄鱼,BPA 的安全浓度为1.08 mg·L-1,说明在2.5 mg·L-1浓度范围以内,小黄鱼对BPA 的具有高度的耐受性。
随着工业的发展和塑料制品的广泛应用,BPA 污染分布范围遍布环境各个角落。理论上,BPA 的生物半衰期约为6 h,可以通过尿液排出体外,但仍然会有一部分BPA 会积累在组织当中[34]。由于其广泛的分布,且具有化学毒性,因此会对各种生物产生不同程度的影响。人类耐受的BPA 的安全剂量为≤50 μg·(kg·d)-1[35]。学龄前儿童对BPA 的耐受力相对成年人要低,因此学龄前耐受的安全剂量为0.24~0.41 ng·(kg·d)-1[36]。欧洲和美国食品、药物管理局认为目前环境中BPA 的暴露并不能对人体产生损害[35]。但是部分科学家却认为,环境中的BPA 水平可能足以危害人类健康,且由于胎儿各项生理机能并未成熟,因此即使是微量的BPA 接触,也可能对胎儿产生不良影响[37];0.1 mg·L-1浓度BPA 处理72 h 后会影响5 龄第4 天家蚕无核精子束的形成及精子束的浓缩成熟[38];通过对SD 大鼠Sprague-Dawley,用于药理、毒理、药效及GLP 实验的一个大鼠品系进行BPA 灌胃发现,BPA 会影响大鼠机体的免疫功能[39];使用12.5、25 和50 mg·(kg·d)-1的BPA 对雌性CD-1 小鼠进行腹腔注射后,结果显示高浓度的BPA 会抑制卵泡的发育[40];BPA 浓度达到0.79 mg·L-1会对河蚬Corbicula fluminea 产生氧化损伤[41];在对金鱼Carassius auratus 的研究中发现,0.05和0.5 mg·L-1浓度的BPA 浸浴30 d 后,金鱼精巢发育受到阻碍,且停止暴露后,精巢仍无法继续发育成熟[20];0.02 mg·L-1浓度的BPA 暴露3 周后会改变雄性和雌性斑马鱼的内分泌大麻素系统(ECS),从而改变性腺功能[42];从出生开始分别使用0.375 和1.5 mg·L-1的BPA 暴露斑马鱼至性成熟,会导致斑马鱼性腺组织形态结构改变,交配行为障碍,雌性产卵量下降[43];分别使用5.4、6.0、6.8、7.6、8.0 mg·L-1的BPA 处理斑马鱼96 h,会导致雄性斑马鱼精巢结构损伤,雌性斑马鱼卵泡严重萎缩[44]。
目前对双酚A 暴露的研究主要集中在生殖毒性方面。在对小黄鱼的研究过程中发现,小黄鱼雄性精巢在发育过程中会经历特殊的雌雄同体阶段[30],BPA 又是我国沿海含量最高的环境内分泌干扰物,因此研究BPA 对小黄鱼的影响对此特殊阶段产生原因的解析有重要意义。
3.2 BPA 毒性特点
本研究结果显示,BPA 对小黄鱼的致死作用并不是随浓度增加而单纯的呈直线增强,而是会经历不同的毒性强度阶段,随时间的推移和暴露浓度的增加,BPA 在小黄鱼体内的蓄积作用越来越明显。这与BPA 毒性作用曲线呈“U 型”的结论相似[45]。
而且在研究中发现,BPA 的毒性出现了比较明显的分段。首先,实验各时间段半致死浓度比较结果为24 h LC50>48 h LC50>72 h LC50>96 h LC50,说明随时间的推移,BPA 在小黄鱼体内的毒性蓄积作用愈发明显,当BPA 含量超出小黄鱼耐受范围时,小黄鱼存活率出现快速下降。通过计算,其安全浓度为1.08 mg·L-1,而0~2.5 mg·L-1浓度范围的存活率普遍较高,说明在1.08~2.5 mg·L-1范围内,虽然已超出安全浓度,但其毒性仍较低,原因可能是在此范围内,BPA 的蓄积作用仍在小黄鱼正常代谢调控限度之内,小黄鱼可以通过自身代谢来降低BPA 造成的损伤,因此这时小黄鱼的存活率仍然较高。而浓度达到3.0 mg·L-1时,存活率出现了明显的下降,此时的浓度跨度为0.5 mg·L-1,远低于安全浓度与2.5 mg·L-1之间的跨度,说明此时BPA 的蓄积作用显著,导致毒性作用快速增强。本研究实验结果及计算分析表明,小黄鱼BPA 暴露96 h 半致死浓度为3.94 mg·L-1,与其他水生生物略有差异,例如BPA 对黑斑蛙Pelophylax nigromaculatus 胚胎的半致死浓度为7.68 mg·L-1,对黑斑蛙蝌蚪的半致死浓度为9.00 mg·L-1[46];对体长3.0±0.5 cm 的斑马鱼的96 h 急性毒性暴露的半致死浓度为6.3 mg·L-1[21];对大西洋银汉鱼的96 h 急性毒性暴露的半致死浓度为9.4 mg·L-1[22]。
综上所述,高浓度的BPA 对孵化后25 d 的小黄鱼具有急性毒性作用,当暴露浓度大于2.5 mg·L-1时BPA 在小黄鱼体内蓄积作用增强,致死作用显著,并随暴露时间延长和暴露浓度提高而增强。结果显示,与其他物种相比,小黄鱼对BPA 的耐受力较弱,因此BPA 更容易对小黄鱼的生长生殖等生理活动产生影响。本研究确定了BPA 对小黄鱼的半致死浓度和安全浓度,为接下来研究BPA 对小黄鱼性腺发育的影响提供数据基础,丰富了BPA 对海洋生物毒性作用的研究结果,为研究BPA 对其他生物的毒性作用提供参考。
