基于苏打水中碳酸氢钠定量测定的中学化学实验研究*
2022-05-17王建坤马怀蕊杨春香杨艳华王宝玲李艳妮黄素芳王颖臻
王建坤,马怀蕊,杨春香,杨艳华**,王宝玲,李艳妮,黄素芳,王颖臻
(1.昆明学院 化学化工学院,云南 昆明 650214;2.迪庆藏族自治州民族中学,云南 迪庆 674400)
“中学化学教材分析与教学设计”是面向化学专业教师教育方向学生开设的一门教师教育发展方向课,是一门研究中学化学教材知识内容、结构体系、知识间相互联系,以及教材与教学关系的一门理论与实践紧密联系的课程。其对培养师范生具备较强的化学教学能力、化学实验教学能力、化学教学研究和综合实践能力有明显提升作用。其中,实验探究是一种科学实践活动,是培养学生化学学科核心素养中“科学探究与创新意识”的构成要素[1]。
在课程教学中发现,CO2性质和制备实验贯穿于整个义务教育和高中一年级阶段,在实验探究教学中,教学人员都是基于CO2在生活中的实际应用进行实验设计的。例如:探究啤酒、可乐和雪碧等饮品中CO2的含量测定[2-5]。实验过程主要为:第一步,用草酸溶液或邻苯二甲酸氢钾溶液对配制的NaOH溶液进行标定;第二步,使用标定的NaOH溶液标定HCl溶液;第三步,取出一定量的啤酒、可乐或雪碧,与过量的NaOH溶液反应,全部生成Na2CO3;第四步,用标定的HCl溶液标定Na2CO3溶液,生成NaHCO3;第五步,继续用HCl标定溶液标定NaHCO3溶液。除第三步不使用酸碱指示剂外,第一、二、四步均使用酚酞作指示剂,第五步使用甲基橙作指示剂,根据第四、五步指示剂颜色变化时使用的已标定HCl溶液的体积,计算出啤酒、可乐和雪碧中CO2的含量。
这样的探究实验,不仅是重视开展“素养为本”的教学体现,同时也利于培养学生合作意识,达到树立研究性学习习惯的目的。但是,以上探究实验存在耗时较长、标定溶液实验操作重复、酸碱指示剂都需要使用,并且以小组形式完成实验不能有效提升学生独立操作能力,在中学教学中实际可行性不强等问题。因此,我们以高中必修第一册中NaHCO3的性质为基础,测定市售苏打水中NaHCO3的含量,开展探究式教学。虽然已有教学人员利用苏打水中的NaHCO3开展探究式教学的报道,但其工作仅定性验证了NaHCO3的存在,没有进行较为完整的定量实验探究[6]。因此,我们以一款市售苏打水为例,测定其NaHCO3的含量,将研究性学习和探究式教学相结合,更好地培养学生“科学探究与创新意识”的学科核心素养。
实验基本原理及步骤为:首先,用Na2CO3溶液标定HCl溶液;然后,用标定的HCl溶液标定苏打水。两个标定实验都使用甲基橙作指示剂,根据甲基橙颜色变化时使用的已标定的HCl溶液体积,计算苏打水中NaHCO3的含量。这样开展实验教学,一方面培养学生创新精神和实践能力,另一方面也使探究实验内容更加贴近于中学化学实际教学。
1 实验原理
HCl与NaHCO3发生复分解反应,以甲基橙做指示剂,用HCl标准溶液滴定苏打水,从而测定苏打水中碳酸氢钠的含量。反应方程式如下:

测定的苏打水中NaHCO3的含量计算:
式中:CNaHCO3为待标定苏打水中NaHCO3的浓度;CHCl为HCl标准溶液的浓度;ΔVHCl为滴定后滴定管读数-滴定前滴定管读数,即滴定单位体积的苏打水时,所消耗HCl标准溶液的体积;V测定的苏打水为标定时,所取苏打水的单位体积。
市售 400 mL 苏打水中NaHCO3的质量计算:
mNaHCO3=cNaHCO3×MNaHCO3×0.4
式中:mNaHCO3为400 mL 该苏打水中NaHCO3的质量;cNaHCO3为该苏打水中NaHCO3的物质的量浓度;MNaHCO3为NaHCO3的相对分子质量;0.4为换算系数,因所测苏打水体积为 0.4 L。
其中,HCl标准溶液的浓度由Na2CO3溶液标定得出,反应方程式为:

标定的HCl标准溶液的浓度为:
式中,CHCl为待标定的HCl标准溶液浓度;2为根据反应方程式,从Na2CO3到HCl的换算系数;CNa2CO3为标定HCl标准溶液时,所取用的Na2CO3溶液的浓度;VNa2CO3为标定HCl标准溶液时,所取用的单位Na2CO3溶液体积;V消耗的HCl为滴定单位体积的Na2CO3溶液时,所消耗的HCl标准溶液的体积。
2 素养目标
1)科学探究与创新意识:练习多种中学化学常见实验仪器的使用,掌握酸碱滴定分析方法和相关实验现象,学会运用身边物质进行科学探索,体会化学研究过程中的科学方法,培养学生分析问题、解决问题的能力。
2)变化观念与平衡思想:根据滴定过程中指示剂颜色变化判断反应的情况,掌握反应的实质,培养学生数据处理能力。
3)科学精神与社会责任:通过对苏打水中NaHCO3含量测定的实验探究和学习,掌握高效的学习方法,建立高效学习的科学精神,培养学以致用的学科意识。
3 实验部分
3.1 仪器与药品
托盘天平(含砝码)、移液管、酸式滴定管、碱式滴定管、烧杯、量筒、玻璃棒、胶头滴管、容量瓶、锥形瓶、药匙、酒精灯、石棉网、铁架台(含蝴蝶夹)。
Na2CO3和浓盐酸等均为分析纯,400 mL 昆明宏达苏打水饮品,购于昆明学院后勤超市。蒸馏水为实验室制取,甲基橙指示剂为实验室配制。
3.2 溶液配制
3.2.1 0.1000 mol/L Na2CO3溶液
称取 5.3 g Na2CO3于 50 mL 烧杯中,加入蒸馏水溶解,用 500 mL 容量瓶定容。
3.2.2 HCl溶液
量取 4.2 mL 浓盐酸(质量分数为36%~38%)于 50 mL 烧杯中,加入蒸馏水稀释,用 500 mL 容量瓶定容。
3.3 溶液的标定
3.3.1 HCl溶液的标定
用移液管移取 10.00 mL Na2CO3溶液于锥形瓶中,加入1~2滴甲基橙指示剂,用配制的HCl溶液进行滴定。当指示剂由黄色变为橙色时,酒精灯加热锥形瓶 2 min,冷却至室温后,继续滴定至指示剂为橙色,即为终点,平行测定3次,实验数据如表1所示。

表1 标定HCl标准溶液的实验数据
3.3.2 苏打水中NaHCO3含量的测定
用碱式滴定管取 20.00 mL 瓶装苏打水于 250 mL 锥形瓶中,加入1~2滴甲基橙指示剂,用酸式滴定管中标定的HCl溶液进行滴定。当指示剂由黄色变为橙色时,酒精灯加热锥形瓶 2 min,冷却至室温后,继续滴定至指示剂为橙色,即为终点,平行测定3次,实验数据如表2所示。

表2 苏打水中NaHCO3浓度的实验数据
通过公式计算出苏打水中NaHCO3的浓度为1.90×10-3mol/L,400 mL 市售苏打水中含有约 63.85 mg NaHCO3,即 15.96 mg/100 mL。
计算出cHCl=0.1186 mol/L,此实验可由实验准备人员先期完成。
计算出使用HCl溶液的体积 ΔVHCl=0.32 mL。
整个实验流程如图1所示。
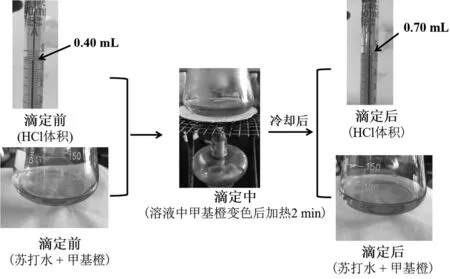
图1 苏打水中NaHCO3浓度滴定流程图
昆明宏达苏打水饮品没有标明NaHCO3的含量,相比较于已标明NaHCO3质量浓度的娃哈哈苏打水 35 mg/100 mL、农夫山泉苏打水天然水饮品白桃风味 20 mg/100 mL,实验测定值偏小,而比农夫山泉苏打水天然水饮品柠檬风味 10 mg/100 mL,实验测定值偏大。主要原因分析如下:首先,NaHCO3浓度的标定没有按照国家标准中的溴甲酚绿-甲基红指示液(pH变色范围为5.0~5.2)[7],而是使用甲基橙作指示剂(pH变色范围为3.1~4.4),因为中学化学要求学生掌握的指示剂只有酚酞(碱滴定酸)、甲基橙(酸滴定碱)和石蕊3种,甲基橙比溴甲酚绿-甲基红的酸性强,标定的盐酸溶液浓度偏低。其次,实验过程中使用的仪器都为中学化学常用仪器,比如托盘天平(含砝码)精确度偏低、滴定管读数不精确等,影响了物质的标定。最后,虽然昆明宏达苏打水饮品营养成分标明了Na 5 mg/100 mL,但是钠元素含量并不能代表NaHCO3含量。因此,实验测试结果虽然有差距,但在培养学生实验操作能力和创新精神方面,依然有重要的教学意义。
4 结论
本实验耗时较短、取材源于生活,可激发学生学习兴趣、做到学以致用,不仅便于将研究性学习与探究教学应用于中学化学教学,而且也为师范生和中学教学研究人员提供了教学素材。
