圆锥绣球“粉色精灵”组培快繁技术研究
2022-05-16王红梅陈婷婷刘春风孟紫莲
王红梅, 陈婷婷, 刘春风, 孟紫莲, 高 鹏
(1.江苏农林职业技术学院, 江苏 句容 212400;2.北京林业大学生物科学与技术学院, 北京 100083)
圆锥绣球(HydrangeapaniculataSieb.et Zucc)是虎尾草科绣球属植物,落叶灌木,多生于山谷、疏林或灌丛中[1]。叶片纸质,卵形或椭圆形,长6~12 cm,对生或轮生,背脉上具毛[2];聚伞花序尖塔形,花序极大,如‘魔幻月光’品种花序纵径可达30 cm以上。花期6—10月,观赏期长,从夏季一直持续到秋季[3]。圆锥绣球品种丰富,颜色可人,多数品种初花时为白色或绿色,随着温度和光照条件等的变化,部分品种花色可变为纯白、淡粉、绿粉、红色等,因而具有极高观赏价值[4]。圆锥绣球适应范围较广,可片植、孤植和群植于庭院、公园、街道等绿地,亦可多个品种混栽更为壮观且延长了观赏期[5]。初秋季节,花干而不枯,巨大的花球剪下可作为室内的装饰点缀。此外,圆锥绣球还具有一定的药用价值,其根系可入药,用于免疫疾病的治疗,如风湿性关节炎[6];其提取物总香豆素苷对治疗慢性损伤有一定作用[7]。由于圆锥绣球花序多由无性花组成,较难采用播种方法进行繁殖,多采用无性繁殖的方法,如扦插、压条等,但繁殖率不高,而组培可以在短期内快速繁殖,获得优质苗木[8]。
目前对于圆锥绣球的组织培养报道较少,陆乙卜等[9]以野生圆锥绣球的种子为试验材料,研究了种子离体萌发的培养条件。王红梅等[10]报道了圆锥绣球‘北极熊’组培快繁体系的建立。“粉色精灵”是开花较早的圆锥绣球品种,且为少有的花色可变品种,初花白色,随着开花时间的延长、温度及光照条件的变化,可逐渐变为红色,其植株粗壮,生长旺盛,是观赏性与抗性均较好的品种。目前,“粉色精灵”组培快繁技术的研究未见相关报道[3]。本研究旨在利用茎段作为外植体,探索圆锥绣球“粉色精灵”的组培快繁技术,为利用组织培养的方法快速繁殖圆锥绣球健壮苗木提供一定的技术参考。
1 材料和方法
1.1 试验材料
外植体材料为圆锥绣球“粉色精灵”(Hydrangeapaniculata‘Pink Winky’)品种的当年生幼嫩茎段,来源于江苏农林职业技术学院农博园科研基地。于4—6月份的晴天中午,选择生长健壮、无病虫害的新生嫩梢8~10 cm,采集完后立即将其放进装水的烧杯中,以防嫩梢失水萎蔫,并及时带回实验室进行处理。
1.2 试验方法
1.2.1材料预处理
将采集来的嫩梢进行修剪,去掉叶片和叶柄,剪切成2 cm左右茎段,每段保留1~2个腋芽[3],然后将茎段放入干净的烧杯中,在洗衣液中浸泡15 min,再在流水下冲洗1.5~2 h。
1.2.2材料表面灭菌
在超净工作台内将流水冲洗好的茎段用2 g/L多菌灵和0.6 g/L链霉素的混合溶液浸泡5~12 min,之后用无菌水冲净[3],然后用消毒好的镊子每次夹取10个茎段,转入无菌空瓶,用75%酒精处理40 s,无菌水冲洗2次,再用0.1%HgCl2处理3~10 min,无菌水冲洗3次,处理时不断摇晃无菌瓶,使药剂与材料充分接触。采用双因素完全随机组合试验设计,试验因素分别为:杀菌剂2 g/L多菌灵和0.6 g/L链霉素混合溶液的处理时间(0、5.0、8.0、12.0 min),HgCl2的处理时间(3.0、5.0、7.0、10.0 min)各4个水平,共16个处理,每个处理接种20瓶,每瓶接种2个外植体,重复4次[3]。14 d后观察灭菌效果,统计污染率、褐化率和成活率。
1.2.3启动培养
在超净工作台上,对经表面灭菌的茎段两端直接接触药剂的切口稍做修剪,修剪成1 cm左右的单芽茎段,垂直接种于培养基上,接种深度以能固定住外植体茎段为宜。启动培养选用MS基本培养基,采用双因素完全随机组合试验设计对激素的种类及浓度进行试验,分别为:6-BA(0.2、0.5、1.0、2.0 mg/L)和NAA(0.1、0.15、0.2、0.5 mg/L),共16个处理,每个处理15瓶,每瓶接种2个外植体,重复4次[3]。30 d后统计生长状况并计算萌芽率。
萌芽率(%)=(萌芽外植体数/接种数)×100%。
1.2.4增殖培养
将经过启动培养30 d的组培苗截成1.5 cm左右的带芽茎段,将茎段下部可能接触到培养基的部分叶片减掉,然后将修剪好的茎段接种到增殖培养基。增殖培养选用MS基本培养基,采用双因素完全随机组合试验设计,加入不同浓度的6-BA(1.0、1.5、2.0 mg/L)和NAA(0.1、0.15、2.0 mg/L),共9个处理,每个处理20瓶,每瓶接种2个外植体,重复3次。20 d后统计生长状况并计算增殖系数。
增殖系数=总增殖芽数/原接种数[3]。
1.2.5生根培养
选用1/2 MS基本培养基,采用正交试验设计,试验因素及水平分别为6-BA(0、0.05、0.2 mg/L),IBA(0、0.1、0.5 mg/L),NAA(0.05、0.1、0.5 mg/L),共9个处理,每个处理接种40个茎段,重复3次。接种方法为:待增殖培养20 d左右,试管苗长到2 cm以上时[11],将较健壮的组培苗取出,剪掉基部愈伤组织及能接触到培养基的叶片,垂直接种于生根培养基上,每瓶接种1~2个茎段,20 d后计算生根率、平均根数和平均根长。
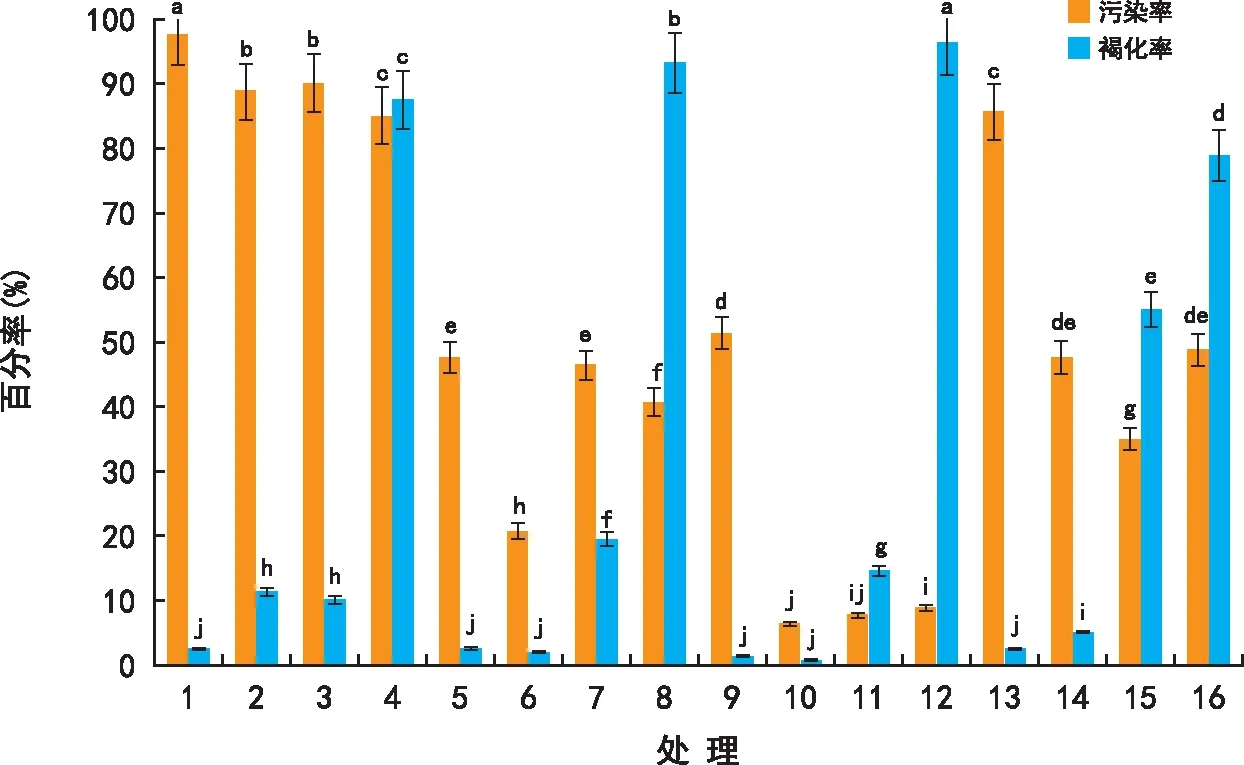
注:不同字母表示在0.05水平上差异显著。 图1 不同处理对外植体消毒效果的影响 Fig.1 Effect of different treatments on the disinfection effect of explants
1.2.6驯化与移栽
将经过生根培养30~35 d,带健壮根的组培苗在温室进行驯化,两周左右后可以看见组培苗的茎段变硬,打开瓶盖,炼苗2 d,移栽前用温水洗净组培苗根系周围的培养基,栽入由腐殖土、蛭石、珍珠岩配比好的3种基质中,共7个处理,每种处理30株。移栽后浇透水,用塑料薄膜覆盖,温度保持在25 ℃左右,空气湿度保持在80%~90%,每天上午和下午视情况喷水2次,注意通风透气,30 d后统计成活率。
1.2.7培养条件
启动和增殖培养基中蔗糖浓度为30 g/L[3],生根培养基中蔗糖浓度为20 g/L。其余条件均为:琼脂6.8 g/L,pH值5.8~6.2。121 ℃高压灭菌20~25 min,培养室中温度为(25±2)℃,光照强度保持在2 000~3 000 lx,光照时间为每天12 h[3]。
1.2.8统计分析
采用IBM SPSS STATISTIC 23.0单因素方差分析(ANOVA)、一般线性模型(单变量、多变量)进行方差分析,采用Excel 2016软件制图。
2 结果与分析
2.1 外植体的消毒效果
内源菌是导致组培过程污染率高的原因之一,因此需要借助一些杀菌剂进行杀菌。多菌灵为高效低毒内吸性杀菌剂,有内吸治疗和保护作用[12]。链霉素是一种抗生素,有一定抗菌作用。将外植体浸入2 g/L多菌灵和0.6 mg/L链霉素混合溶液中,再配合酒精与HgCl2进行表面灭菌。外植体的消毒效果见表1。
利用SPSS软件将百分数资料进行数据转换,公式为:X2=ARSIN(SQPT(X1)),其中X1为需转换的百分数(数值范围为0~1之间),X2为转换后的数据。利用转换后的数据进行方差分析和多重比较。将污染率、褐变率作图,并在图中以字母的形式标出多重比较结果。由图1可见,处理10的污染率和褐化率均最低,分别为6.25%和0.63%。此时的杀菌剂灭菌时间为8 min,HgCl2灭菌时间为5 min。当杀菌剂灭菌时间小于8 min时灭菌效果不明显,污染率高。当大于8 min时污染率又会增加。当HgCl2灭菌时间小于5 min时褐化率极低,但是污染率高,灭菌效果不明显。当HgCl2灭菌时间大于5 min时褐化率增高,外植体受伤严重。
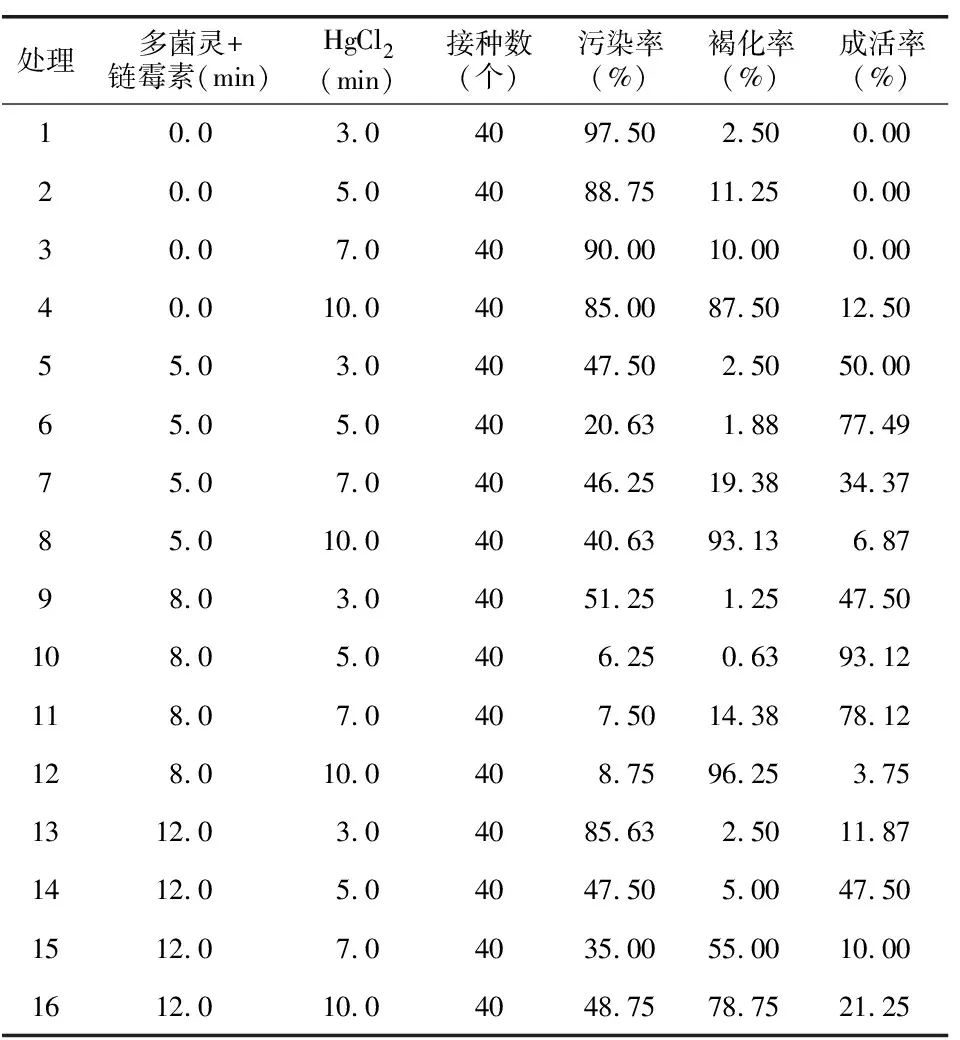
表1 外植体的表面消毒效果Table 1 Effect of surface disinfection of explants
2.2 激素种类及浓度对腋芽萌发的影响
初代培养30 d后对组培苗腋芽萌发情况做统计,统计数据及极差分析结果(见表2)。
从表2可得出,在其他因素相同的条件下,激素6-BA较NAA对腋芽的萌发影响更大,处理6,即当6-BA浓度为0.5 mg/L,NAA浓度为0.15 mg/L时萌芽率可达100%,且生长旺盛,苗的生长情况见图2 A~图2 C)。通过SPSS软件对萌芽率百分数进行平均根反正弦转换后,再进行方差分析,结果得出,6-BA浓度对腋芽诱导的影响p=0.000,小于0.05,所以处理间差异显著;NAA浓度对腋芽诱导的影响p=0.022,小于0.05,所以处理间差异显著。多重比较结果以字母的形式标注在表2各水平的平均数后,其结果得出:6-BA浓度为0.5 mg/L时与其他浓度间均存在显著差异,且该浓度萌芽率最高,说明0.5 mg/L的6-BA对芽的分化效果最好。当NAA浓度为0.5 mg/L时与其他浓度间均存在显著差异,其萌芽率低;而其他浓度间对腋芽诱导的效果差异不显著。
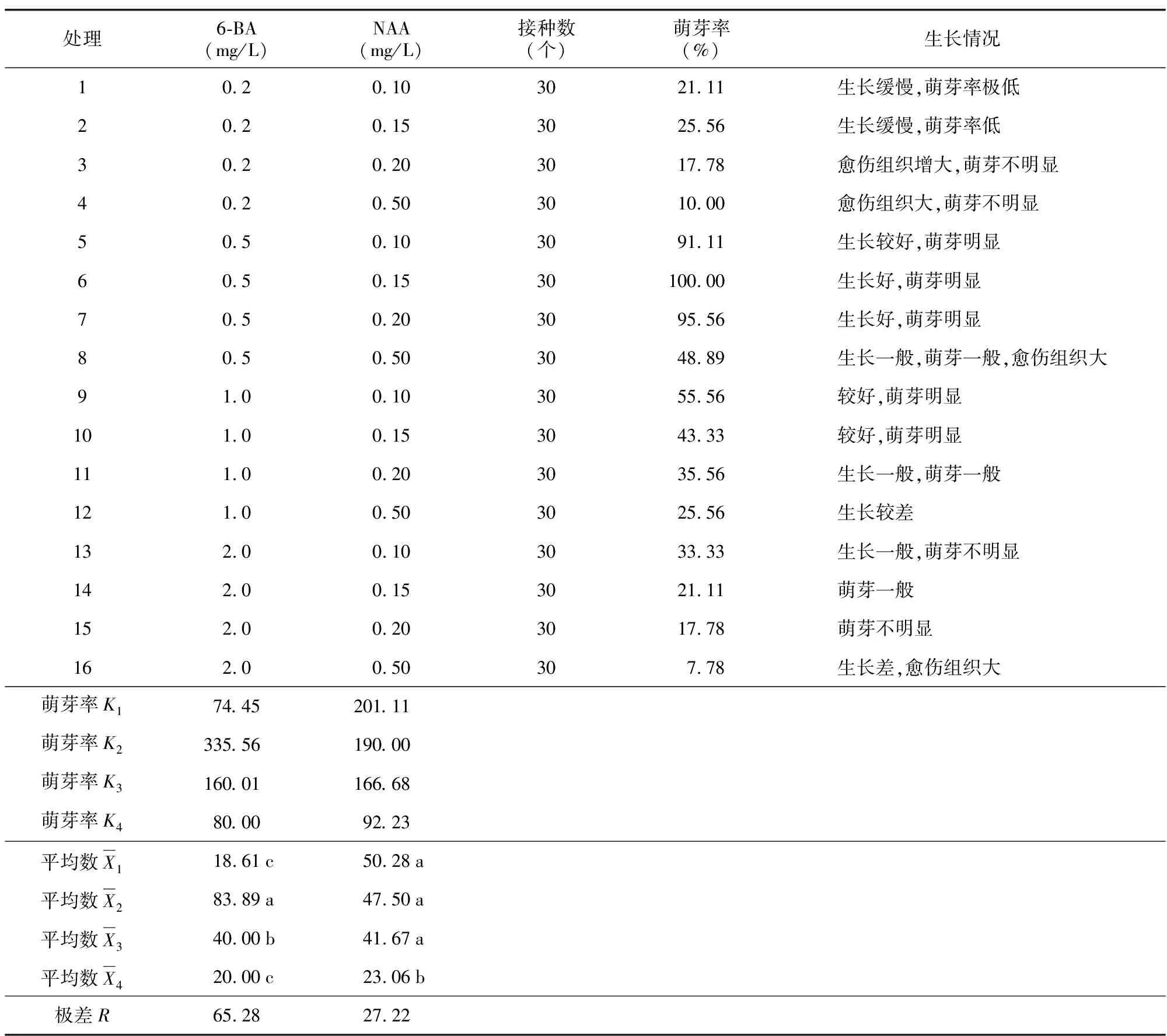
表2 不同生长激素配比对腋芽诱导的影响的极差分析Table 2 Range analysis of effect of different growth hormone ratio on axillary bud induction
2.3 不同浓度生长激素配比对增殖效果的影响
增殖培养30 d左右,对增殖效果进行记录并做极差分析,见表3。增殖系数是衡量植物分化能力的重要指标,是组培过程中需要着重研究的问题。增殖系数的大小决定了扩繁植株的数量,在组织培养试验中尤为重要。通过试验发现,当6-BA浓度为0.1 mg/L、NAA浓度为0.15 mg/L时,丛生芽最多且苗健壮,增殖系数可达7.0,苗的生长情况见图2 D。
极差分析结果显示,6-BA的第二水平与NAA的第二水平结合对不定芽增殖的效果最好。对不同浓度生长激素配比对增殖效果影响做方差分析及多重比较,结果显示,不同浓度6-BA对增殖的影响p=0.016,小于0.05,所以处理间差异显著;不同浓度NAA对增殖的影响p=0.012,小于0.05,所以处理间差异显著。多重比较结果(以字母形式标注于表3)得出:当6-BA浓度为2.0 mg/L时与其他浓度间差异显著,但增殖系数最低;而6-BA浓度为1.0 mg/L和1.5 mg/L之间差异不显著。当NAA浓度为0.5 mg/L时与其他浓度间差异显著,而NAA 0.10 mg/L和0.15 mg/L之间差异不显著。综合分析,适宜圆锥绣球“粉色精灵”增殖的培养基为:MS+6-BA(1.0~1.5)mg/L+NAA(0.10~0.15)mg/L。
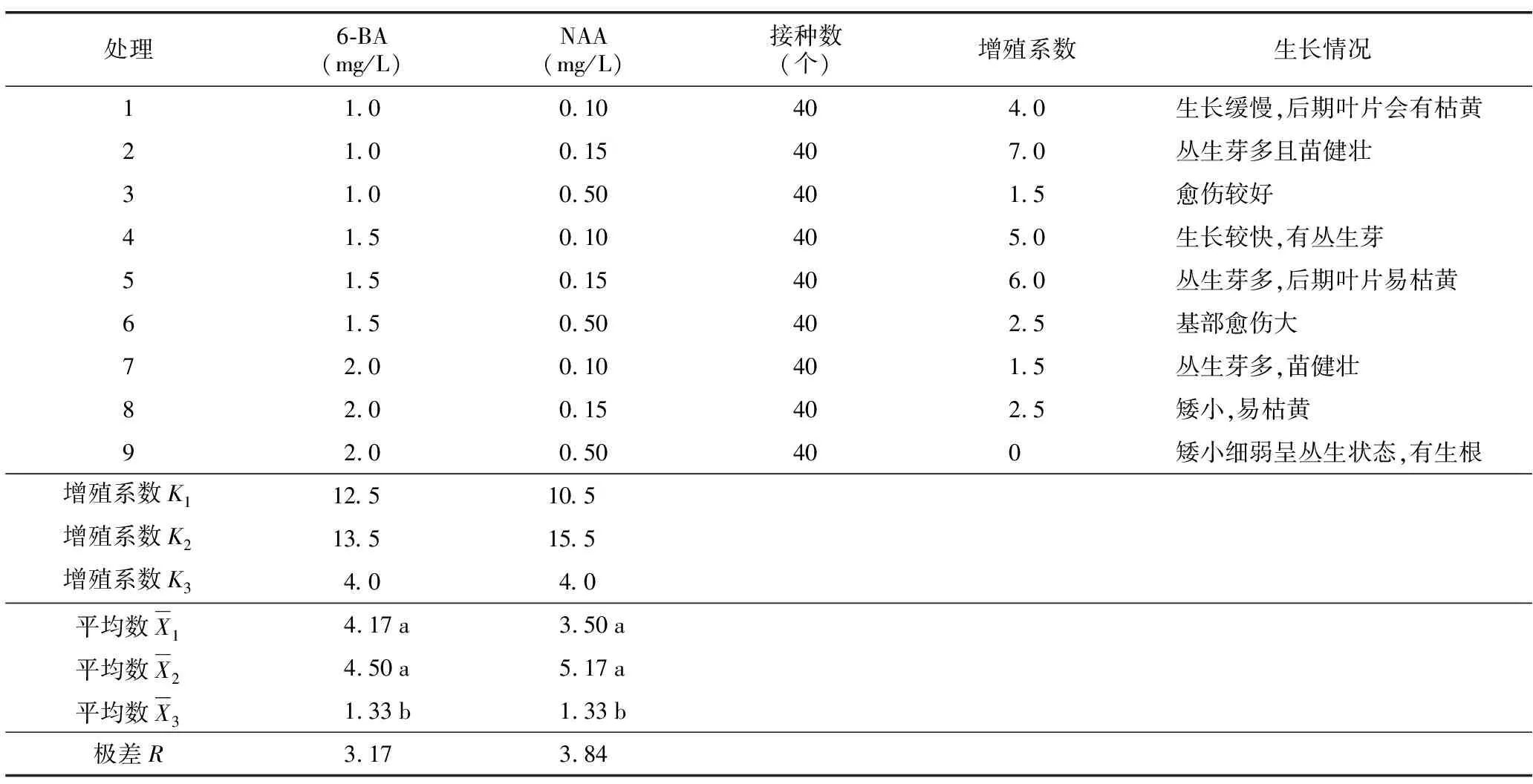
表3 不同生长激素配比对增殖效果的极差分析Table 3 Range analysis of effect of different concentrations of growth hormone on proliferation
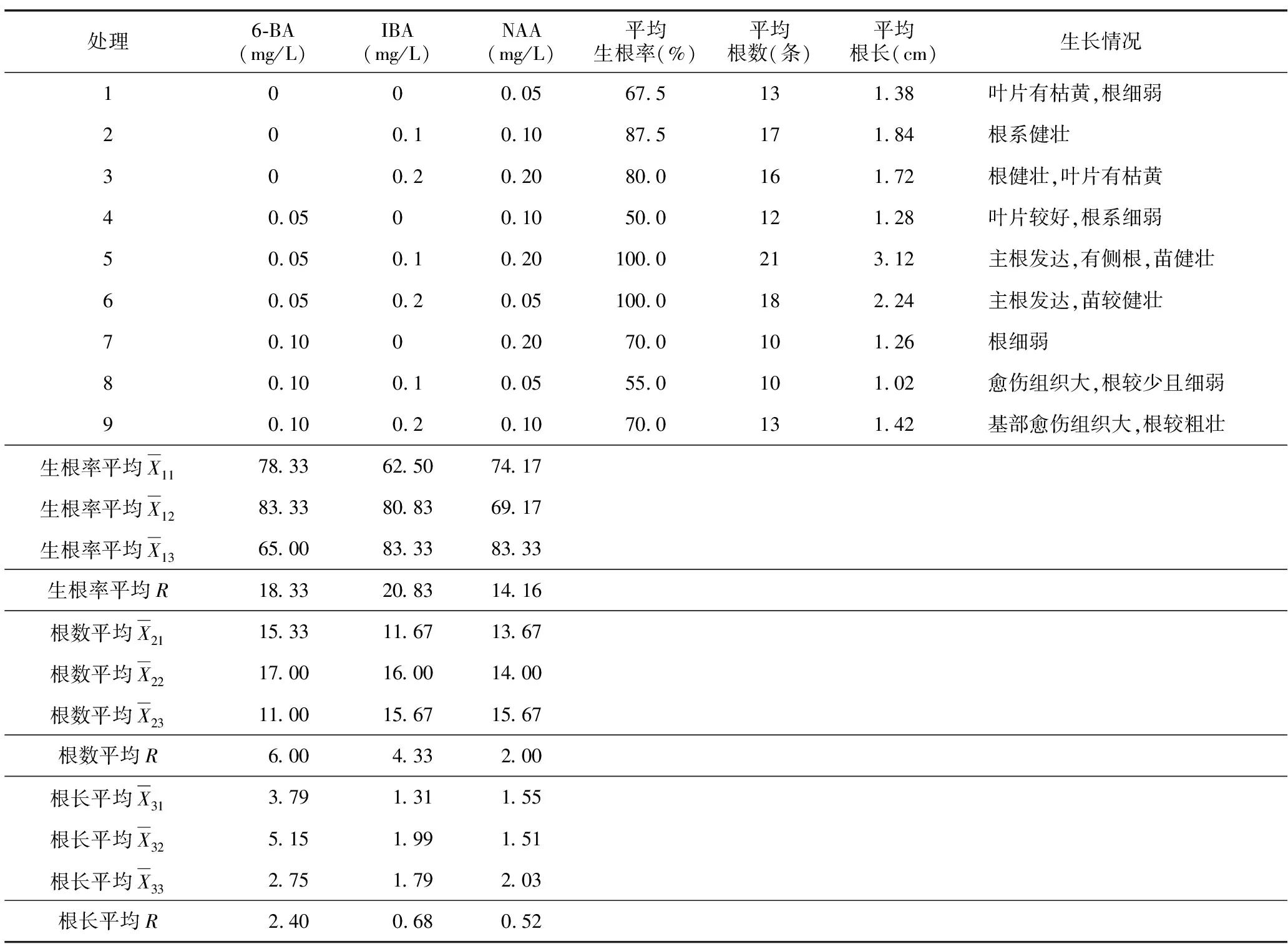
表4 不同生长激素配比对生根效果影响的极差分析Table 4 Range analysis of effect of different concentrations of growth hormone on rooting

注:A为茎段外植体腋芽萌发;B~C为初代培养苗;D为增殖培养苗;E~F为生根培养苗;G~H为移栽组培苗。 图2 圆锥绣球“粉色精灵”的组织培养Fig.2 Tissue culture of Hydrangea paniculata ‘Pink Winky’
2.4 不同浓度生长激素配比对生根效果的影响
增殖培养20 d后对生根情况进行统计,统计数据及极差分析结果见表4。
对于生根率的影响排序为:IBA>6-BA>NAA;对于根数的影响排序为:IBA>6-BA>NAA;对于根长的影响排序为:6-BA>IBA>NAA。利用SPSS软件对不同激素配比的生根效果进行方差分析及多重比较,其中生根率需进行平方根反正弦转换后再分析。方差分析结果表明,无论是生根率、平均根数还是平均根长,6-BA、IBA、NAA的各水平间的p值均大于0.05,即各水平间差异不显著。在试验所选取的激素配比范围内,圆锥绣球“粉色精灵”生根比较容易。但结合根的长势以及叶片与植株的生长情况分析,未添加6-BA的处理,植物叶片枯黄;IBA不添加时,根细弱,随着加入量增加,对根的生长有促进作用;当NAA浓度较低时,不易生根,浓度较高时,茎基部愈伤组织增大,并萌生出粗壮根系。所以由表4可知,当6-BA浓度为0.05 mg/L,IBA浓度为0.1 mg/L,NAA浓度为0.2 mg/L时,3种激素相互协作,效果最好,生根率为100%,平均根长为3.12 cm,平均根数21条,根系发达,苗健壮,见图2 E、图2 F。
2.5 不同基质体积配比对后期驯化移栽效果的影响
移栽之后统计移栽苗的成活率(见表5),对成活率数据进行方差分析及多重比较。由此可得,当基质配比为V腐殖土∶V珍珠岩=1∶1时,成活率最高为87%,见图2 G、图2 H。
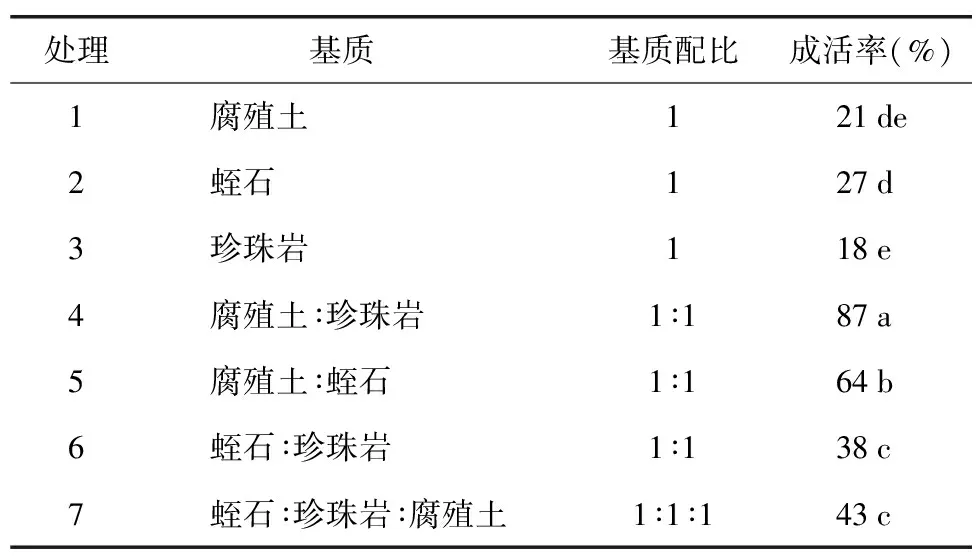
表5 不同基质体积配比对后期驯化移栽效果的影响Table 5 Effects of different volume ratio of substrate on the later domestication and transplanting
3 结论与讨论
3.1 结 论
在圆锥绣球“粉色精灵”的组培试验中,通过数据对比得出最佳的灭菌方法为:将处理好的外植体在洗衣液中浸泡15 min,流水下冲洗1.5~2 h,2 g/L多菌灵和0.6 g/L链霉素浸泡8 min左右,用无菌水冲净,将茎段放入超净工作台进行表面消毒,75%酒精浸泡1 min左右,无菌水冲洗1~2次,0.1%HgCl2浸泡5 min左右,无菌水冲洗3~5次,成活率达95%。着重解决启动培养时外植体污染率极高的问题。在初代培养过程中,当MS+6-BA 0.5 mg/L+NAA 0.15 mg/L+琼脂6.8 g/L+蔗糖30 g/L,萌芽率达100%,组培苗健壮,叶片大。在增殖培养过程中,当MS+6-BA(1.0~1.5)mg/L+NAA(0.10~0.15)mg/L+琼脂6.8 g/L+蔗糖30 g/L,增殖系数最高可达7.0,解决了增殖培养中增殖系数不高等问题。生根培养过程,培养基为1/2 MS+6-BA 0.05 mg/L+IBA 0.1 mg/L+NAA 0.1 mg/L,附加琼脂6.8 g/L,蔗糖20 g/L,生根率达100%,根长3.12 cm。在后期驯化与移栽阶段,使用V腐殖土∶V珍珠岩=1∶1,成活率可达87%。通过上述研究建立相对合适的快繁体系,降低污染率,提高繁殖率及生根率,改善组培苗生长状况,为利用组织培养的方法快速繁殖圆锥绣球苗木提供技术支持。
3.2 讨 论
植物组培试验是一个不断尝试的过程,在此过程中寻找对外植体的最佳灭菌药剂、灭菌时间、灭菌方法尤为重要,是实现组培试验的关键步骤。解决外植体污染问题是组培的首要任务。微生物是引起植物组织培养污染的重要原因[13],而其小又无处不在,所以减少培养环境中的微生物可以大大提高组培效率[14]。外植体的灭菌是组培的关键,外植体的不同生长状态,不同采集时间,表面微生物情况不同,甚至有些菌丝体已侵入组织[15],使消毒灭菌效果差异较大。单一的药剂灭菌很难达到较好的效果,利用抑菌剂或杀菌药剂对材料进行处理后,再利用酒精和HgCl2配合进行表面消毒灭菌的效果明显好于不使用杀菌剂的灭菌处理,但若杀菌剂浸泡时间超过一定临界值,灭菌效果也不明显。HgCl2浸泡时间过短,灭菌不充分,时间过长会导致外植体褐化。
在启动、增殖、生根培养过程中,寻找最合适的激素配比平衡对组培苗的生长影响显著。在启动培养过程中,细胞分裂素6-BA对芽的诱导效果显著,不过随着浓度的升高,超过临界值会有一定抑制作用,培养基中使用细胞分裂素与生长素配合,对于芽的诱导及高生长都有显著的影响。增殖培养过程中,较高的6-BA浓度会抑制芽的伸长[16],后期叶片会枯黄;NAA浓度过高会抑制苗的分化[17],使基部愈伤组织膨大。后期叶片枯黄问题可添加20~25 g/L的香蕉泥来解决,在之后的组培试验中,可继续进行相关研究。添加一定浓度NAA与IBA能促进组培苗根系数量增多和根的生长[18]。IBA和NAA协同作用时,效果远远大于其中任一种激素单独使用的效果[8]。
试管苗生长在恒温、高湿、弱光、无菌的环境条件下[19],因此,出瓶移栽前必须经历一个逐步驯化的过程。驯化时间的长短结合苗木的状况,待试管苗茎秆明显变硬后,再行移栽。驯化时间一般不能短于2周。移栽基质的种类对试管苗根系的生长影响较大,试管苗根系为不定根,根与茎的疏导组织连通性不好,移栽基质必须具有良好的疏松透气性。纯腐殖土基质透气性不好,易造成烂根;纯珍珠岩基质透气性好,但水分流失快,一旦水分不足,苗木很容易萎蔫。因此,使用腐殖质土和珍珠岩按照一定比例配合使用较好。
