钩藤再生体系优化与遗传转化条件探究
2022-05-16王晓红于晓松张明生
贾 娜, 王晓红, 李 林, 于晓松, 刘 智, 张明生
(贵州大学生命科学学院,山地植物资源保护与种质创新教育部重点实验室, 贵阳 550025)
钩藤(Uncariarhynchophylla(Miq.)Miq. ex Havil.)为茜草科(Rubiaceae)钩藤属(Uncaria)植物,常以干燥带钩茎枝入药[1],具有息风定惊,清热平肝之功效。钩藤在我国分布较广,主要生长于贵州、广西等省区,野生资源较为丰富。钩藤中的有效成分主要有生物碱类、黄酮类、有机酸类和甙类化合物,其中以生物碱含量最为丰富且为发挥药理作用的主要成分[2]。生物碱有效成分为钩藤碱、异钩藤碱、去氢钩藤碱和异去氢钩藤碱等,其中钩藤碱及异钩藤碱已被证明具有显著的降压、抗心律失常、镇静和治疗老年痴呆症等功效,同时对治疗风热头痛、头晕目眩等症具有较好的效果且副作用小[3-6]。此外,钩藤中的三萜酯类和钩藤酸类对结肠癌、肺癌、膀胱癌及乳腺癌等肿瘤细胞的增殖有抑制作用[7],因此,钩藤在医药领域具有巨大的开发潜力。
木本植物育种周期普遍较长且杂合度较高,导致其育种相关研究较其他植物进展缓慢,而随着植物组织培养及遗传转化等技术的发展,通过建立稳定高效的再生及遗传转化体系来进行基因功能验证及性状改良的研究在木本植物中逐渐增多[8-10],极大优化并加快了木本植物的育种研究进程。植物遗传转化有多种技术,其中由根癌农杆菌介导的遗传转化因具有操作简单、成本较低、周期较短及所得遗传转化植株可育等优点被广泛应用[11]。遗传转化体系成功构建的前提是具有稳定高效的组培再生体系,关于钩藤再生及遗传转化体系的研究,起初毛堂芬等[12]对基本培养基进行过探索,之后施力军等[13]以钩藤茎段为外植体探究了钩藤的分化阶段;在此基础上,吴顺等[14]以钩藤茎段,叶片及叶柄为外植体对愈伤诱导进行研究,初步建立了钩藤的再生体系。对于钩藤遗传转化体系的研究,仅吴顺等[15]以钩藤的叶片、茎段及叶柄为外植体,利用发根农杆菌对其进行浸染,探讨了不同钩藤外植体、菌液浓度、AS浓度、干燥处理时间对毛状根诱导率的影响。
本实验以钩藤种子无菌萌发的植株叶片为外植体,探究不同因素对钩藤组培再生体系中各阶段的影响,优化建立了稳定高效的钩藤组培再生体系,以钩藤再生体系为基础,采用叶盘法探究钩藤无菌离体叶片对卡那霉素的抗压程度,预培养时间、浸染液中AS浓度、菌液浓度、浸染时间及共培养时间对钩藤遗传转化效率的影响,经过抗性筛选获得阳性植株,以野生型钩藤植株作为对照,通过PCR检测鉴定GUS基因顺利转入。本研究成功建立钩藤遗传转化体系,为钩藤功能基因研究与定向改良奠定基础,对钩藤资源的开发利用具有重要意义。
1 材料与方法
1.1 材 料
钩藤种子采自贵州省黔东南州钩藤种植基地(26°27′55″N,106°39′21″E)。实验采用的农杆菌菌株为EHA 105,质粒PBI 121,该质粒含有GUS报告基因及卡那霉素抗性基因,菌株及载体保存于贵州大学生理生化与分子生物学实验室,试验时间2018年9月—2020年8月。
1.2 方 法
1.2.1种子消毒
将种子在流水下冲洗2 h后转移至超净工作台上,用75%酒精消毒15 s后用无菌水清洗3次,再使用10%次氯酸钠消毒8 min,无菌水清洗4~5次,接种于提前准备好的平板中,种子与培养基间用滤纸间隔进行萌发获得钩藤的无菌苗。
1.2.2愈伤组织诱导
将钩藤叶片切割成约0.5 cm2大小,以WPM为基本培养基,添加不同浓度的蔗糖(10、2、30 g/L)、2,4-D(2.0、3.0、4.0 mg/L)、6-BA(1.0、1.5、2.0 mg/L)和NAA(0.5、1.0、1.5 mg/L)进行四因素三水平正交实验,2周后统计愈伤诱导率,筛选愈伤诱导适宜条件。以WPM、MS和B 5为基本培养基,添加优化后的激素组合探究诱导钩藤愈伤组织适宜的基本培养基,再将接种好的材料分成两组,一组置于光照强度为31~35 μmol/(m2·s)、光照时间14 h/d、培养温度(25±2)℃的条件下,另一组置于同温度条件下遮光培养,探究遮光对钩藤愈伤诱导的影响。每个处理20瓶,每瓶接种5片,3次重复。
愈伤诱导率(%)=(出愈叶片数/接种的叶片数)×100%。
1.2.3不定芽的诱导
将钩藤愈伤组织接种到不定芽诱导培养基中,不定芽诱导培养基以WPM、MS和1/2 MS为基本培养基并添加6-BA(1.0、2.0、3.0 mg/L)和NAA(0.1、0.5、1.0 mg/L)进行三因素三水平正交实验,30 d后统计不定芽的诱导率。每个处理20瓶,每瓶接种4块愈伤组织,3次重复。
不定芽诱导率(%)=(出芽个数/接种的愈伤块数)×100%。
1.2.4叶片对卡那霉素的抗压筛选
取钩藤无菌苗叶片接种于含有不同浓度的卡那霉素(0,30,50,70,90 mg/L)愈伤诱导培养基中,2周后统计愈伤诱导率及叶片存活情况,将愈伤组织继续接种至不定芽诱导培养基中,统计不定芽的发生率,获得适宜的卡那霉素筛选浓度。
1.2.5预培养时间筛选
以优化所得的愈伤诱导培养基为预培养基,叶片裁剪为0.5 cm2大小,接种时叶片背面接触培养基进行预培养,时间设置0、2、4 d,将经过不同时间预培养的叶片在OD600=0.6的浸染液中浸染10 min[10],用滤纸吸干叶片表面菌液,共培养2 d,结束共培养后进行GUS染色并统计GUS染色的阳性率以获得最适预培养时间。
GUS染色的阳性率(%)=(着色叶片数/染色总数)×100%。
1.2.6浸染液中AS浓度筛选
取OD600=0.6时的农杆菌菌液,4 000 r/min离心10 min去上清,用WPM液体培养基重悬菌体配置成浸染液对进行外植体浸染,浸染时间为10 min[10],共培养2 d,共培养基中AS浓度设置为0、30、60、90、120 mg/L,将共培养后的叶片进行GUS染色,以获得共培养基中适宜的AS浓度。
1.2.7浸染浓度、浸染时间及共培养时间正交实验
取钩藤无菌苗叶片裁剪为0.5 cm2大小,设置预培养时间为0 d,浸染液中添加120 mg/L AS,以OD600(0.4、0.6、0.8)、农杆菌浸染时间(5、10、15 min)以及共培养时间(2、3、4 d)设置L9(34)正交实验。将共培养结束的钩藤叶片进行GUS染色,再经酒精脱色后统计GUS染色阳性率,获得正交试验最优组合。每个处理20皿,每皿放置8个叶片,3次重复。
1.2.8阳性植株的获得及PCR检测
通过上述实验所获得遗传转化最优条件,对钩藤叶片采用叶盘法进行遗传转化操作后,接种在含有50 mg/L卡那霉素的愈伤诱导培养基上筛选抗性叶片,将筛选获得的叶片转接至组培再生体系来获得抗性幼苗,利用RNA试剂盒提取抗性幼苗叶片中的RNA,反转录成cDNA,以GUS基因特异性引物(F-GUS:TACCGACGAAAACGGCAAGA;R-GUS:CAACTCCTACCGTACCTCGC)进行PCR检测,PCR反应程序为:94 ℃ 3 min预变性;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸1 min,共30个循环;再72 ℃延伸5 min,将野生型钩藤幼苗cDNA作为对照,PCR产物用1%琼脂糖凝胶电泳进行检测。
1.3 数据处理
运用DPS及Minitab 18统计分析软件进行显著性(p<0.05)分析,使用Origin 2018软件进行绘图。数据为平均值±标准差,不同小写字母之间表示在(p<0.05)水平上有显著性差异。
2 结果与分析
2.1 钩藤组培再生体系的优化
2.1.1不同因素对钩藤愈伤组织诱导的影响

表1 不同影响因素对钩藤愈伤诱导率的影响Table 1 The influence of different factors on callus induction of Uncaria rhynchophylla
基本培养基及光照对愈伤组织的形成均有一定的影响。由图1 A可见,当使用WPM作为钩藤愈伤诱导的基本培养基时,诱导效果最好且褐化率较低,其次是MS培养基,但通过显著性分析可知二者并无显著性差异,而B 5培养基的诱导效果最差,与前两者相比愈伤诱导率显著降低,同时褐化率较高。对外植体遮光处理后愈伤诱导率显著增高且褐化率显著降低,相对于光照条件,其出愈时间缩短(图1 B)。

注:A为基本培养基对愈伤诱导的影响, B为遮光处理对愈伤诱导的影响。图1 基本培养基及遮光处理对愈伤组织诱导的影响Fig.1 The effect of basic medium and shading treatment on callus induction

注:A为种子萌发;B为以WPM为基本培养基所得愈伤组织;C为遮光处理所得愈伤组织;D为愈伤分化产生不定芽。图2 钩藤组培再生过程Fig.2 Tissue culture regeneration of Uncaria rhynchophylla
2.1.2基本培养基及激素水平对钩藤不定芽诱导的影响
基本培养基可以为植物提供其生长发育所需要的营养物质,不同植物所需的营养种类及所需含量不一样,外源激素对诱导不定芽发生也起关键作用。由表2中极差分析得出,基本培养基相较外源激素对诱导不定芽发生的影响最大,其次是NAA的浓度,6-BA的影响最小,且WPM最适合进行钩藤的不定芽诱导,MS培养基的出芽效果最差。钩藤不定芽的分化率会随着6-BA浓度的增加而增加,但当6-BA持续增长时,其出芽率也会有明显降低的趋势,低浓度的NAA对诱导钩藤不定芽的发生有较好的效果,同时6-BA与NAA浓度的比值不断增加时其出芽率会逐渐增高。通过显著性分析,处理2的出芽率最高,为87.6%。
本实验成功优化并建立了高效的钩藤组培再生体系,依次获得种子萌发的钩藤无菌幼苗、愈伤组织及不定芽(图2)。

表2 不同影响因素对钩藤不定芽诱导的交互作用Table 2 Interaction of different influencing factors on adventitious bud induction of Uncaria rhynchophylla
2.2 钩藤遗传转化体系的建立
2.2.1钩藤叶片对卡那霉素的敏感性
由表3得知,不添加卡那霉素时钩藤叶片可正常诱导愈伤组织进而诱导不定芽的发生,当卡那霉素浓度为30 mg/L时,抗生素已经明显抑制愈伤组织的发生,钩藤叶片出现死亡,此时愈伤诱导率为48.89%,将愈伤组织转接到不定芽诱导培养基上时,不定芽诱导率随之降低;卡那霉素的浓度增加至50 mg/L时,钩藤叶片愈伤诱导率急剧下降,仅有7.49%,此时叶片大量死亡,不定芽的诱导率也极低;卡那霉素增长至70 mg/L时,钩藤叶片的愈伤诱导被完全抑制,不定芽也未成功诱导。综上,根据半致死剂量原则,确定筛选培养基中适宜的卡那霉素浓度为30 mg/L。

表3 钩藤叶片对卡那霉素的敏感性Table 3 Sensitivity of Uncaria rhynchophylla leaves to Kanamycin

注:A为不同预培养时间下GUS染色阳性率;B为共培养基中添加不同浓度AS时GUS染色阳性率。图3 预培养时间及共培养基中AS浓度对钩藤叶片遗传转化效率的影响Fig.3 The effect of pre-cultivation time and AS concentration in the co-culture medium on the genetic transformation efficiency of Uncaria rhynchophylla leaves
2.2.2预培养时间及AS浓度对转化效率的影响
通过GUS染色阳性率显示,不同的预培养时间及共培养基中AS浓度对钩藤叶片遗传转化效率具有显著性的影响。当预培养时间不断增加,GUS染色的阳性率先增加后降低,不进行预培养操作时GUS染色阳性率依旧较高,预培养时间为2 d时,GUS染色阳性率明显升高,预培养时间增至4 d时,GUS染色阳性率最低(图3-A)。同时GUS染色阳性率会随着共培养基中AS浓度的增加不断增高(图3-B),当浸染液中不添加AS时,虽有一定的GUS染色阳性率,但较低,当AS的浓度不断增加时GUS染色阳性率逐渐增加,AS浓度为120 μmol/L时,GUS染色阳性率达到最高。因此,利用钩藤叶片进行遗传转化时,共培养基中AS的适宜浓度为120 μmol/L。
[80] [美]帕特里克·克罗宁:《南海地区的权力与秩序:美国南海政策的战略框架》,《亚太安全与海洋研究》2017年第1期,第36页。
2.2.3不同因素对转化效率的交互影响
对正交实验结果(表4)进行极差分析可知,菌液浓度对GUS染色阳性率的影响最大,极差为37.94,其次为农杆菌的浸染时间,而共培养时间对其影响最小。在农杆菌浸染时间及共培养时间固定时,GUS染色阳性率随菌液浓度的增加呈先升高后降低的趋势。在OD600=0.8时钩藤叶片中GUS染色阳性率较其他浓度显著提高,在OD600=0.4时,不断增加浸染时间及共培养时间,GUS染色阳性率依旧较低。浸染时间为10 min时,GUS染色阳性率比在其他时间处理下显著提高。此外,当OD600为0.4~0.6同时随着浸染时间的增加,共培养时间逐渐增加时,GUS染色阳性率呈先增加后降低的趋势即在共培养时间为3 d时,转化效率较高。但当OD600=0.8,共培养时间为2 d的条件下,GUS染色阳性率显著高于其他同菌液浓度下的处理。通过对不同处理下的叶片进行GUS染色如图4,编号8的染色效果较其他处理效果较好,着色强度较大,而编号1的效果最差,着色强度极小。综上OD600=0.8,农杆菌浸染时间10 min,共培养时间2 d的条件下转化率最高,为60.06%。

注:1~9为正交表相应编号处理下GUS染色效果;10为野生型钩藤叶片GUS染色效果(10×40)。图4 正交实验GUS染色效果Fig.4 Effect of GUS dyeing by orthogonal experiment

注:M为DL 2 000 Marker;PC为阳性对照(PBI 121质粒);NC为阴性对照(野生型钩藤幼苗);1~7为转化所得阳性植株反转录PCR结果。图5 转化所得钩藤阳性植株GUS基因PCR扩增电泳检测图谱Fig.5 The GUS gene PCR amplification and electrophoresis detection pattern of the transformed U. rhynchophylla positive plants
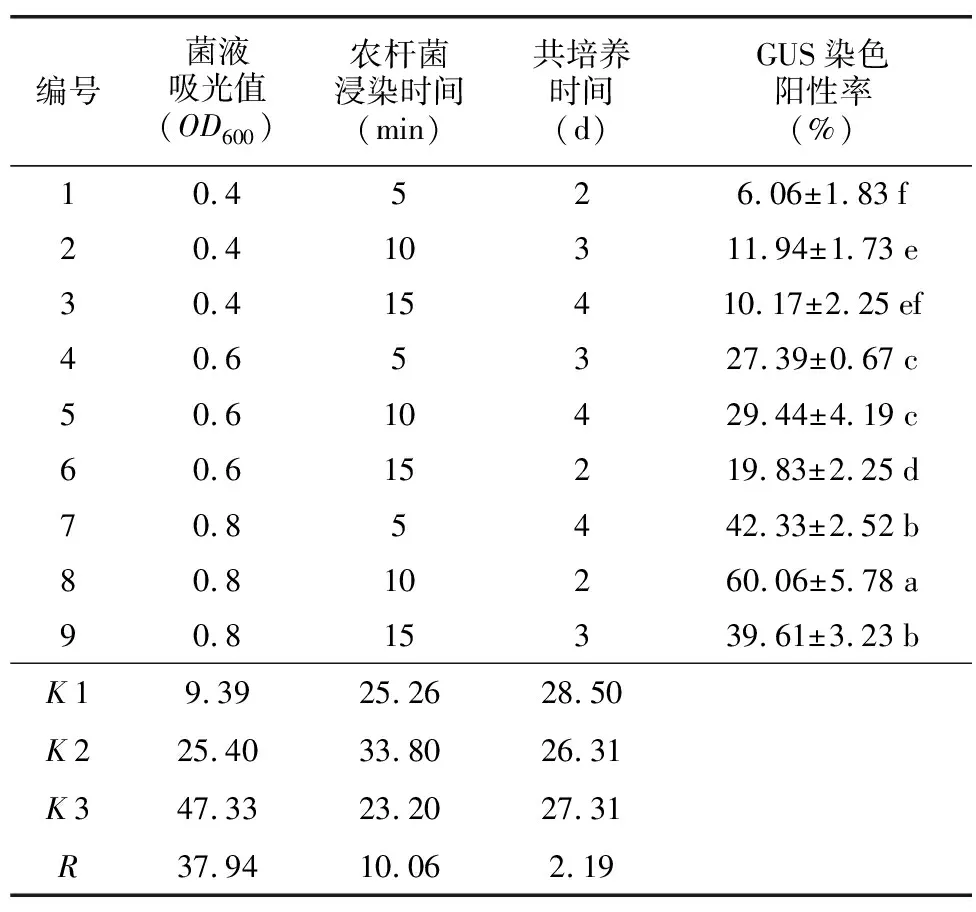
表4 菌液浓度、浸染时间及共培养时间对遗传转化率的影响Table 4 The influence of bacterial solution concentration, dip time and co-cultivation time on genetic transformation rate
2.3 抗性幼苗的阳性检测
取钩藤叶片结合实验所得最优条件组合进行遗传转化操作后,接种至愈伤诱导培养基中,培养基加入50 mg/L卡那霉素进行筛选后,转接至优化所得再生体系中培养抗性钩藤幼苗,将获得的抗性植株切取一部分进行GUS染色进行初步筛选,以检测抗性幼苗是否为转基因阳性幼苗。再以野生型钩藤幼苗为对照,将检测到的7株阳性转基因幼苗提取叶片中的RNA,反转录后进行PCR检测,经1%凝胶电泳,结果见图4,通过抗性筛选获得的7株阳性幼苗均扩增出相应条带。
3 讨 论
3.1 钩藤组培再生体系的优化
糖原在培养基中除提供能源外还可调节渗透压,而植物在进行脱分化形成愈伤组织的过程中能源必不可少[16-17]。WPM培养基因其本身具有较低的无机盐含量,更加适应钩藤等木本植物的生长。植物学研究表明,外植体可在暗培养下进行脱分化形成愈伤组织,因此将钩藤叶片进行遮光培养时愈伤组织诱导率显著增加。
对大部分的木本植物来说,欲使愈伤组织分化产生不定芽,通常需要一定外源激素的作用;同时很多木本植物在进行愈伤诱导时仅添加6-BA和NAA而不添加2,4-D[18],但结果显示,2,4-D对钩藤愈伤诱导有显著影响;当不断增加6-BA及NAA的浓度时,钩藤不定芽的分化反而降低,这可能和植物种类、生长条件及组织部位等的不同,不同激素的内生水平也不相同,因而对不定芽发生过程来说,它们所要求的外源激素的水平也会有所不同[19-20]。实验所得愈伤诱导率最高可达96.32%,同时补充遮光及不同培养基对愈伤诱导的影响;不定芽的诱导率为87.6%,较吴顺等[14]研究的愈伤诱导率(83.3%)提高13.02%,不定芽发生率(82.3%)提高5.3%,成功优化建立了高效的钩藤组培再生体系。
3.2 钩藤遗传转化体系的建立
筛选培养基添加卡那霉素旨在有效抑制非转化细胞的生长并使其死亡,同时又要求所添加的浓度不能影响成功转化细胞的正常生长[21-22],因此在筛选培养基中所添加的卡那霉素浓度很关键。研究发现,T-DNA的转移、整合是在共培养阶段进行,所以需外植体在共培养时达到最佳的分裂状态,而不同植物在转化前进行预培养所获得的效果有所不同,有些植物因脱分化较易且快而不用进行预培养,但很多木本植物其自身脱分化较慢就需要进行预培养[23-25]。本研究发现,钩藤虽为木本植物,但其外植体不进行预培养时遗传转化效率反而较高,推测可能与其自身愈伤组织诱导较易及自身特殊性有关。
在遗传转化操作中,菌液浓度过低时浸染效率不高,浓度过高又会产生毒害作用导致外植体的褐化死亡[26-27];农杆菌是通过伤口进入植物组织,根癌农杆菌携带的目的基因,在共培养阶段经过加工后,向植物细胞转移,进而整合到植物基因组中,因此浸泡时间过短不能使足够量的农杆菌附着于伤口处,从而降低了转化效率,浸泡时间过长又会导致外植体的褐化死亡,同时导致后续除菌困难[28-29];共培养时间的长短,对目的基因的整合及转化细胞的数量也有着很大的影响[30],对钩藤而言,浸染后随着共培养时间的延长,其转化效率反而降低,随着菌液浓度增加,遗传转化效率显著增加,表明较高的菌液浓度适宜其进行遗传转化,这可能是木本植物其自身的木质部发达质地坚硬的原因,也可能是不同种类钩藤特性及取材时幼苗的生长状态不同,具体原因有待下一步对比探究。
4 结 论
综上所述,钩藤愈伤诱导培养基为WPM+3 mg/L 2,4-D+1.5 mg/L 6-BA+1.0 mg/L NAA+30 g/L蔗糖同时遮光培养;最适不定芽诱导培养基为WPM+2 mg/L 6-BA+0.5 mg/L NAA;叶片对卡那霉素抗压筛选条件为30 mg/L;最适遗传转化因子组合为:预培养2 d,OD600=0.8,共培养基中加入120 μmol/L AS,浸染时间10 min,共培养时间2 d。经PCR检测证明,GUS基因可顺利转入钩藤基因组中并作为其遗传转化的指示基因。表明农杆菌介导的钩藤遗传转化体系可以构建,并能成功得到具有相关抗性的植株,为钩藤后续基因功能的验证及品种改良奠定基础。
