外施2,4-表油菜素内酯缓解冬小麦拔节期冻害胁迫效应
2022-05-12张奥深雍晓宇韩巧霞姚永伟师焕婷李鸽子康国章
张奥深,雍晓宇,韩巧霞,姚永伟,师焕婷,李鸽子,康国章
(河南农业大学 农学院,国家小麦工程技术研究中心,河南 郑州 450046)
小麦作为我国三大粮食作物之一,其产业发展直接影响到国家粮食安全和社会稳定。近年来,随着全球气候变暖,极端低温灾害频繁发生,严重影响了小麦的稳产、高产[1],其中倒春寒是黄淮麦区最严重的灾害,在我国冬麦主产区黄淮麦区,小麦冻害发生的频率越来越高,对小麦造成的危害也越来越严重[2]。小麦拔节期到抽穗前是小麦生长速度最快,生长量最大的时期,叶面积及茎穗的长度和体积成倍或几十倍增长,干物质积累也进入迅速增长阶段,此时小麦生长旺盛,抗寒能力弱[3],低温对小麦造成的不利影响较为严重[4]。
油菜素内酯(Brassinolide,BR)又称芸薹素内酯[5],是广泛存在于植物体内、参与各种生理活动的一种天然化合物,被称为第六种植物激素[6]。BR是公认的高效、广谱、无毒的一种植物生长调节剂。2,4-表油菜素内酯(2,4-Epibrassinolide,EBR)是一种人工合成的高活性油菜素内酯类似物,外施EBR能够提高作物的抗逆能力[7]。尚宏芹等[8]研究表明,叶面喷施EBR可通过提高小麦幼苗的抗氧化酶活性和抗氧化物质含量、降低MDA和H2O2含量,减轻重金属汞对幼苗的伤害,促进小麦幼苗的生长。孙玉珺等[9]研究表明,外源BR处理可提高幼苗生物量、抗氧化酶活性以及Pro、可溶性糖和可溶性蛋白含量,降低MDA含量,缓解低温胁迫对玉米生长的抑制程度。刘丽杰等[10]研究发现,利用0.1 mg/L的EBR处理小麦幼苗,可提高小麦的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,可溶性糖和Pro含量显著提高,降低MDA含量,从而提高小麦的抗冻性。前人从生理层面对EBR提高作物的耐受性进行研究,证实EBR对多种逆境胁迫具有缓解作用,但从基因层面对EBR的作用机制研究较少。
本试验以半冬性品种百农207为材料,在小麦拔节期外源浇施EBR,并利用人工气候室模拟低温冻害,研究冻害胁迫条件下小麦植株生理指标、抗逆相关基因表达量、幼穗受冻率、籽粒产量、千粒质量以及地上部干物质质量的变化,探究外源EBR缓解小麦低温冻害的生理机制,以期为减轻倒春寒对小麦的危害提供理论依据和技术支撑。
1 材料和方法
1.1 试验材料与设计
供试材料为普通半冬性小麦品种百农207。试验采用盆栽,2020年秋季种植在河南省郑州市毛庄河南农业大学科技园试验田中,盆的直径为30 cm,高为30 cm,三叶期每盆定苗16株。盆栽用土为0~30 cm的耕层土壤,每盆装过筛壤土8 kg,并均匀施入尿素2.3 g、磷肥0.8 g和钾肥3.4 g,之后埋于试验田中,盆的顶部边缘与地面齐平。
在前期试验筛选EBR浓度的基础上,待小麦生长至拔节期时浇施浓度为0.1 mg/L的EBR 400 mL,对照(CK)施用同等体积的水。小麦植株充分吸收24 h后,将盆栽移入人工气候室内-5 ℃低温连续处理48 h,在处理0,24,48 h分别剪取主茎最上部全展叶,用于生理指标的测定及基因表达分析,每个处理重复3次。
1.2 生理指标测定
在冻害胁迫处理前后利用SPAD-502叶绿素仪测定小麦最上部全展叶的SPAD值,每盆测5片叶片取平均值。利用硫代巴比妥酸(TCA-TBA)显色法测定叶片MDA含量,采用酸性茚三酮法测定Pro含量,利用电导率仪测定叶片相对电导率[11]。
1.3 基因表达分析
取小麦叶片0.1 g,利用总RNA提取试剂盒(Vazyme,南京)提取总RNA,反转录试剂盒(Vazyme,南京)合成cDNA第一链。在前期研究中,小麦高产抗逆分子调控创新团队筛选出与冻害胁迫相关的5个抗逆基因:SOD[12]、POD[13]、CAT[14]、P5CS[15]和WCS120[16]。本研究以小麦Actin作为内参基因,对5个抗逆相关基因进行转录水平的检测。采用软件Primer Premier 5.0设计引物(表1),由河南尚亚生物技术有限公司进行合成。2-ΔΔCt法计算基因的相对表达量。

表1 实时荧光定量PCR引物信息Tab.1 qRT-PCR primer information
1.4 小麦幼穗受冻率调查和籽粒产量、千粒质量、干物质质量测定
在拔节期对盆栽小麦外源施用EBR 24 h后,进行冻害胁迫处理(48 h),自然条件下恢复生长,15 d后调查幼穗受冻后死亡情况,取其平均值计算幼穗受冻率;于成熟期按盆收获籽粒计算籽粒产量;按处理随机选取1 000个籽粒确定千粒质量;将收获后小麦植株地上部放入烘箱,105 ℃杀青30 min后80 ℃烘干,计算干物质质量。
1.5 数据处理
采用Microsoft Excel 2010进行数据处理,采用SPSS 22.0软件进行方差分析,采用Origin 9.0作图。
2 结果与分析
2.1 小麦拔节期外施EBR冻害胁迫后植株叶片SPAD值的变化
如图1所示,冻害胁迫前,外施EBR处理组与对照的SPAD值无显著差异,在冻害胁迫后,叶片的SPAD值随冻害胁迫时间的延长呈下降趋势,在同一胁迫时间处理组的SPAD值始终显著高于对照,这表明小麦拔节期外施EBR可以缓解冻害胁迫下叶片衰老,延长叶片的功能期。

柱上不同小写字母均表示在5%水平差异显著。图2—5同。The different lowercase letters on the columns indicate significant differences at the 5% level.The same as Fig.2—5.
2.2 小麦拔节期外施EBR冻害胁迫后植株叶片MDA含量和相对电导率的变化
冻害胁迫处理前外施EBR的小麦植株和对照植株叶片MDA含量差异不显著;冻害胁迫24 h对照组MDA含量显著升高,而外施EBR处理组小麦植株叶片MDA含量与冻害胁迫前无显著变化;而冻害胁迫处理时间达到48 h,二者的MDA含量均较处理24 h显著下降,且处理组MDA含量显著低于对照组。结果表明,拔节期外施EBR可以降低小麦植株叶片MDA含量,从而减轻其膜脂过氧化程度(图2)。
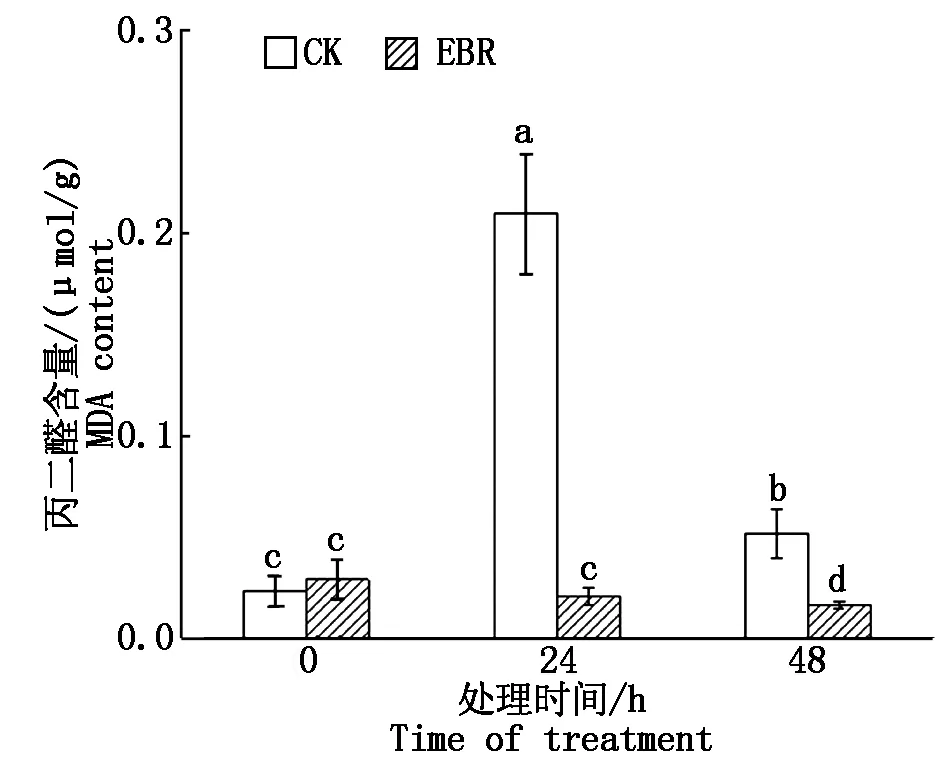
图2 小麦拔节期外施EBR冻害胁迫后叶片的MDA含量Fig.2 MDA content in wheat leaves under freezing stress after external application of EBR at jointing stage
在冻害胁迫处理前外施EBR植株叶片的相对电导率与对照无显著差异,在低温胁迫24,48 h,外施EBR的植株相对电导率均显著低于对照(P<0.05),分别降低了8.19,7.03百分点(图3)。
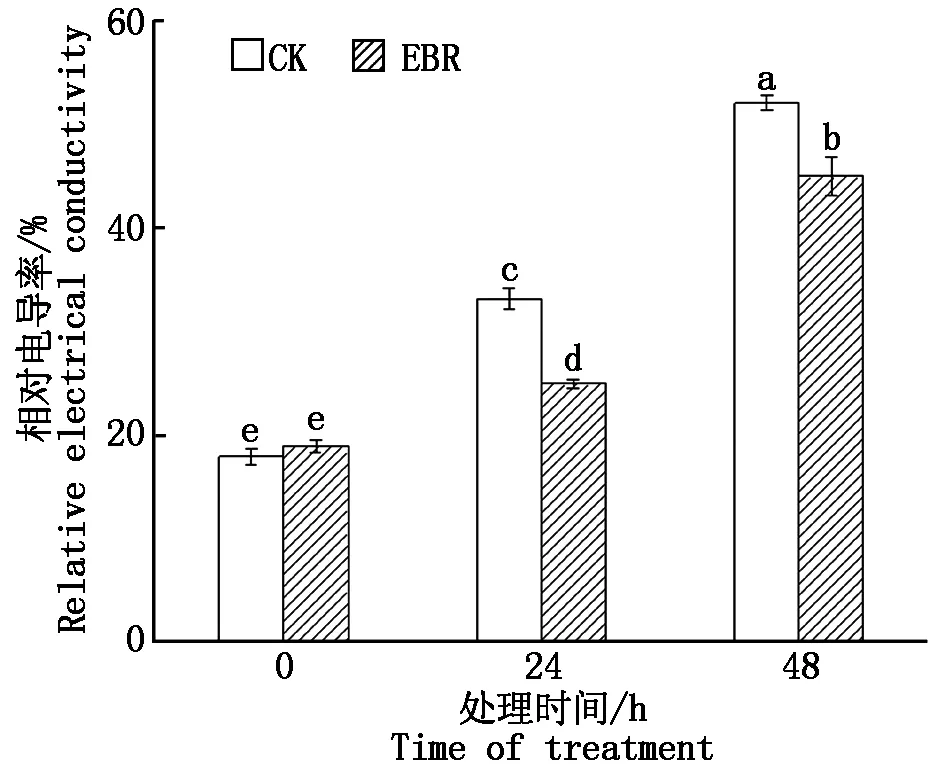
图3 小麦拔节期外施EBR冻害胁迫后叶片的相对电导率Fig.3 Relative conductivities in wheat leaves under freezing stress after external application of EBR at jointing stage
2.3 小麦拔节期外施EBR冻害胁迫后植株叶片Pro含量的变化
由图4可知,对照组在冻害胁迫下,Pro含量呈现逐渐下降趋势;而外施EBR的处理组在胁迫条件下,叶片的Pro含量逐渐上升;在冻害胁迫48 h,处理组小麦叶片的Pro含量显著高于对照组(P<0.05)。
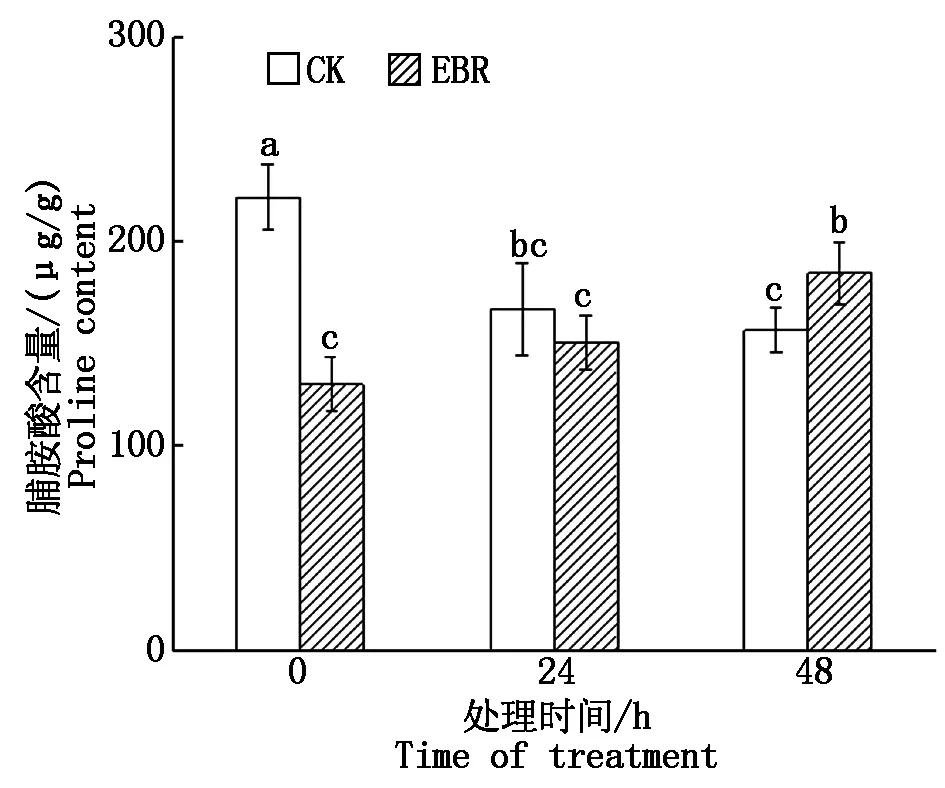
图4 小麦拔节期外施EBR冻害胁迫后叶片Pro含量Fig.4 Proline contents in wheat leaves under freezing stress after external application of EBR at jointing stage
2.4 小麦拔节期外施EBR冻害胁迫后植株叶片抗逆相关基因表达量变化
在冻害胁迫处理前,除P5CS其余4个抗逆相关基因的表达量处理组均显著高于对照组(P<0.05);处理组小麦植株在冻害胁迫24 h,叶片中的SOD、POD和CAT的表达量较胁迫处理前均显著降低,而P5CS和WCS120的表达量均显著上升;对照组在冻害胁迫处理24 h,SOD、CAT的表达量较冻害胁迫处理前无显著变化,P5CS和WCS120的表达量均显著上升。冻害胁迫处理48 h与24 h相比,处理组的SOD、POD、CAT和WCS120的相对表达量均显著提高;而对照组的SOD、P5CS和WCS120表达量无显著变化。在冻害胁迫处理48 h,处理组的5个抗逆相关基因表达量均显著高于对照(P<0.05)(图5)。
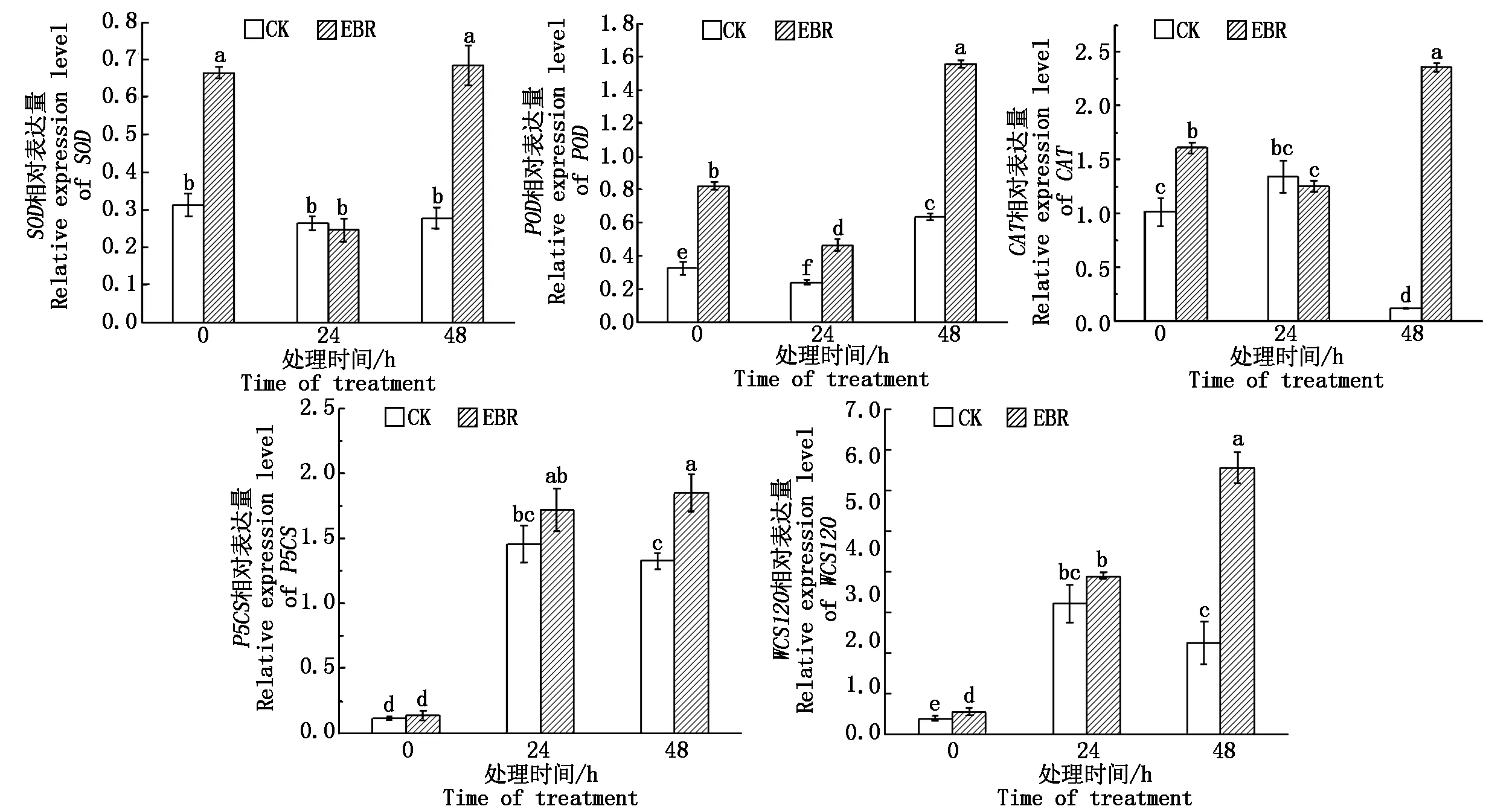
图5 小麦拔节期外施EBR冻害胁迫后叶片抗逆相关基因的相对表达量Fig.5 Relative expression leaves of stress resistance related genes in wheat leaves under freezing stress after external application of EBR at jointing stage
2.5 小麦拔节期外施EBR冻害胁迫后植株幼穗受冻率、籽粒产量、千粒质量和干物质质量的变化
外施EBR的处理组小麦植株幼穗受冻率比对照组降低了20.93百分点;处理组的植株籽粒产量和干物质质量每盆分别较对照增加了19.38,54.40 g,处理组千粒质量较对照增加了2.37 g,均显著高于对照。说明在拔节期外施EBR能够提高小麦幼穗的抗冻性和干物质积累量,从而提高小麦产量(表2)。

表2 小麦拔节期外施EBR冻害胁迫后幼穗受冻率、籽粒产量、千粒质量和干物质质量Tab.2 The damage rates of young ears,grain yields,1 000 grains weights and dry matter qualities in wheat under freezing stress after external application of EBR at jointing stage
3 结论与讨论
油菜素内酯是一种多羟基甾类化合物,是调节植物逆境胁迫伤害的重要生长调节剂,参与不同植物的生长、发育和抵抗外界胁迫等生物学功能[17-18]。外源EBR对植物逆境胁迫缓解方面的生理作用日益受到关注[19-21]。华智锐等[22]研究发现,在干旱胁迫下,经BR处理的小麦幼苗抗氧化酶活性提高,MDA含量降低,相对含水量提高,从而提高了小麦幼苗的抗旱性。李淑叶[23]在低温处理前对棉花叶面分别喷施不同浓度的EBR和蒸馏水,结果表明,外源喷施适宜浓度的EBR较喷施蒸馏水可显著提高叶片Pro含量、净光合速率、植株的干鲜质量,降低MDA含量和相对电导率。唐秀巧等[24]在小麦灌浆期高温前通过叶面喷施磷酸二氢钾(PDP)和BR均能显著延缓灌浆期叶片衰老,促进干物质积累。植物在逆境胁迫下会产生活性氧,破坏细胞膜结构,阻碍叶绿素合成,降低SPAD值,从而破坏光系统,减少植物干物质积累量[25]。本试验研究结果表明,在连续冻害胁迫48 h,外施EBR的处理组小麦MDA含量和相对电导率显著降低,而Pro含量显著提高,SPAD值、籽粒产量、千粒质量和地上部干物质质量均显著高于对照,与前人研究结果一致。
在植物逆境研究中,前人的研究表明,抗氧化酶SOD、POD、CAT 等活性的高低与植物的抗逆能力密切相关[26],但植物体内其他的水解酶的存在,极易影响抗氧化酶的提取与活性的测定,而进行转录水平的检测则受其他水解酶的影响较小。在前期研究中,本课题组筛选出与冻害胁迫相关的5个抗逆基因SOD、POD、CAT、P5CS和WCS120。其中,SOD基因控制超氧化物歧化酶的合成,超氧化物歧化酶作为清除植物体内活性氧(ROS)的清除剂,是首个响应逆境胁迫并参与反应的酶[12];POD基因控制过氧化物酶的合成,过氧化物酶能分解植物体内的H2O2,降低其对细胞的危害[13];CAT基因控制过氧化氢酶的合成,过氧化氢酶是一种强抗氧化酶,催化H2O2分解成水和氧,在植物对非生物胁迫的响应中起着关键作用[14];WCS120基因是一种受低温特异性诱导的基因,其编码的蛋白质被认为在小麦的冷驯化过程中起着重要的作用,WCS120蛋白的积累量与高抗冻冬小麦组织的耐寒性呈正相关[16]。吡咯琳-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)是脯氨酸合成中谷氨酸合成途径的关键酶[15],Pro含量和植物的逆境耐受力呈正相关[27],植物体内的Pro含量与P5CS基因的相对表达量呈正相关[28-29]。因此,SOD、POD、CAT、P5CS和WCS120这5个抗逆相关基因的相对表达量可作为小麦抗冻性的参考依据。本试验研究结果表明,在冻害胁迫处理48 h,对照组SOD基因的相对表达量较冻害胁迫处理前无显著变化,POD、P5CS和WCS120均显著升高,而外施EBR的处理组小麦植株,除SOD外POD、CAT、P5CS和WCS120的表达量较冻害胁迫处理前均显著提高,在冻害胁迫48 h 5个抗逆基因的相对表达量均显著高于对照。
在冻害胁迫条件下,抗逆基因转录水平的检测结果与生理指标鉴定结果一致,表明在冻害胁迫下,外施EBR可提高小麦植株的抗氧化酶活性,增加其清除活性氧的能力,降低膜脂过氧化程度;同时P5CS基因的高表达表明,外施EBR可提高植株体内游离脯氨酸含量,增加小麦的抗寒性。SPAD值的显著提高表明,外施EBR可缓解冻害胁迫下小麦叶片衰老,延长其功能期,提高小麦植株物质积累量;幼穗受冻率的检测结果同样表明,在小麦拔节期外施EBR可降低其幼穗受冻率,提高籽粒产量和千粒质量。因此,EBR拔节期外施可起到缓解冻害的效应,从而提高小麦的抗冻性。基于此,在春季低温冻害来临之际,可以通过施用EBR减轻低温冻害对冬小麦生产造成的产量损失。
