Ⅲ型干扰素在HPV阳性宫颈癌中作用的研究进展
2022-05-07范雅丹邓青春海南医学院第二附属医院妇科海南海口570216
范雅丹,邓青春 (海南医学院第二附属医院妇科,海南 海口 570216)
干扰素是Ⅱ类细胞因子家族的一部分,根据序列的同源性可将其分为Ⅰ型、Ⅱ型和Ⅲ型。Ⅰ型干扰素家族包括IFN-α、IFN-β、IFN-ε、IFN-κ、IFN-ω、IFN-ζ,其特异性受体IFNAR1、IFNAR2分布在所有有核细胞中。Ⅰ型干扰素被认为是机体抵抗病原体感染的关键天然免疫防御,同时其还有抑制肿瘤细胞增殖和调节免疫的作用。Ⅱ型干扰素在机体中主要发挥促炎和免疫调节的作用,功能上与Ⅰ型和Ⅲ型干扰素有很大的差异[1]。Ⅲ型干扰素于2003年被发现,是一系列白介素(IL-28a、IL-28b、IL-29)的总称,具有抗病毒、抑制肿瘤细胞增殖、调节免疫的作用,且可作为前线防御控制上皮黏膜的感染,同时可减少由炎症反应引起的细胞组织损伤。
女性生殖道短且直,易引起细菌、支原体、衣原体及病毒的感染,其中人乳头瘤状病毒(human papilloma virus,HPV)是引起疣状损害和宫颈癌的主要原因。HPV是球形的DNA病毒,多感染女性生殖道,具有传染性。到目前为止,已经明确可以感染人类的HPV病毒有200多种,其中又分为高危型病毒和低危型病毒。低危型HPV(如HPV6型、HPV11型)主要引起生殖器、黏膜的疣状损害以及轻度的宫颈上皮内瘤变;而高危型HPV(如HPV16型、HPV18型)致癌风险较为突出,是引起高级别宫颈上皮内瘤变和宫颈癌的主要原因。干扰素可清除生殖道的致病微生物,其中Ⅰ型干扰素已应用于临床,但Ⅲ型干扰素还在研究阶段。故本研究总结了Ⅲ型干扰素的作用机制及其在高危的HPV感染所致宫颈癌中的研究现状,现报告如下。
1 Ⅲ型干扰素的分型及调控特点
Ⅲ型干扰素可分为4种亚型,分别是IFN-λ1(IL-29)、IFN-λ2(IL-28a)、IFN-λ3(IL-28b)和IFN-λ4。由于IFN-λ2与IFN-λ3于染色体位置上毗邻,有97%相同的启动子,两者有着非常高的同源性,功能上也有着极高的相似性,故在构建IFN-λ3缺失小鼠模型的同时会造成IFN-λ2多片段的缺失[2-3]。IFN-λ4与其他几种亚型相比,在物种间有更高的同源性,虽然IFN-λ4在大部分哺乳动物中高表达,但在部分人群中呈假基因状态,这是由于这部分人群体内缺乏rs368234815-△G的等位基因。IFN-λ4具有较大的抗病毒潜能,其分泌量少,但能诱导大量干扰素刺激基因(interferon-stimulated genes,ISGs)的表达,诱导产生的ISGs能直接或间接影响病毒在体内的扩散。IFN-λ3分泌平缓,持续时间长,相比之下,IFN-λ4多为旁分泌,且可更快地达峰[4]。除此之外,IFN-λ4能诱导泛素特异性蛋白酶18(ubiquitin-specific peptidase 18,USP18)和细胞因子信号传导抑制因子1(suppressors of cytokine signaling 1,SOCS1)的表达来参与干扰素的负性调节。其中USP18可裂解干扰素刺激基因15(interferon-stimulated gene 15,ISG15),或者竞争性与IFNAR2结合抑制IFNAR2与JAK1的相互作用,从而降低干扰素的抗病毒效能;而SOCS1则是通过阻断STAT磷酸化来负性调节干扰素的作用效能[4]。然而USP18、SOCS1对Ⅰ型干扰素和Ⅲ型干扰素的调控有所不同:SOCS1敲除的小鼠表现为对Ⅲ型干扰素更敏感,USP18敲除的小鼠则表现为对Ⅰ型干扰素更敏感,说明SOCS1对Ⅲ型干扰素的负性作用更强,而USP18对Ⅰ型干扰素起更强的负调控作用[5]。Ⅲ型干扰素对多种病毒都有一定程度的抑制作用,如丙肝病毒、仙台病毒、登革热病毒以及冠状病毒等,但都不足以将其完全清除[6-8]。Ⅲ型干扰素是丙肝病毒感染中预测肝清除能力受损的最强因子,但其在HPV感染和宫颈癌中的作用尚不明确。
2 Ⅲ型干扰素的信号通路及与Ⅰ型干扰素的差异
2.1 Ⅲ型干扰素的信号通路
Ⅲ型干扰素通过与细胞膜上特异性受体IFN-LR1(又称IL-28Rα)、IL-10Rβ结合,激活JAK-STAT信号通路,以旁分泌的形式于上皮、黏膜处发挥抗病毒作用。Ⅲ型干扰素先与高亲和力的IFN-LR1相结合,再募集低亲和力的IL-10Rβ形成三元的复合物,从而激活TYK2、JAK1使STAT磷酸化,形成p-STAT1和p-STAT2的异源二聚体;异源二聚体与IRF9结合形成干扰素刺激基因因子3(interferon-stimulated gene factor 3,ISGF3),ISGF3由细胞质转移至细胞核,与位于ISGs上游启动子区域的干扰素激活反应元件相结合,刺激ISGs大量表达,从而抑制病毒的复制(图1)[9-11]。
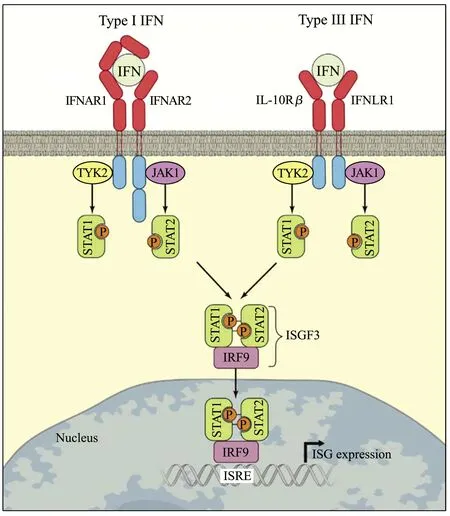
图1 Ⅲ型干扰素经典通路[20]
ISGs有上百种,但能在体内发挥抗病毒作用的ISGs较少,主要原因是:①对ISGs的解读是从全基因组转录分析才开始,对其了解尚不全面;②已发布的对ISGs的筛选表明只有少量的ISGs在体外有抗病毒的表型,而进行体内研究通常需要强有力的体外研究理论依据,故目前只有少量的ISGs得到了较充分的研究;③在激活的JAK-STAT信号通路中,由于ISGs功能冗余,故敲除其单个基因常不能得到一个明确的表型,因此限制了对单个ISG的抗病毒机制的研究[9,12]。经典的ISGs包括抑制细胞内病毒mRNA转录的双链RNA激活蛋白酶(double-stranded RNA-activated protein kinase,PKR)、以病毒核衣壳为靶点的粘液病毒抗性蛋白A(myxovirus resistance protein A,MXA)以及2,5’-寡腺苷酸合成酶(2,5’-oligoadenylate synthetase,OAS)[13-14]。OAS由病毒的双链RNA激活,合成2,5’-寡腺苷酸,合成的2,5’-寡腺苷酸激活RNase L降解病毒RNA[15]。RNase L参与各种病毒感染的防御反应过程,在人体先天性免疫中起重要作用,也是在多数肿瘤中表达异常的一类蛋白分子。ISG15为ISGs中作用最强烈、诱导最快的因子之一。ISG15缺乏的小鼠会被多种病毒感染,被感染的小鼠呈现出比野生型小鼠更高的病死率。ISG15可抑制病毒DNA或RNA的复制,影响病毒的出芽和释放,通过ISG化影响新合成的宿主蛋白和病毒蛋白的表达,也可间接影响由病毒感染宿主诱导的信号通路,从而发挥免疫调节作用[16-17]。但有研究发现,先天缺乏ISG15的患者更易被分枝杆菌感染,而不是被病毒感染,这与ISG15诱导IFN-γ分泌相关[18],说明ISG15在免疫应答中发挥广泛作用。干扰素诱导的四肽重复序列(interferon-induced protein with tetratricopeptide repeats,IFIT)基因家族包括ITFT1、ITFT2、ITFT3、ITFT5。IFIT通过识别缺乏2’-O甲基化及含有5’-三磷酸碱基的病毒RNA,进而抑制病毒RNA复制,也可竞争性结合真核翻译起始因子3(eukaryotic translation initiation factor 3,eIF3)抑制病毒翻译[19]。干扰素诱导的跨膜蛋白(interferon inducible transmembrane,IFITM)在病毒入侵早期表现出抑制作用。对A型流感患者体内的ISGs进行检测发现,IFITM3和MXA1是抑制流感病毒作用最强的蛋白,且IFITM3是导致患者病理性结果最少的ISGs效应器之一[14]。ISGs及其产物在病毒入侵的各个阶段发生作用,并能正向和负向调节干扰素的信号通路,或将是调节干扰素信号通路的重要靶点。
2.2 Ⅲ型干扰素和Ⅰ型干扰素的功能差异及其原因
Ⅰ型干扰素和Ⅲ型干扰素均有抗病毒、抑制增生、调节免疫的功能,但与Ⅰ型干扰素相比,Ⅲ型干扰素诱导的炎症更少,且在大部分组织中诱导的反应更弱,但在消化道、上呼吸道、生殖道、母胎界面及皮肤等上皮黏膜处,Ⅲ型干扰素可快速分泌,从而抑制病毒复制,而Ⅰ型干扰素分泌较晚,强度较弱,并且由于其能调节炎症反应反而可能会加重病情[21-23]。
Ⅰ型干扰素和Ⅲ型干扰素都能激活JAK-STAT信号通路,但在功能上存在差异,两者存在差异的主要原因有:①特异性受体上的差异。Ⅰ型干扰素特异性受体IFN-AR1和IFN-AR2分布在所有有核细胞中,Ⅲ型干扰素特异性受体IFN-LR1主要分布在上皮细胞、血浆树突状细胞、肝细胞和B细胞等细胞的细胞膜上,由于受体表达的局限,Ⅲ型干扰素的副作用相对Ⅰ型干扰素更少,这就使得Ⅲ型干扰素拥有更广阔的研究价值和应用前景[24-25]。②通路上的差异。在经典通路中,Ⅲ型干扰素除了可以激活JAK1,还可以激活JAK2;STAT1、STAT2和STAT3均可参与Ⅰ型干扰素的信号传导,而Ⅲ型干扰素的信号传导只有STAT1和STAT2参与[26-27]。对于STAT3目前颇有争议,有研究表明STAT3是通过抑制依赖STAT1的相关基因的激活来负性调控Ⅰ型干扰素的信号通路,也有研究显示STAT3能促进Ⅰ型干扰素的抗病毒作用[28-29]。Ⅰ型干扰素形成STAT1同源二聚体促进IRF1的表达,进一步促进下游CXCL9、CXCL10和CXCL11的表达,进而使炎症趋化因子和中性粒细胞募集,诱导炎症反应[30]。而Ⅲ型干扰素不形成STAT1的同源二聚体,也没有IRF1的表达,即使理论上IFN-LR1过表达会介导炎症反应,但在类似IFN-LR1高表达的肠和肺等的组织中,Ⅲ型干扰素介导的炎症反应也轻于IFN-β,这是其炎症作用较少的原因之一[20,31-32]。③ISGs动力学上的差异。ISGs是经典通路的下游表达因子,包括MX1、IFITM、OAS等。Ⅰ型干扰素和Ⅲ型干扰素诱导产生相同的ISGs,但在动力学上存在差异,Ⅰ型干扰素诱导产生的ISGs可更早地达峰和下降,而Ⅲ型干扰素诱导产生的ISGs则作用相对更持久。这种差异主要与ISG15、USP18等负性调节ISGs相关[33-34]。④启动子的差异。在DNA损伤应答研究中发现,Ⅲ型干扰素启动子有NF-κB和IRF的结合位点,且NF-κB和IRF-3/7均可独立接受信号,而Ⅰ型干扰素启动子只有IRF的结合位点,故Ⅲ型干扰素的启动子较Ⅰ型干扰素更加灵活[35-36]。⑤病毒载量上的差异。有研究表明,病毒载量会决定宿主是由Ⅲ型干扰素还是Ⅰ型干扰素主导抗病毒的免疫应答[37]。低载量的流感病毒A感染时,主要由Ⅲ型干扰素产生免疫应答,且多位于局部黏膜上皮组织;高载量的病毒感染时,病毒大量复制和扩散,Ⅰ型干扰素参与免疫应答并促使中性粒细胞浸润和组织损伤。虽然Ⅰ型干扰素和Ⅲ型干扰素在很多方面都非常相似,但以上这些原因造成了两者在功能上的差异。
3 Ⅲ型干扰素在HPV阳性宫颈癌中的研究现状
3.1 HPV和宫颈癌
2018年全球宫颈癌发病人数为570 000例,病死人数为311 000例,宫颈癌是全球女性第四大常见癌症,是女性生殖道最常见的恶性肿瘤,也是发展中国家女性癌症死亡的主要原因[38]。根据2021年全球癌症统计,宫颈癌是20~39岁女性癌症死亡的第二大原因,尽管近几十年来宫颈癌发病率总体下降,但在很大程度上受疾病年轻化的影响,远期疾病和宫颈腺癌的发病率正在增加[39-40]。我国每年新增宫颈癌病例约14万,死亡病例约3.7万。宫颈癌好发于宫颈的鳞状上皮和柱状上皮交界处,多为鳞癌,其次是腺癌,腺癌常由于细胞学检查无法发现而漏诊。HPV感染与宫颈癌的发生密切相关,同时多个性伴侣、口服避孕药、吸烟、免疫力低下等也是宫颈癌发病的危险因素。HPV种类多样,能进展为宫颈癌的多为高危型HPV,如HPV16型、HPV18型、HPV31型、HPV35型、HPV39型等[41]。大部分HPV感染患者可在1年内通过机体免疫清除病毒,不超过10%的患者会持续性感染,最终部分发展成为宫颈癌[42-43]。HPV致癌的原因可能与致癌基因的激活、抑癌基因的抑制、HPV基因与宿主基因的整合、表观遗传修饰等相关[44]。HPV的早期转录区含编码病毒周期所必需的基因(E1~E7),并在细胞转化中起重要作用,其中E6、E7主要参与驱动细胞周期、免疫逃逸和病毒释放。HPV感染主要分为潜伏阶段和生产性阶段[45],潜伏阶段病毒感染未分化的角质形成细胞,因复制能力低,暂不向体内释放遗传物质,从而完成免疫逃逸[46];生产性阶段的E6、E7高表达,病毒DNA复制能力强,故在每个成熟的角质细胞中均有大量的病毒基因组存在。
3.2 Ⅲ型干扰素的研究现状
目前,在黑色素瘤、肺癌、肝癌、乳腺癌、前列腺癌、结肠癌、纤维肉瘤等肿瘤中发现,Ⅲ型干扰素通过抑制肿瘤细胞复制和有丝分裂诱导细胞凋亡、阻滞细胞周期、抑制血管增生,并作用于肿瘤微环境,直接或间接抑制肿瘤细胞的增殖和转移[34,47-52]。但Ⅲ型干扰素诱导机体发挥免疫作用的同时,机体的免疫会对其直接作用产生一定的抵抗,这会在一定程度上削弱Ⅲ型干扰素的作用,且有研究发现在犬的乳腺癌模型中,髓源性抑制细胞分泌的Ⅲ型干扰素可通过调节STAT3通路来促进血管生成、上皮向间质转化、肿瘤向上皮侵入和迁徙[53],故Ⅲ型干扰素在肿瘤中的作用尚存在争议,不同的肿瘤、同一肿瘤的不同分期以及不同宿主的免疫特征都可能导致其表达和作用存在差异。在HPV感染及进展到宫颈癌的过程中,Ⅰ型干扰素和Ⅲ型干扰素发挥的作用不完全相同。在不同细胞和组织、同一细胞和组织的不同发展阶段,两者的表达及作用有各自的特点,而在动物实验中则发现两者在功能上可能存在协同作用。Ⅰ型干扰素在HPV感染时会激活适应性免疫来控制感染,其作用十分重要但非常缓慢,且在上皮细胞和组织中会有损伤性的炎症反应。Ⅰ型干扰素在控制生殖道感染方面不能代偿Ⅲ型干扰素,Ⅲ型干扰素在上皮中抑制病毒的复制,而在固有层中IFN-α能更有效地抑制病毒的复制。除此之外,有报道称Ⅰ型干扰素在高危型HPV的感染中受到了抑制[54]。Ⅲ型干扰素在上皮的固有免疫过程中扮演了不可或缺的角色,不仅仅可以抗病毒,也可以作为前线防御机制。研究发现,低危型HPV感染的患者中,IFN-λ1的mRNA含量明显高于高危型HPV感染的患者以及未感染HPV的患者,IFN-λ2、IFN-λ3的含量呈中等程度升高,IFN-LR1和ISG15则与IFN-λ1有相同的趋势,而IL-10β表达水平相对恒定[54]。这足以证明在低危型HPV感染时IFN-λ1被激活且IFN-λ1的分泌随着病理恶化而降低。在宫颈癌小鼠模型中,IFN-λ1和IFN-λ4缺乏,IFN-λ3能较为明显地抑制肿瘤细胞增殖、增强NK细胞的细胞毒性及诱导细胞凋亡。而联合IFN-α和IFN-λ3作用于肿瘤模型小鼠,相比于单独使用任何一种干扰素,都呈现了更好的促凋亡及肿瘤抑制效果。其原因是在体外实验中加入了IFN-α后,增加了ISGs的种类和数量,进一步增强了NK细胞的细胞毒性,且相比单独使用IFN-α,两者的联合应用减少了IFN-α的使用剂量,从而减少了IFN-α带来的副作用,故使得小鼠的生存时间明显延长[41]。Ⅰ型干扰素和Ⅲ型干扰素的联合作用既能增强抗肿瘤的效果,也能在很大程度上减少Ⅰ型干扰素带来的副作用,若运用到临床上则有望改善患者的预后和生存质量。
4 重组干扰素α-2β的临床应用
目前,临床上主要将Ⅰ型干扰素(重组干扰素α-2β)用于HPV感染患者的治疗及宫颈上皮内瘤变患者行宫颈环形电切术的围术期干预。在宫颈环形电切术围术期使用重组干扰素α-2β可以提高转阴率,增加CD4+/CD8+的外周血水平,降低术后复发率,并下调高危型HPV的E6、E7和mRNA表达[55]。在HPV感染的患者中单一采用重组干扰素α-2β在短期内会获得一定的疗效,但部分患者容易复发,因此临床常将重组干扰素α-2β与抗生素[56]、胸腺肽α1[57]、柴胡解毒汤[58]、保妇康栓[59]等药物联用,以控制HPV的病毒载量,且取得了不错的疗效,相比于单一用药,联合用药的HPV患者转阴率、免疫球蛋白水平均更高。此外,重组干扰素α-2β联合乳酸杆菌也具有较好的效果,乳酸杆菌可以与重组干扰素α-2β相辅相成,使患者症状得以有效缓解,甚至可以逆转Ⅰ级宫颈上皮内瘤变。其主要原因是提升阴道内乳酸杆菌的含量可增强阴道的自净作用、调节微生态平衡,同时也有一定的抗感染作用。临床多局部使用重组干扰素α-2β,但也难以避免局部灼热、发热、瘙痒以及腰腹酸痛等副作用的发生,故Ⅰ型干扰素的使用仍存在一定局限,研究Ⅲ型干扰素在HPV患者及宫颈癌患者中的治疗作用具有重要意义。
5 总结与展望
宫颈癌的发病率和病死率在全球女性恶性肿瘤中都排名第四,HPV被公认为是宫颈癌发生的主要致病因子。HPV感染后产生了一系列免疫应答,其中Ⅲ型干扰素在前线防御中发挥着不可或缺的作用。目前临床应用较为广泛的是Ⅰ型干扰素,但由于其副作用较多而不能长期大剂量使用,故多为小剂量局部联合应用。Ⅲ型干扰素与Ⅰ型干扰素作用相似,但副作用更少,或将是治疗宫颈癌的一个新方案。但Ⅲ型干扰素的发现较其他类型的干扰素晚,其结构、特点和机制都尚未完全清楚,且目前研究发现其在肿瘤中的功能较复杂,对其研究面临着巨大的挑战,因此还需进一步了解和探究,才能为日后广泛应用于临床提供可能。
