利用Seahorse XF-96探讨不同细胞浓度和血清对线粒体功能的影响
2022-05-07李晓栩阳一栋周晓英王辰元杨诚忠陆军军医大学高原军事医学系高原生理学与病理学教研室极端环境医学教育部重点实验室全军高原医学重点实验室重庆400038重庆医药高等专科学校生理教研室重庆4033
李晓栩,崔 宇,阳一栋,周晓英,矫 力,王辰元,杨诚忠,史 诗,黄 缄 (.陆军军医大学高原军事医学系/高原生理学与病理学教研室/极端环境医学教育部重点实验室/全军高原医学重点实验室,重庆 400038;.重庆医药高等专科学校生理教研室,重庆 4033)
线粒体是一种存在于真核细胞内、具有双层膜结构的细胞器,是细胞进行有氧氧化和能量转换的主要场所[1],细胞生命活动所需能量的80%来自线粒体,因而线粒体也被喻为细胞的动力工厂。线粒体的功能研究对于了解细胞的能量代谢尤为重要,通过检测细胞的氧消耗量和三磷酸腺苷(adenosine triphosphate,ATP)生成量可以反映线粒体的呼吸功能[2-4]。以往通常采用Clark电极来检测线粒体的呼吸功能,但该方法需从完整的细胞中分离线粒体,无法保证线粒体的质量和数量,且需要使用大量的电池、电极、染料、放射性物质,并需要进行细胞裂解,具有很大的局限性。
细胞外流量检测仪Seahorse XF-96是一款通过检测细胞外流量分析线粒体有氧代谢、细胞代谢和糖酵解等的新型仪器,可以精准、实时测量活细胞和组织的能量代谢[5]。该仪器可利用光学传感器和特殊的微孔板设计,实现对耗氧率(oxygen consumption rate,OCR)和pH值的无创检测。细胞外酸化率(extracellular acidification rate,ECAR)和OCR可分别反映糖酵解和线粒体呼吸功能,从而快速评估细胞内线粒体的有氧代谢和糖酵解的能量代谢状态[6]。以往关于细胞浓度对线粒体功能影响的研究较少,研究者往往通过查阅文献,选择相应的细胞浓度或药物浓度进行实验,但在实际工作中,很多原代培养的细胞无可参考的细胞浓度,而是否进行细胞浓度的优化对研究至关重要;此外,在检测线粒体功能时,为了保持细胞活性,往往会在培养基中加入少量血清,但是血清是否会影响线粒体功能目前尚不清楚。因此,本研究拟利用Seahorse XF-96探讨不同细胞浓度和血清对线粒体功能的影响,以期为后续建立稳定的细胞模型提供依据。
1 材料与方法
1.1 仪器与试剂
20 μL、200 μL多道移液器(德国Eppendorf公司),电动吸液器(美国Axgen公司),细胞外流量检测仪Seahorse XF-96(美国Seahorse Bioscience公司),超净工作台(苏州金净净化设备科技有限公司),细胞培养箱(美国NUAIRE公司),37 ℃恒温培养箱(美国赛默飞世尔科技有限公司),细胞计数仪(美国Becman公司),纯水仪(美国Millipore公司),台式低温冷冻离心机(德国Eppendorf公司)。
U87细胞由美国国立卫生研究院国家癌症研究所提供,人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVEC)为高原生理学与病理学教研室保种,细胞线粒体应激试剂盒、XF-96 V3聚苯乙烯细胞培养微孔板、XF校准液、XF检测液等购自美国安捷伦科技公司,胎牛血清、DMEM高糖培养基购自美国Gibco公司,丙酮酸钠、葡萄糖购自德国Sigma公司,氢氧化钠购自上海国药集团化学试剂有限公司,盐酸购自济南大晖化工科技有限公司。
1.2 方法
检测原理:在实验中使用96孔检测板,检测板分为上下两部分,上部分带有传感器探针,探针上带有粉红色的荧光物质,可附着氢离子和氧气,探针中间是带有光纤的钢针,检测板下面放置铺有单层细胞的细胞培养板。当程序启动后,仪器会推动探针形成一个暂时的密闭微环境,可在这个微环境中测量氧气和pH值的变化;当探针进入培养基液面后,会在每个孔中形成2.28 μL的小室,从而实时检测氧分压和pH值的变化;当探针离开培养基液面,微环境又回到基线水平,可通过斜率计算OCR和ECAR。
细胞制备(实验前准备):取对数生长期的细胞,常规胰酶消化后制备细胞悬液,取1 mL细胞悬液用细胞计数仪进行计数,调整细胞浓度为1×105/mL,在XF-96 V3聚苯乙烯细胞培养微孔板中加入80 μL细胞悬液,浓度为2×103~8×103/孔,预留背景校正孔(A1、A12、H1、H12角落的4个孔)不接种细胞,依据细胞浓度分为2 000组、4 000组、6 000组和8 000组。细胞接种完后,于37 ℃、5% CO2的细胞培养箱中培养过夜[6-7]。
测试板水化:在实验前1 d每孔加入200 μL XF校准液,置于37 ℃恒温培养箱中水化过夜,以激活荧光探针。实验前调节XF检测液pH值至7.4,并置于37 ℃恒温培养箱中预热。
细胞换液:移除细胞培养板中的培养液,每孔用200 μL XF检测液清洗1次,去除XF检测液后再加入175 μL新鲜检测液,37 ℃孵育20 min。
药物稀释:选择细胞线粒体应激试剂盒,试剂盒中有寡霉素、解偶联剂、抗霉素A和鱼藤酮4种药物,药物浓度参考文献[8-10],实验前每孔加入25 μL XF检测液稀释药物[11]。检测线粒体的基础氧耗,然后在加药孔A中加入寡霉素抑制有氧氧化的H+传递,测定OCR与基础氧耗的差值,间接反映线粒体的ATP生成能力;在加药孔B中加入解偶联剂,测定线粒体最大呼吸能力和储备的呼吸能力(最大呼吸能力与基础氧耗的差值);在加药孔C中加入鱼藤酮和抗霉素A抑制线粒体的氧化呼吸链,测定质子漏(图1)。加入寡霉素后的OCR与加入鱼藤酮后的OCR差值即为非线粒体的氧耗,ATP生成能力与基础氧耗的比值即为偶联效率,最大呼吸能力与基础氧耗的比值即为线粒体呼吸潜力。
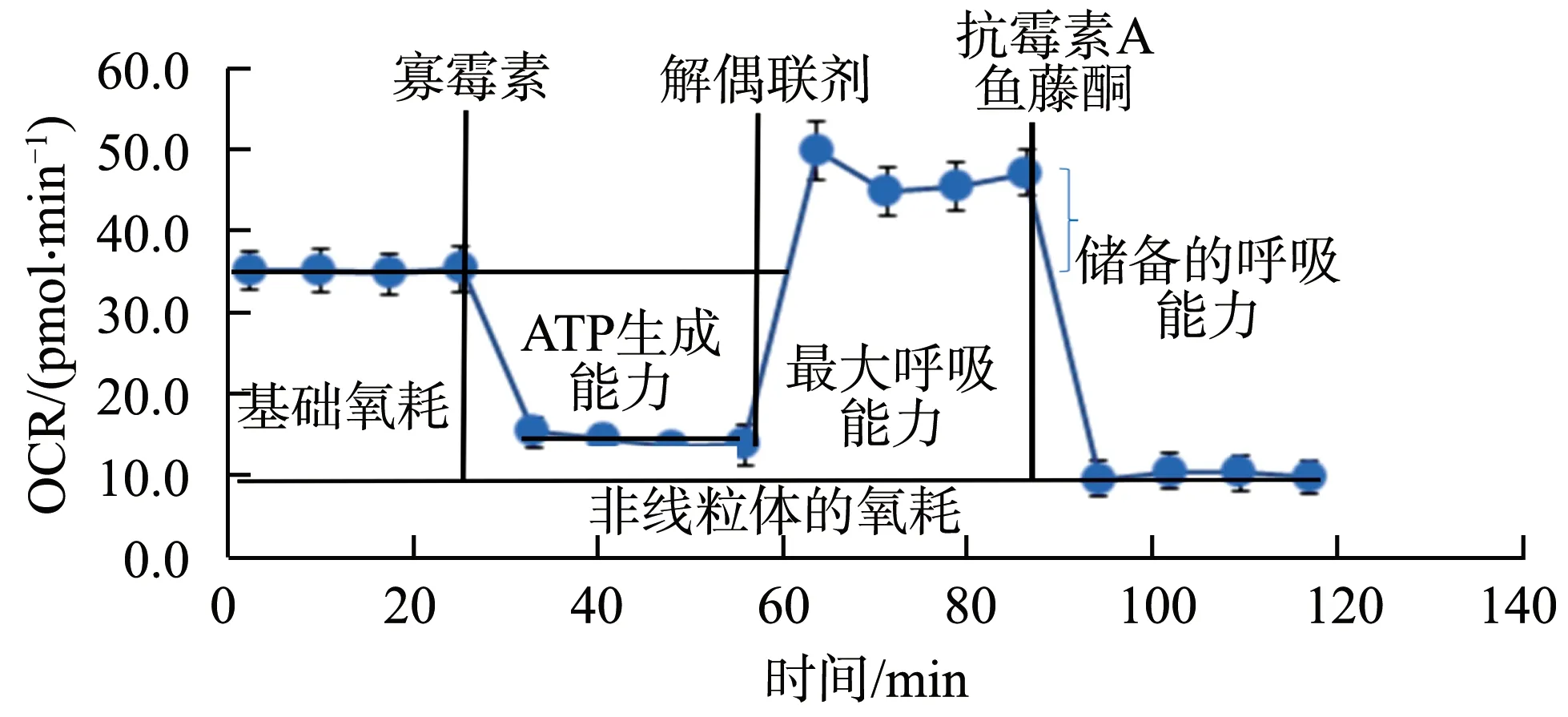
图1 线粒体OCR测定图
血清实验:HUVEC细胞悬液制备同上,调整细胞浓度为1×105/mL,在XF-96 V3聚苯乙烯细胞培养微孔板中加入80 μL细胞悬液,进行测试板水化、细胞换液等,分别使用含0.25%胎牛血清和无血清的培养基进行药物稀释,再分别加入浓度为2 μmol/L和5 μmol/L的解偶联剂,分为血清+低解偶联剂组、血清+高解偶联剂组、无血清+低解偶联剂组和无血清+高解偶联剂组。
仪器设置:打开Seahorse XF-96和软件,加载检测模板或使用新的模板,设置循环数、检测时间和药物混合时间,修改保存路径。
校正及检测:点击“Start”按钮后,将测试版放入检测仪中,仪器开始进行校正,10~15 min后仪器会自动弹出测试板,放入细胞板后仪器会按照预先设定的程序进行加药、混合和检测[8]。
1.3 观察指标
观察不同浓度U87细胞和HUVEC细胞对线粒体OCR和ECAR的影响;比较不同浓度U87细胞和HUVEC细胞对基础氧耗、储备的呼吸能力、最大呼吸能力、非线粒体的氧耗、质子漏、ATP生成能力、偶联效率和线粒体呼吸潜力的影响以及两种细胞上述指标的差异;观察血清对HUVEC细胞基础氧耗、储备的呼吸能力、最大呼吸能力、非线粒体的氧耗、质子漏、ATP生成能力、偶联效率和线粒体呼吸潜力的影响。
1.4 统计学方法
2 结果
2.1 细胞浓度对线粒体OCR和ECAR的影响
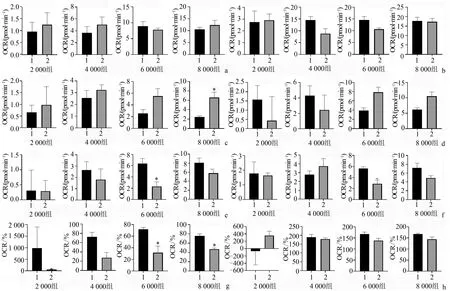
HUVEC细胞和U87细胞2 000组OCR显著低于4 000组、6 000组和8 000组(P<0.01);HUVEC细胞4 000组OCR与6 000组、6 000组与8 000组比较,差异无统计学意义(P>0.05),4 000组OCR显著低于8 000组(P<0.01);U87细胞4 000组OCR显著低于6 000组和8 000组(P<0.01),6 000组OCR与8 000组比较差异无统计学意义(P>0.05),见图2。HUVEC细胞和U87细胞2 000组的ECAR显著低于4 000组、6 000组和8 000组(P<0.01),4 000组显著低于6 000组和8 000组(P<0.01);HUVEC细胞6 000组和8 000组ECAR比较,差异无统计学意义(P>0.05);U87细胞6 000组ECAR显著低于8 000组(P<0.01),见图3。
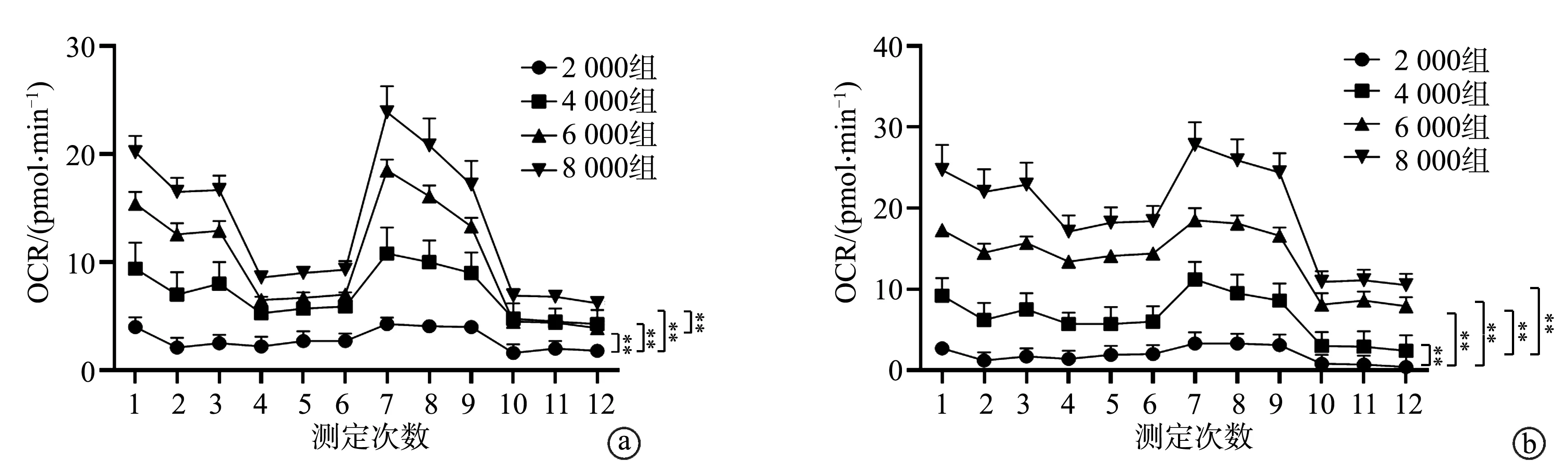
a:HUVEC细胞;b:U87细胞
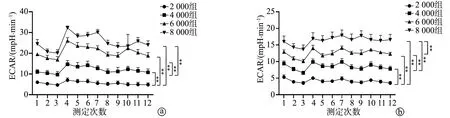
a:HUVEC细胞;b:U87细胞
2.2 细胞浓度对线粒体功能的影响
在HUVEC细胞中,与2 000组比较,6 000组和8 000组的基础氧耗、储备的呼吸能力、ATP生成能力和最大呼吸能力显著增强(P<0.05),2 000组与4 000组相比,差异无统计学意义(P>0.05);与2 000组比较,8 000组非线粒体的氧耗和质子漏显著增强(P<0.05),4 000组及6 000组与2 000组相比,差异无统计学意义(P>0.05);线粒体的偶联效率和线粒体呼吸潜力各组间比较差异无统计学意义(P>0.05),见图4。在U87细胞中,与2 000组比较,6 000组和8 000组的基础氧耗、非线粒体的氧耗和最大呼吸能力显著增强(P<0.05),2 000组与4 000组相比,差异无统计学意义(P>0.05);与2 000组比较,8 000组ATP生成能力、储备的呼吸能力和质子漏显著增强(P<0.05),4 000组及6 000组与2 000组相比,差异无统计学意义(P>0.05);线粒体的偶联效率和线粒体呼吸潜力各组间比较差异无统计学意义(P>0.05),见图5。
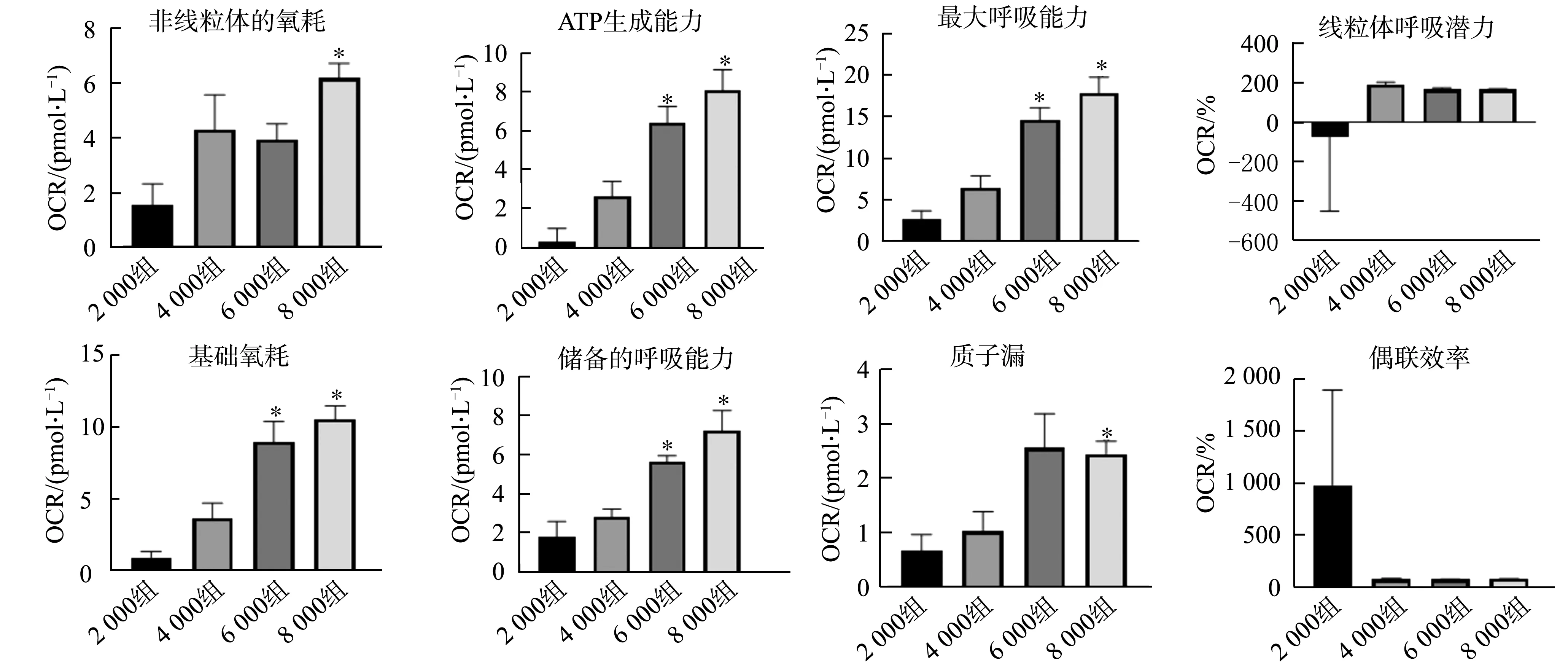
*:与2 000组比较,P<0.05
*:与2 000组比较,P<0.05
2.3 不同浓度下两种细胞线粒体功能的比较
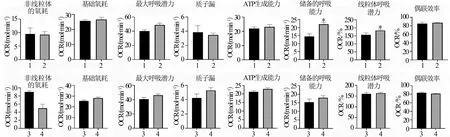
HUVEC细胞和U87细胞2 000组、4 000组、6 000组的质子漏比较,差异无统计学意义(P>0.05),U87细胞8 000组的质子漏显著高于HUVEC细胞(P<0.05);HUVEC细胞2 000组、6 000组和8 000组的偶联效率显著高于U87细胞(P<0.05);HUVEC细胞6 000组的ATP生成能力和储备的呼吸能力显著高于U87细胞(P<0.05);两种细胞各组间基础氧耗、最大呼吸能力、非线粒体的氧耗、线粒体呼吸潜力比较差异均无统计学意义(P>0.05),见图6。
a:基础氧耗;b:最大呼吸能力;c:质子漏;d:非线粒体的氧耗;e:ATP生成能力;f:储备的呼吸能力;g:偶联效率;h:线粒体呼吸潜力1:HUVEC细胞;2:U87细胞;*:与HUVEC细胞比较,P<0.05图6 不同细胞浓度下两种细胞线粒体功能比较
2.4 血清对线粒体功能的影响
血清+低解偶联剂组储备的呼吸能力和线粒体呼吸潜力显著高于无血清+低解偶联剂组(P<0.05),非线粒体的氧耗、基础氧耗、最大呼吸能力、质子漏、ATP生成能力、偶联效率组间比较差异均无统计学意义(P>0.05);血清+高解偶联剂组和无血清+高解偶联剂组的线粒体功能各指标差异均无统计学意义(P>0.05),见图7。
1:无血清+低解偶联剂组;2:血清+低解偶联剂组;3:无血清+高解偶联剂组;4:血清+高解偶联剂组 *:与无血清+低解偶联剂组比较,P<0.05图7 血清对HUVEC细胞线粒体功能的影响
3 讨论
以往研究仅单独对U87细胞和HUVEC细胞的线粒体OCR和ECAR进行分析,未对两种细胞进行比较。HUVEC细胞浓度有10 000/孔[12]、15 000/孔[13]、30 000/孔[14],U87细胞浓度有12 000/孔[15]或(20 000~30 000)/孔[16],不同研究结果差异较大。本研究对U87细胞和HUVEC细胞进行浓度优化,结果显示,随着细胞浓度的升高,线粒体的呼吸功能增强;当细胞浓度为2 000/孔时,HUVEC细胞、U87细胞的线粒体OCR和ECAR之间差异无统计学意义,而当细胞浓度为4 000/孔时,两种细胞的OCR和ECAR之间存在显著差异。这可能是由于细胞浓度过低容易使本身存在差异的数据被掩盖,出现假阴性结果。本研究的OCR和ECAR都不高,在后续的实验中,可以适当提高细胞浓度,选择8 000/孔或更高的细胞浓度,以期获得更高的OCR和ECAR,更准确地反映其对线粒体功能的影响。
细胞的线粒体OCR和ECAR分别反映了细胞的氧化磷酸化水平和糖酵解水平,不同细胞类型之间OCR差异较大,其代表着粒线体处于基础状态时的耗氧效率。有文献报道,U87细胞的ECAR较高,OCR相对较低,仅为20~80 pmol·min-1[15];而HUVEC细胞的OCR一般在50~200 pmol·min-1[13,17]。本研究结果显示,各组基础氧耗无统计学差异,且两种细胞的OCR都低于文献报道,这可能是由不同实验所使用的细胞浓度不同所致。U87细胞的OCR较低可能是由肿瘤细胞的Warburg效应导致,健康细胞依靠线粒体氧化糖类分子释放能量,而肿瘤细胞产生能量的方式比较特别,大多数肿瘤细胞是通过产能率相对较低的糖酵解作用为自身供能,不需要氧气及线粒体参与。因此,有学者推测这种变化的代谢是癌症发生的根本原因[15],对有氧代谢和糖酵解的调控也一直是癌症研究的重点。癌细胞一般具有高耗氧能力,但其在低氧环境中仍然能够生存,如高级别胶质瘤,尤其是胶质母细胞瘤,其特征是具有高速增殖的能力,U87细胞就是一种增殖速度相对较快的胶质瘤细胞系。较高的ECAR提示糖酵解的增加,U87细胞的主要能量代谢途径是糖酵解,而内皮细胞的线粒体含量较低,也主要通过糖酵解氧化葡萄糖,但具体机制还需进一步研究加以验证[18]。
本研究比较了HUVEC细胞和U87细胞在不同浓度时线粒体功能的变化,结果显示,当细胞浓度为2 000/孔、4 000/孔和6 000/孔时,两种细胞的质子漏无显著差异,而当细胞浓度升高到8 000/孔时,U87细胞的质子漏显著高于HUVEC细胞。解偶联剂可破坏三磷酸腺苷合酶的合成,将其加入到细胞的线粒体中可产生典型的质子漏。在生理情况下,线粒体质子漏的发生使得氧化磷酸化得到最优的偶联系数,从而使产热和氧化磷酸化这两个对机体十分重要的过程达到精确的平衡[19]。质子漏的耗氧对细胞呼吸具有很强的控制作用,同时质子漏也是重要的产热过程,且能引起线粒体内膜通透性改变的物质都可以影响质子漏。因此,HUVEC细胞和U87细胞质子漏的差异不仅与其本身的基础代谢有关,也反映了线粒体内膜通透性的差异。在实验中,我们加入解偶联剂用来测定细胞储备的呼吸能力,其为评估线粒体储备能力的一个极其稳定的功能参数,可反映线粒体满足超出基础水平的额外能量需求的能力,以应对急性细胞应激或沉重的工作负荷,灵敏度高[20]。本研究结果显示,U87细胞6 000组储备的呼吸能力显著低于HUVEC细胞,说明在应激情况下,U87细胞额外能量需求的能力不如HUVEC细胞,这可能是由于糖酵解并不是肿瘤细胞所特有的代谢表型,想要探寻这种差异的原因还需要更深入的研究。
在以往的实验中,为了防止细胞在无血清培养基中时间过长,往往会添加低浓度的血清为细胞提供营养,保持细胞活性,但血清的添加是否会对线粒体功能造成影响目前尚无相关文献报道。本研究通过在配制的药物中加入低浓度(0.25%)的血清,观察其是否会影响线粒体的呼吸功能,结果显示,血清仅对线粒体储备的呼吸能力和线粒体呼吸潜力产生影响,其余的线粒体功能指标未受影响,提示在测定线粒体呼吸功能时,血清对HUVEC细胞线粒体功能的影响较小,但在其他细胞中是否也有相似的结果还需进一步研究。此外,本研究中血清组和无血清组的线粒体功能在解偶联剂为5 μmol/L时均无显著性差异,说明当达到一定浓度后,持续增加解偶联剂的浓度不会增强线粒体的呼吸功能。
在荧光技术之前,线粒体呼吸功能测定主要利用Clark电极[21-23],这种氧分压测量的方法最为经典。但Clark电极主要适用于非黏附的细胞,如循环造血细胞或一些悬浮的肿瘤细胞等,其分析成本较低,但存在以下缺点:所需的样本量较大,在测定原代培养物、临床样品或干细胞时具有较大的限制;通量较低,一般只能检测1~2个样本;需要分离线粒体,不能直接进行检测,且样本检测后不能用于其他实验。而通过Seahorse XF-96,研究者能更快、更简易地了解细胞以及线粒体如何运用不同的物质作为能量来源,评估疾病与氧代谢和线粒体状态之间的相互作用,分析代谢调节药物的生理效应,快速筛选出具有开发潜力的药物及进行药物毒性评估等。目前,Seahorse XF-96已被广泛应用于药物筛选、药物转化、病理毒理、细胞生理、细胞代谢等热门研究领域,是进行细胞活力评价、药物药效评估、线粒体功能和代谢疾病分析等的有效手段[5]。
本研究总结实验的注意事项如下:①为保证结果的准确性和稳定性,建议每组设置3~4个复孔;以第1列和第12列作为空白和对照,防止边缘效应。②根据实验设计,细胞培养板需要在实验开始前提前准备,细胞需加入细胞培养板中培养过夜,如需额外加入药物,需提前种植细胞。③检测板上部带有传感器探针,荧光探针若失效会严重影响实验结果,应在有效期内使用,使用后可置于-20 ℃保存6个月。为了建立稳定、可靠的实验方法,得到真实、可靠、可重复的实验数据,在进行线粒体功能测定之前一定要查阅文献,若文献中没有所研究的细胞系,需要在实验开始前进行预实验摸索,选择合适的细胞浓度及解偶联剂、寡霉素、鱼藤酮和抗霉素A浓度,严格按照说明书进行实验。
综上所述,细胞浓度会影响线粒体OCR和ECAR,HUVEC细胞和U87细胞的质子漏和偶联效率存在显著差异,在后续的实验中,HUVEC细胞和U87细胞可选择8 000/孔或更高的细胞浓度,解偶联剂浓度使用2 μmol/L,在使用血清进行药物稀释时,充分考虑血清对线粒体功能的影响,以建立稳定的检测线粒体功能的方法。本研究对于药物浓度的摸索、实验条件的进一步优化没有过多涉及,有待在后续的实验中进一步完善。
