基于CTA的颈动脉斑块测量与急性缺血性卒中风险的相关性研究
2022-05-07王文静王忠睿重庆大学附属中心医院重庆市第四人民医院影像科重庆400010
王文静,吕 蕾,邓 铁,刘 军,王忠睿 (重庆大学附属中心医院/重庆市第四人民医院影像科,重庆 400010)
颈动脉斑块是导致急性缺血性卒中的重要原因。目前,国内外指南仍将颈动脉狭窄程度作为评估卒中风险的主要指标,并以此制定治疗方案[1-2]。近年来,随着医学影像技术的发展,除狭窄程度外,颈动脉斑块的形态和成分也成为了评估卒中风险的重要因素。研究表明,磁共振成像(magnetic resonance imaging,MRI)能清楚反映动脉管壁及管腔的情况,较准确地识别这些易损斑块[3-4],但具有采集时间长、存在伪影及一些禁忌证等特点,其在临床上尚未得到广泛应用。计算机断层血管造影(computed tomography angiography,CTA)是诊断颈动脉疾病的常规检查方法,用时少、费用低,减影后图像可避免周围骨质及钙化的干扰,多平面重建图像可从多平面、多角度显示管腔内外的情况[5]。研究显示,通过对CTA图像中CT值的测量能够识别易损斑块[6]。本研究通过对颈动脉斑块患者的CTA图像进行定量分析,探讨其与急性缺血性卒中的关系,以期为临床诊疗提供参考。
1 资料与方法
1.1 临床资料
回顾性分析2017年3月至2019年11月在我院行颈部CTA检查的颈动脉斑块患者的临床资料。纳入标准:年龄18~80岁;颈动脉颅外段粥样硬化斑块并狭窄率≥50%(中度以上狭窄);意识清楚,能配合完成CTA检查。排除标准:颈动脉闭塞;颈部血管畸形;造影剂过敏;合并肿瘤、感染等疾病。本研究经我院医学伦理委员会批准[2021年伦审第(11号)]。
1.2 分组
所有患者的CTA图像由1名具有15年经验的神经内科医生按照《中国急性缺血性脑卒中诊治指南2018》[7]进行独立评价,将在颈部CTA检查前3 d内出现急性缺血性卒中的患者作为症状组,检查前无任何缺血性卒中或短暂性脑缺血发作等缺血症状的患者作为无症状组。症状组仅纳入卒中侧颈动脉斑块,无症状组纳入符合标准的单侧斑块。最终纳入78例患者(78个颈动脉斑块),其中症状组33例,无症状组45例。收集2组患者的年龄、BMI、性别、吸烟史、合并糖尿病、合并高血压、合并高血脂、冠心病等临床资料。
1.3 扫描方法
采用GE Lightspeed-64 CT扫描仪进行标准扫描,扫描范围从主动脉至寰椎,自肘静脉以5 mL/s流速推注非离子型造影剂碘普罗胺注射液(370 mg/mL)60~80 mL及生理盐水50 mL;使用Smart prep技术监测主动脉弓感兴趣区域密度,当密度达到150 HU,开始扫描。扫描参数:管电压120 kV,采用自动管电流调制技术,层厚0.625 mm,层距0.625 mm,螺距0.938∶1,旋转速度0.5 r/s。
1.4 图像分析
将原始数据传入PACS后处理工作站,由2名具有10年以上经验的放射科医生采用盲法进行独立分析。在原始轴位图像上使用电子卡尺(精度0.1 mm)于垂直血管方向分别测量最大钙化斑块(≥120 HU)直径及最大非钙化斑块(<120 HU)直径(图1),并参照北美症状性颈动脉内膜切除术实验组标准测量颈动脉狭窄程度[8]。所有测量结果取2名观察者测量数据的平均值,并对2名观察者的原始测量数据进行一致性分析。
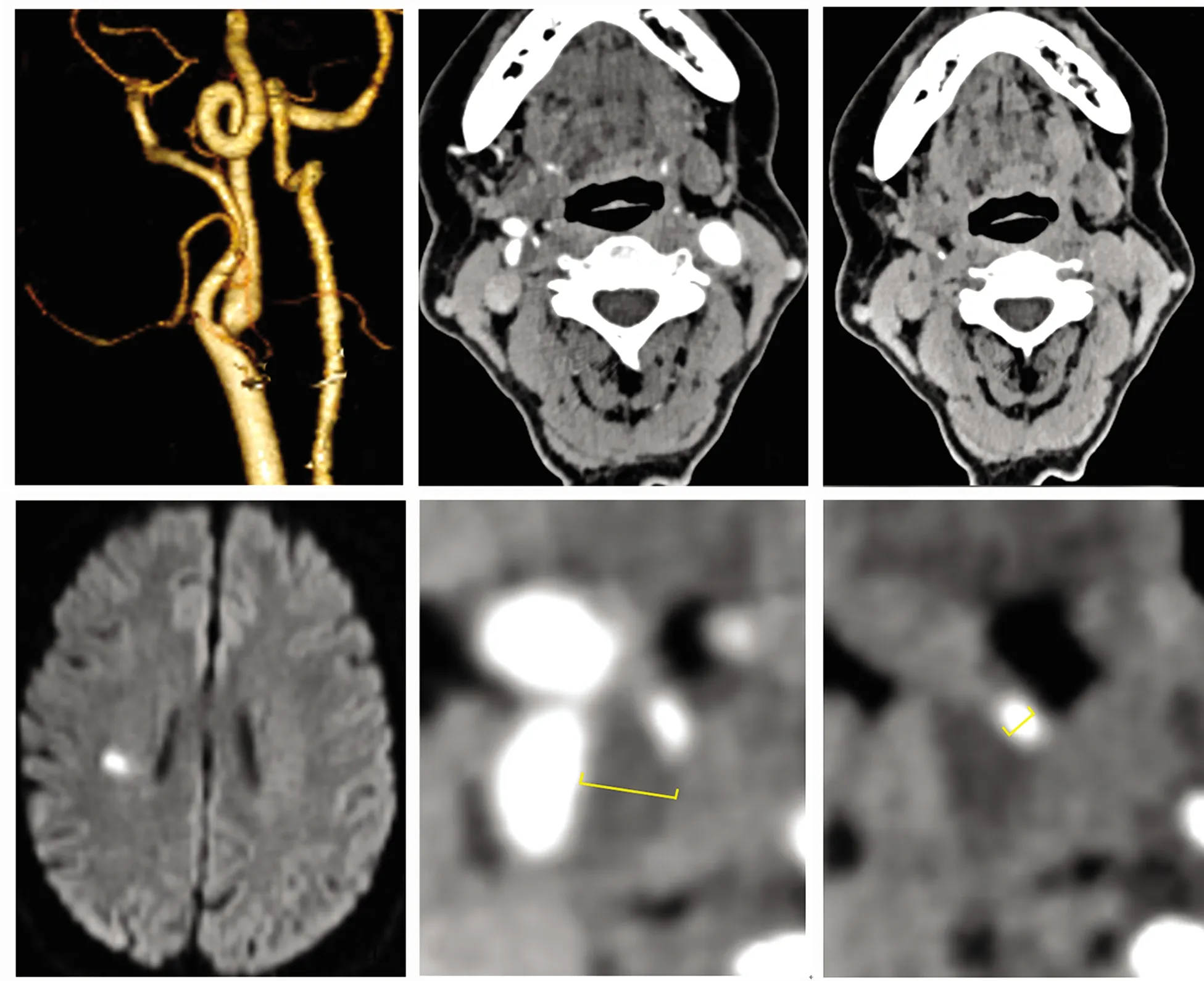
a:3D最大密度投影;b:CTA轴位增强图像测量最大非钙化斑块直径为4.6 mm(黄色标尺);c:CTA轴位平扫图像测量最大钙化斑块直径为1.7 mm(黄色标尺);d:MRI扫描DWI序列示右侧基底节区急性梗塞灶
1.5 统计学分析
2 结果
2.1 观察者间测量数据一致性检验结果
2名观察者对78个颈动脉斑块的动脉狭窄程度、最大钙化斑块直径及最大非钙化斑块直径测量结果的ICC值分别为0.93、0.96、0.91(P<0.05),提示2名观察者的测量结果具有较高的一致性,测量方法具有较好的可重复性。
2.2 单因素分析结果
单因素分析显示,2组患者年龄、性别、BMI、吸烟史、合并糖尿病、合并高血压、合并高血脂及动脉狭窄程度比较,差异均无统计学意义(P>0.05)。症状组冠心病发生率明显高于无症状组,最大非钙化斑块直径明显大于无症状组,最大钙化斑块直径明显小于无症状组,差异均有统计学意义(P<0.05),见表1。

表1 患者单因素分析结果
2.3 多因素分析结果
以单因素分析中有统计学意义的指标为变量,采用多因素Logistic回归分析分别建立模型1(CT测量数据模型,最大非钙化斑块直径+最大钙化斑块直径)及模型2(临床和CT测量数据综合模型,冠心病+最大非钙化斑块直径+最大钙化斑块直径)。模型1和模型2均显示,最大非钙化斑块直径增大是急性缺血性卒中的重要危险因素(P<0.05),OR值分别为4.411、4.442,见表2。ROC曲线显示,模型1和模型2的AUC分别为0.904、0.915(P<0.05),见图2。根据模型2构建列线图(图3),将冠心病、最大非钙化斑块直径及最大钙化斑块直径3个因素得分相加得到总分,根据总分可对应显示急性缺血性卒中发生的概率。
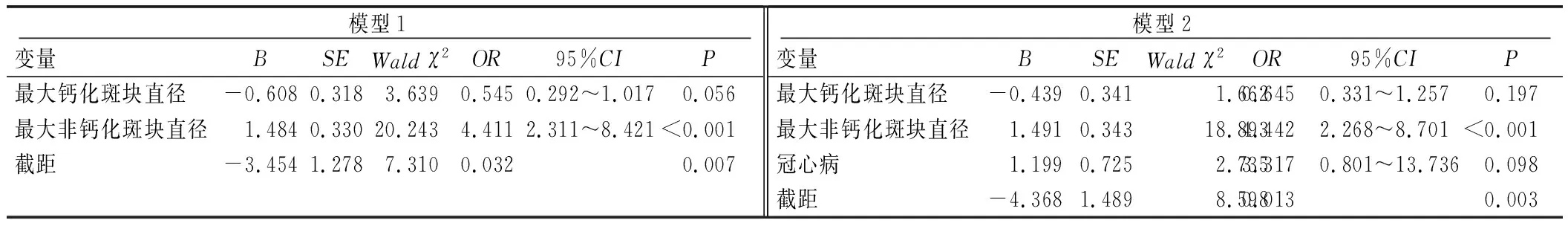
表2 患者多因素Logistic回归分析结果
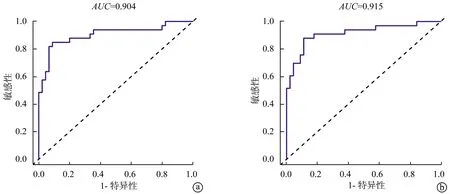
a:模型1;b:模型2

图3 模型2列线图
3 讨论
一项流行病学调查发现,全球范围内颈动脉粥样硬化斑块的发生率呈明显上升趋势,且以往研究已证实颈动脉粥样硬化斑块是急性缺血性卒中的重要危险因素[9]。目前的临床指南仍将颈动脉狭窄程度作为卒中风险分层的主要参考依据,认为只有中度以上狭窄才是手术的相对适应证。但随着研究的深入,这种观点越来越受到质疑。Perl等[10]发现,颈动脉粥样硬化斑块引起急性缺血性卒中的机制主要有两种,一种是斑块体积不断增大引起颈动脉狭窄,导致远端脑组织缺血,另一种是斑块破裂、出血或脱落引起远端栓塞,由于Willlis环的代偿作用,第二种机制才是颈动脉粥样硬化斑块导致急性缺血性卒中的主要原因。临床试验也发现,卒中风险与颈动脉狭窄程度无相关性,一些颈动脉重度狭窄的患者采用保守治疗也可以长期保持稳定;相反,一些轻度狭窄患者在早期即可出现卒中症状[11-12]。因此,近年来研究者们认为颈动脉斑块的形态和成分也是影响卒中风险的重要因素,识别易损斑块成为了当下的研究热点。
Yuan等[3]研究发现,采用MRI成像可以较为准确地识别颈动脉斑块内出血、富含脂质的坏死核心及纤维帽,且出现富含脂质的坏死核心、斑块内出血及纤维帽变薄或破裂可使卒中风险分别增加3倍、6倍和4.5倍。其主要机制为斑块内出血可使斑块体积迅速增大并突破变薄的纤维帽,使富含脂质的坏死核心暴露于血管腔内,直接释放栓子或诱发血栓,从而引起卒中。Trelles等[13]发现,在不同狭窄程度的颈动脉斑块上,基于CT发现的非钙化斑块与美国心脏协会基于MRI定义的Ⅵ型斑块具有高度的一致性,而Ⅵ型斑块正是由富含脂质的坏死核心、斑块内出血等共同构成的复杂高危斑块。由此推测,这些MRI定义的高风险成分在CT上大多以非钙化斑块的形式呈现。本研究基于CTA轴位图像测量最大非钙化斑块直径,经Logistic回归模型显示,最大非钙化斑块直径增大与急性缺血性卒中风险高度相关,且两个模型的OR值均大于4,即最大非钙化斑块直径每增加1 mm,则卒中风险增加超过4倍,间接印证了以上推测。此外,还有研究发现,颈动脉粥样硬化斑块内钙盐的沉积提示炎症细胞减少及斑块的机械稳定性增加,是相对稳定斑块的重要标志[14-15]。本研究发现,颈动脉最大钙化斑块直径与卒中风险呈负相关,与以上研究结果一致。但Li等[16]认为,钙化位置才是影响斑块稳定性的关键因素,其使用计算机模拟发现,邻近管腔纤维帽附近的钙化由于应力高度集中,可增加斑块破裂的风险,而远离管腔或位于脂质核心内的钙化对斑块的稳定性影响较小。因此,颈动脉斑块的成分及形态对卒中的影响还需进一步研究证实。本研究中年龄、糖尿病、高血压、高血脂等公认的卒中危险因素组间无统计学差异,可能与纳入的样本量小有关。
以往研究采用不同的CTA成像策略评估颈动脉斑块的易损性,但需要复杂的后处理软件或对CT值进行精确测量,导致结果具有较大的主观性及较低的可重复性[17-19]。本研究仅基于常规的CTA图像,对中度以上狭窄的颈动脉斑块进行最大钙化斑块直径及最大非钙化斑块直径的简单测量,具有较高的可重复性及实用性;且基于测量结果建立的急性缺血性卒中预测模型的AUC高达0.904,具有较好的预测效能;根据预测模型结果构建列线图,对结果进行预测并可视化展示,使其更具有可读性,有助于临床对急性缺血性卒中风险进行评估。但本研究也存在一些不足:样本量较少,且为横截面研究,导致无法对模型进行外部验证。希望在未来进行大样本量、多中心前瞻性的纵向研究,进一步探讨颈动脉粥样硬化斑块的动态变化对急性缺血性卒中的影响。
综上所述,最大非钙化斑块直径与急性缺血性卒中的发生风险呈正相关,基于CTA测量颈动脉粥样硬化斑块的直径能较好地预测急性缺血性卒中的发生风险。
