miR-483靶向调控DLC1对三阴性乳腺癌细胞增殖、迁移和侵袭的影响
2022-05-07李丕嵩陈宏甡程晓宇朱肖宇大连大学附属中山医院乳甲外科辽宁大连116000
李丕嵩,陈宏甡,程晓宇,朱肖宇 (大连大学附属中山医院乳甲外科,辽宁 大连 116000)
乳腺癌是全球女性中最常见的癌症类型,其发病率逐年增加[1]。三阴性乳腺癌是乳腺癌亚型中侵袭性最强的一种,其缺乏α-雌激素、孕酮和HER2(erbB2)受体的表达,特征是有丝分裂率高、淋巴细胞浸润增加、病理级别高和肿瘤体积大[2]。寻求有效的分子靶点对治疗三阴性乳腺癌具有重要意义。microRNA(miRNA)是一类长度为17~24个核苷酸的非编码RNA分子,可调节细胞分化、细胞周期进程和细胞凋亡[3],miRNA已被证明在机体致癌过程中发挥着重要作用[4]。最近有研究发现,IGF2基因座在第7个内含子中有1个miRNA,即miR-483,在肝母细胞瘤中IGF2与miR-483表达呈正相关[5]。有研究表明,miR-483可以作为各种癌症的潜在生物标志物[6-7],但miR-483表达升高影响癌症发展的机制目前尚不完全清楚。肝癌缺失基因1(deleted in liver cancer 1,DLC1)最初是作为一种潜在的肿瘤抑制因子被发现,其在肝细胞癌中表达降低,后续研究发现其在其他癌症中也存在表达降低或丢失,如在结直肠癌中miR-483表达的升高可以通过减少DLC1介导癌细胞的生物学行为[8]。目前尚未见miR-483在三阴性乳腺癌细胞中表达及作用机制的研究报道,因此,本研究通过研究miR-483对三阴性乳腺癌细胞的促癌作用并分析其潜在机制,旨在为三阴性乳腺癌的治疗靶点提供进一步的支持。
1 材料与方法
1.1 细胞复苏培养及分组设计
人MDA-MB-231乳腺癌细胞购自中国科学院生物化学与细胞生物学研究所,在Dulbecco改良的Eagle培养基(DMEM;美国Thermo Fisher Scientific Inc;批号:4152032.32)中培养,并补充10%胎牛血清(FBS;美国Thermo Fisher Scientific Inc;批号:BC-41563)、2 μmol/L谷氨酰胺(美国Thermo Fisher Scientific Inc;批号:BX-54896)、100 U/mL青霉素和100 μg/mL链霉素(美国Thermo Fisher Scientific Inc;批号:102363、365479)。所有细胞均于37 ℃、5%CO2的加湿培养箱中培养。
将细胞分为对照组、miR-NC组、miR-483 inhibitor组、miR-483 mimics组。对照组培养方法:将浓度为5×106/mL的MDA-MB-231乳腺癌细胞置于37 ℃、5%CO2、含10%FBS的DMEM中培养。miR-NC组、miR-483 inhibitor组、miR-483 mimics组培养方法:空白载体(miR-NC)、miRNA-483低表达载体(miR-483 inhibitor)、miRNA-483过表达载体(miR-483 mimics)均购自广州RiboBio,其载体序列分别为:5’-TGGCTAGCTGATCGA-TCGTAGCTAGCTAGCTAGCTAGCTAGTCGATCGATCG-3’;5’-TCGCGATCGATCGTAGCTAGCTAGCTAGTCGATCGAT-GCTAGCTG-3’;根据说明书将MDA-MB-231乳腺癌细胞接种在6孔板中至70%融合,并使用Lipofectamine 2000(美国Thermo Fisher Scientific Inc;批号:NB514896)分别转染miR-NC、miR-483 inhibitor(100 nmol/L)、miR-483 mimics(100 nmol/L),转染72 h后,采用逆转录定量聚合酶链反应(reverse transcription quantitative polymerase chain reaction,RT-qPCR)检测miR-483的表达。以上各组细胞每孔设6个平行样。
1.2 MTT法检测细胞活力及结晶紫染色检测细胞单克隆形成数目
转染72 h后,将各组MDA-MB-231乳腺癌细胞(1×104)置于37 ℃的96孔板中,再将20 μL MTT溶液(5 mg/mL)添加到每个孔中培养4 h。随后吸出DMEM,并向每个孔中加入150 μL DMSO。将96孔板置于振荡器上10 min,然后在MK-3酶标仪(美国Thermo Fisher Scientific Inc)上使用630 nm参考波长在570 nm处测定吸光度(absorbance,OD)值。细胞存活率=(处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)。
将各组MDA-MB-231乳腺癌细胞用0.25%胰蛋白酶消化成单细胞,并以4×105/孔的密度接种到6孔板中,24 h后将50个细胞接种于6孔板中继续培养2周。然后将细胞用结晶紫—福尔马林溶液染色10 min并计数。
1.3 流式细胞仪测定细胞凋亡水平
使用AnnexinV-FITC/PI细胞凋亡检测试剂盒(广州Best Bio生物科技有限公司;批号:415263)检测细胞凋亡水平。将MDA-MB-231乳腺癌细胞(1×106/mL)悬浮在100 μL的PBS中,根据说明书用AnnexinV-FITC/PI双染色15 min。使用FACSCalibur流式细胞仪(美国BD Biosciences)评估细胞凋亡情况,并使用ModFitLT 2.0软件分析结果。
1.4 Transwell小室测定细胞迁移与侵袭水平
使用24孔Transwell小室(孔径8 mm;美国BD Biosciences;批号:202032.6)测定细胞迁移与侵袭情况。在转染48 h后收集转染细胞,悬浮在不含FBS的培养基中,并以5×104/孔的初始密度接种在上部小室中。下室装有500 μL DMEM,其中含有20% FBS作为化学诱导剂。在37 ℃下孵育48 h后,用棉签小心去除未迁移的细胞。迁移后的细胞用95%甲醇室温固定15 min,0.1%结晶紫—福尔马林溶液室温染色15 min,用IX71倒置显微镜(日本Olympus Corporation)捕获细胞。
1.5 RT-qPCR测定细胞miR-483、DLC1 mRNA表达水平
使用TRIzol试剂(美国Thermo Fisher Scientific Inc;批号:5213.36)从细胞中分离总RNA。对于miR-483表达水平检测,使用SYBR®Green PCR试剂盒(日本Toyobo Life Science;批号:102302)在Applied Biosystems Realtime 7500序列检测系统(美国Thermo Fisher Scientific Inc)上进行RT-qPCR。引物序列如下:miR-483正向,5’-TCGCGATCGATCGATCGATCGTAG-CTAGCTAGCTAGCTAGC-3’,反向,5’-TGGGGGATCGA-TGTAGCTAGTCGATCGATCGATGCTAGC-3’;U6正向,5’-TGGCTAGCTAGTGGGCTAGCTAGTCGATCGATCGATCGATCGCC-3’,反向,5’-TGGTCGATCGATGCTAGCTAGC-TAGTCGATCGATCGATCGCTAGCTAGC-3’。对于DLC1 mRNA表达水平检测,使用PrimeScript RT试剂盒(大连Takara Biotechnology Co Ltd;批号:1203659.3)进行逆转录,然后使用SYBR Premix Ex Taq(大连Takara Biotechnology Co Ltd;批号:MC-320156)进行RT-qPCR。引物序列如下:DLC1正向,5’-TCGAGCT-AGTCGATCGATCGTAGCAC-3’,反向,5’-TGTCGAT-CGATCGTCGATCGATCGATC-3’;β-actin正向,5’-TGGCTAGCTAGCTAGCTGGGATCGATCGTAGCA-3’,反向,5’-GCTGATCCACATCTGCTGGAA-3’,将miR-483表达标准化为β-actin表达,使用2-ΔΔCq法分析相对表达水平。
1.6 蛋白印迹法测定细胞DLC1蛋白表达水平
使用含有蛋白酶抑制剂混合物(德国Mannheim;批号:NB-526363)的RIPA裂解液从转染的细胞中分离总蛋白质。用BCA蛋白测定法(美国Thermo Fisher Scientific Inc;批号:#3458965)测量总蛋白的浓度。在10% SDS-PAGE上分离等量的蛋白,然后转移到聚偏二氟乙烯膜(美国Bio-Rad Laboratories Inc;批号:415954)。聚偏二氟乙烯膜的非特异性结合位点用含0.1% Tween 20(TBST)的TBS溶液饱和。随后,将小鼠抗人单克隆DLC1一抗(1∶1 000;目录号:sc-276525;美国Santa Cruz Biotechnology Inc)和小鼠抗人单克隆GAPDH抗体(1∶1 000;目录号:sc-15696;美国Santa Cruz Biotechnology Inc)与聚偏二氟乙烯膜4 ℃孵育过夜。TBST洗涤3次后,将膜与相应辣根过氧化物酶偶联的二抗(1∶10 000;美国Santa Cruz Biotechnology Inc)室温孵育2 h,TBST洗涤3次,使用增强型化学发光试剂盒(美国GE Healthcare;批号:5202363)检测条带水平,DLC1相对蛋白水平被归一化为GAPDH。
1.7 统计学分析
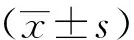
2 结果
2.1 MDA-MB-231乳腺癌细胞OD值、存活率比较
与对照组、miR-NC组比较,miR-483 inhibitor组OD值、存活率均降低(P<0.05),miR-483 mimics组OD值、存活率均升高(P<0.05);与miR-483 inhibitor组比较,miR-483 mimics组OD值、存活率均升高(P<0.05),见表1。

表1 MDA-MB-231乳腺癌细胞OD值、存活率比较
2.2 MDA-MB-231乳腺癌细胞单克隆形成数目、凋亡率比较
与对照组、miR-NC组比较,miR-483 inhibitor组单克隆形成数目减少、凋亡率升高(P<0.05),miR-483 mimics组单克隆形成数目增加、凋亡率降低(P<0.05);与miR-483 inhibitor组比较,miR-483 mimics组单克隆形成数目增加、凋亡率降低(P<0.05),见表2。
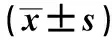
表2 MDA-MB-231乳腺癌细胞单克隆形成数目、凋亡率比较
2.3 MDA-MB-231乳腺癌细胞迁移能力比较
与对照组、miR-NC组比较,miR-483 inhibitor组穿膜数减少(P<0.05),miR-483 mimics组穿膜数增加(P<0.05);与miR-483 inhibitor组比较,miR-483 mimics组穿膜数增加(P<0.05),见表3、图1。

表3 MDA-MB-231乳腺癌细胞穿膜数比较
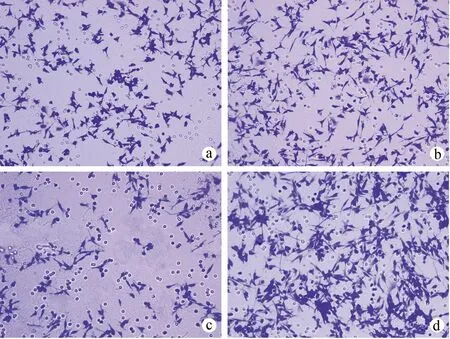
a:对照组;b:miR-NC组;c:miR-483 inhibitor组;d:miR-483 mimics组
2.4 MDA-MB-231乳腺癌细胞miR-483、DLC1 mRNA和蛋白表达水平比较
与对照组、miR-NC组比较,miR-483 inhibitor组细胞miR-483 mRNA表达水平降低、DLC1 mRNA和蛋白表达水平升高(P<0.05),miR-483 mimics组细胞miR-483 mRNA表达水平升高、DLC1 mRNA和蛋白表达水平降低(P<0.05);与miR-483 inhibitor组比较,miR-483 mimics组细胞miR-483 mRNA表达水平升高、DLC1 mRNA和蛋白表达水平降低(P<0.05),见表4、图2。
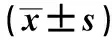
表4 MDA-MB-231乳腺癌细胞miR-483、DLC1 mRNA和蛋白表达水平比较
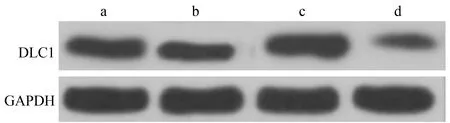
a:对照组;b:miR-NC组;c:miR-483 inhibitor组;d:miR-483 mimics组
3 讨论
三阴性乳腺癌具有较高的转移倾向和复发率,许多基因和蛋白已被证实在三阴性乳腺癌中表达改变,如表皮生长因子受体、血管内皮生长因子受体、拓扑异构酶Ⅱα[9]。到目前为止,一些标志物已被用于临床诊断及预后分析。然而,绝大多数现有的肿瘤侵袭和进展标志物尚未通过严格的临床前和临床测试。因此,寻找与三阴性乳腺癌相关的新靶点对于治疗三阴性乳腺癌意义重大。
miRNA通过与目标mRNA的3’非翻译区中的互补核苷酸序列相互作用,导致其目标mRNA的降解或翻译抑制,从而在基因表达中发挥重要作用。miRNA参与各种生物过程,包括发育、细胞增殖、细胞周期、细胞凋亡、分化、转移和对化疗药物的抵抗等[10]。基于此,miRNA可作为癌症诊断、预防和治疗的靶点。研究证明,miRNA的异常表达可影响人类乳腺癌的增殖、侵袭或转移,如与乳腺癌患者疾病特异性存活率降低显著相关的HER2和HER3(erbB3)可以被miR-125a或miR-125b抑制;miR-146a和miR-26a在三阴性乳腺癌中过表达,而miR-10b和miR-153与三阴性乳腺癌淋巴结转移的发生显著相关[11]。这些结果再次强调了miRNA在乳腺癌中的作用。miR-483干扰多种肿瘤的进展,可预测结肠癌的无远处转移生存[12]。此外,miR-483可在体内促进肝细胞癌的肿瘤增殖,同时上调抗凋亡蛋白Bcl-2和Bcl-xL的表达[13-14]。但miR-483在三阴性乳腺癌中的作用尚不清楚。本研究结果显示,与对照组、miR-NC组比较,miR-483 inhibitor组OD值、存活率降低,单克隆形成数目、穿膜数减少,凋亡率升高;miR-483 mimics组OD值、存活率升高,单克隆形成数目、穿膜数增加,凋亡率降低;与miR-483 inhibitor组比较,miR-483 mimics组OD值、存活率升高,单克隆形成数目、穿膜数增加,凋亡率降低,说明miR-483可促进三阴性乳腺癌细胞增殖、侵袭,并抑制其凋亡。
有学者在miR-483上游的2kb片段中检测到DLC1启动子活性,表明miR-483可能与由DLC1启动子驱动的DLC1基因共转录[15]。此外,miR-483和DLC1在肝癌组织中表达呈负相关[16]。因此,我们推测miR-483可能反向调节宿主DLC1的表达。据报道,DLC1可抑制多种肿瘤的发生发展,包括肾母细胞瘤、肝细胞癌、乳腺癌、膀胱癌、前列腺癌、结直肠癌等[17]。异常印迹或印迹丢失被广泛认为是DLC1抑制癌变的重要机制。有研究发现DLC1在三阴性乳腺癌中低表达,DLC1可以抑制癌细胞增殖,DLC1低表达标志着癌前病变向恶性癌的转变,雌激素受体阴性乳腺癌患者DLC1低表达预示着无复发生存率降低[18-19]。本研究结果显示,与对照组、miR-NC组比较,miR-483 inhibitor组细胞miR-483 mRNA表达水平降低,DLC1 mRNA和蛋白表达水平升高,miR-483 mimics组细胞miR-483 mRNA表达水平升高,DLC1 mRNA和蛋白表达水平降低;与miR-483 inhibitor组比较,miR-483 mimics组细胞miR-483 mRNA表达水平升高、DLC1 mRNA和蛋白表达水平降低。说明miR-483负向调控DLC1表达,同时也提示miR-483体外转染乳腺癌细胞可降低DLC1表达,抑制细胞增殖、迁移和侵袭。
综上所述,miR-483可促进三阴性乳腺癌细胞增殖、侵袭,抑制其凋亡;其机制可能与miR-483抑制DLC1的表达有关。本研究首次报道了miR-483对三阴性乳腺癌细胞的潜在促癌作用和机制,可为研究miR-483作为三阴性乳腺癌的治疗靶点提供进一步的支持。
