猕猴桃AdMSD1和AdMSD2的克隆及其在果实后熟软化中的表达
2022-05-06赖瑞联高敏霞吴如健陈义挺
冯 新 赖瑞联 高敏霞 吴如健 陈义挺,*
(1 福建省农业科学院果树研究所,福建 福州 350013;2 福建省落叶果树工程技术研究中心,福建 福州 350013)
植物细胞内活性氧产生与消除的动态平衡,是保证植物正常生长发育的重要基础。逆境或衰老等过程通常会导致活性氧的大量积累,产生氧化胁迫,加速植物的衰老死亡[1]。超氧化物歧化酶(superoxide dismutase,SOD)是植物活性氧清除系统的第一道抗氧化防线,主要负责清除细胞内产生的过量超氧阴离子自由基,保护细胞膜免受伤害,进而提高抗氧化能力[1]。根据辅基中金属离子的差异,植物SOD主要分为锰超氧化物歧化酶(manganese-SOD,MnSOD)、铜锌超氧化物歧化酶(copper/zinc-SOD,Cu/ZnSOD)和铁超氧化物歧化酶(iron-SOD,FeSOD)[2]。MnSOD作为SOD家族的重要一员,主要定位于线粒体,由核基因编码,其基因序列已陆续从落叶松[3]、芥菜[4]、香蕉[5]、丹参[6]、龙眼[7]、小麦[8]和非洲菊[9]等多种裸子植物和被子植物中鉴定得到。
诸多研究表明,MnSOD广泛参与植物的生长发育与衰老及非生物胁迫等逆境应答过程。单粒小麦MnSOD基因的表达在盐胁迫、氧化胁迫和重金属胁迫下显著上调[10]。紫杆柽柳MnSOD基因的异源表达亦表明,提高MnSOD表达量可以增加植株在盐胁迫、紫外线胁迫等逆境下的存活率[11]。过表达MnSOD基因的仙客来植株在高温胁迫下的SOD活性和可溶性蛋白含量升高,而细胞膜透性和丙二醛含量上升速度下降,对高温胁迫表现出更强的耐受性[12]。Zhou等[13]应用病毒诱导基因沉默技术将文冠果MnSOD沉默后,文冠果受精胚珠发育停滞,产生成熟果实的百分比降至约5%,说明MnSOD基因与受精胚珠和果实的早期发育密切相关。桃果实在采后衰老过程中,随着氧化胁迫加重,线粒体中MnSOD等多种抗氧化酶类的表达量及酶活性紊乱,导致活性氧积累,加速果实衰老[14]。
猕猴桃果实因富含多种氨基酸、矿质元素和维生素而深受消费者喜爱,但采后具有典型的呼吸跃变和生理后熟特点,因而易软化腐烂,不耐贮藏[15]。温度显著影响猕猴桃果实的后熟软化,因此低温贮藏是目前延缓猕猴桃软烂最常用和有效的保鲜手段之一[16-17]。脱落酸(abscisic acid, ABA)和赤霉素(gibberellin acid, GA3)等外源激素也显著影响猕猴桃的后熟软化进程[18-19]。多项研究显示,果蔬的采后衰老软烂与其细胞内活性氧代谢失衡密切相关,清除果蔬细胞内过多的活性氧,有利于保持果蔬品质和提高果蔬商品性[20]。宦晨[21]对桃果实的活性氧和抗氧化酶研究发现,超氧阴离子含量与SOD基因表达量和酶活性显著相关。猕猴桃果实采后酶活性研究表明,其SOD活性随着贮藏时间的延长呈先升后降的变化规律[22],但相关过程的编码基因及其表达规律的研究偏少,且其中多为Cu/ZnSOD基因相关研究[23],鲜有MnSOD基因的报道,限制了从基因与转录水平研究SOD与猕猴桃果实品质的关系。鉴于此,本研究以米良1号猕猴桃(Actinidiachinensisvar.deliciosaMiliang-1)为试材,在克隆验证AdMSD1和AdMSD2基因序列的基础上,对其序列特征、编码蛋白特性、密码子偏好性、调控miRNA、外显子与内含子组成及分子进化情况进行解析,并研究其在各组织器官、果实后熟软化过程、低温贮藏过程及脱落酸和赤霉素处理后的表达规律,以期为后续研究SOD在猕猴桃果实采后品质调控中的功能奠定基础。
1 材料与方法
1.1 试验材料
本试验使用的植物材料为米良1号猕猴桃,其根、茎、叶片、花、幼果(开花后16 d)和成熟果(开花后160 d)均于2018年采集自福建省农业科学院果树研究所猕猴桃种植基地,每样品随机从10棵树上分别采集,重复3次,经液氮速冻,保存于-80℃冰箱,作为基因克隆和组织表达特性分析材料。
参照福建省农业科学院果树研究所猕猴桃研究项目组前期的研究方法[24],以果实硬度、大小和可溶性固形物含量等相近的成熟果(开花后160 d)为材料,在25℃进行贮藏,在果实后熟软化的7个时期取样,分别为硬熟期(果肉硬度20.43±1.04 kg·cm-2、可溶性固形物含量6.92%±0.42%)、软化初期(果肉硬度17.72±0.79 kg·cm-2、可溶性固形物含量12.84%±0.31%)、软化Ⅰ期(果肉硬度13.40±0.76 kg·cm-2、可溶性固形物含量14.12%±0.44%)、软化Ⅱ期(果肉硬度7.13±0.34 kg·cm-2、可溶性固形物含量15.11%±0.21%)、软化Ⅲ期(果肉硬度3.84±0.33 kg·cm-2、可溶性固形物含量16.70%±0.34%)、软化末期(果肉硬度1.11±0.19 kg·cm-2、可溶性固形物含量17.68%±0.46%)和软烂期(果肉硬度0.42±0.10 kg·cm-2、可溶性固形物含量18.08%±0.38%),每样品随机取10个果实,重复3次。果肉样品经液氮速冻后于-80℃冰箱保存。
以成熟果(开花后160 d)作为试验材料,进行不同贮藏温度和激素处理,分别在4℃低温贮藏1、3、5、7、9和11 d进行取样,在25℃室温贮藏1、3、5、7、9和11 d进行取样,在浓度为50 mg·L-1的ABA溶液中浸润果实2 min后于25℃贮藏1、3、5、7和9 d进行取样,在浓度为50 mg·L-1的GA3溶液中浸润果实2 min后于25℃贮藏1、3、5、7、9和11 d进行取样。每样品随机取10个果实,重复3次,果肉样品经液氮速冻后于-80℃冰箱保存。
1.2 试验方法
1.2.1 总RNA的提取与cDNA的合成 按照天根生化科技(北京)有限公司的多糖多酚植物总RNA提取试剂盒说明书提取米良1号猕猴桃不同处理组样品的总RNA。分别运用1%琼脂糖凝胶电泳与UV-1800紫外分光光度计(美谱达,上海)检测RNA的完整性、纯度和浓度。再根据赛默飞世尔中国公司的RevertAidTMFirst Strand cDNA Synthesis Kit试剂盒说明书合成cDNA,作为AdMSDs克隆的模板;根据北京全式金公司的TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒说明书逆转录为cDNA,作为AdMSDs定量表达分析的模板。
1.2.2AdMSDs的引物设计与克隆 以锰超氧化物歧化酶作为检索词,在红阳猕猴桃(Actinidiachinensisvar.chinensisHongyang)基因组[25]中检索,获得相关候选序列,之后应用DNAMAN软件设计包含完整编码区的上下游引物,进行基因的反转录PCR(reverse transcription PCR, RT-PCR)验证,引物信息见表1。PCR反应液共25 μL:12.5 μL DreamTaqGreen PCR Master Mix(2×)、1 μL上游引物、1 μL下游引物、1 μL模板、9.5 μL无菌双蒸水。PCR扩增程序:94℃预变性4 min;94℃变性30 s,55℃(MSD1)/57℃(MSD2)退火30 s,72℃延伸60 s(MSD1)/40 s(MSD2),35次循环;72℃终延伸10 min。PCR扩增产物经回收和纯化后,委托福州尚亚生物有限公司测序。

表1 基因克隆引物
1.2.3AdMSDs的生物信息学分析 通过美国国家生物技术信息中心数据库的BLASTN、BLASTP和Conserved Domains工具分析猕猴桃与其他植物MnSOD的同源性和蛋白结构域。采用在线数据库ExPASy(http://web.expasy.org/protparam/)分析蛋白基本特性、ProtComp v9.0(http://linux1.softberry.com/berry.phtml?topic=protcomppl &group=programs&subgroup=proloc)进行亚细胞定位、MitoPro Ⅱ(https://ihg.gsf.de/ihg/mitoprot.html)查看线粒体运输肽分布、NetPhos 3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)预测磷酸化位点分布、SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)分析二级结构与三维空间结构。通过EMBOSS(http://www.bioinformatics.nl/cgi-bin/emboss)的chip和cusp工具分析AdMSDs基因编码区的有效密码子数、GC含量和密码子第三位的GC含量。应用psRNATarget(https://www.zhaolab.org/psRNATarget/)预测调控猕猴桃AdMSDs基因的miRNA,期望值设置为5.0,其他参数为默认值。采用Clustal X对猕猴桃和其他植物MnSOD蛋白序列进行多重对比,并利用MEGA-X软件的邻位相连法(Neighbor Joining)构建猕猴桃与其他植物MnSOD的系统进化树。采用GSDS 2.0(http://gsds.gao-lab.org/)工具分析AdMSDs基因的外显子与内含子组成。
1.2.4AdMSDs的实时荧光定量PCR分析 根据获得的AdMSDs序列,在DNAMAN软件上设计特异的实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)引物,引物信息见表2,并以表达相对稳定的猕猴桃Actin基因(基因编号为Achn107181)作为内参基因[26],参照北京全式金公司的TransStart® Top Green qPCR SuperMix试剂盒方法配置反应体系进行扩增,Eppendorf定量仪器的程序设定为:94℃预变性30 s;94℃变性5 s,59℃/62℃退火15 s,72℃延伸10 s,40次循环;最后在94℃ 15 s,60℃ 15 s,94℃ 15 s条件下熔解。程序运行结束后,通过 Mastercycler®ep realplex软件进行标准曲线、熔解曲线和样品Ct值分析。应用2-ΔΔCt公式计算AdMSD1和AdMSD2的相对表达量,通过SPSS软件的One-way ANOVA法进行AdMSDs表达量差异的显著性分析,最后在Excel 2016中进行图表的绘制。

表2 qRT-PCR引物
2 结果与分析
2.1 AdMSDs的克隆验证
以米良1号猕猴桃果实的cDNA为模板,分别利用上下游引物MSD1-F/MSD1-R和MSD2-F/MSD2-R进行RT-PCR扩增,得到2条长度分别为803 bp和717 bp的目的条带(图1),测序结果经BLASTN分析显示,2个基因与油柿(Diospyrosoleifera,JQ797740)、茶树(Camelliasinensis,KR189420)、葡萄(Vitisvinifera,KP271926)、白桦(Betulaplatyphylla,KP711292)和文冠果(Xanthocerassorbifolium,MG322616)等植物的锰超氧化物歧化酶基因具有很高的同源性(>82%),说明获得的2个基因均为米良1号猕猴桃锰超氧化物歧化酶基因,分别命名为AdMSD1和AdMSD2,GenBank登录号分别为KY471358和KY471359。编码框查找结果表明,AdMSD1包含675 bp的开放阅读框(open reading frame,ORF),共编码224个氨基酸;而AdMSD2包含690 bp的ORF,共编码229个氨基酸。
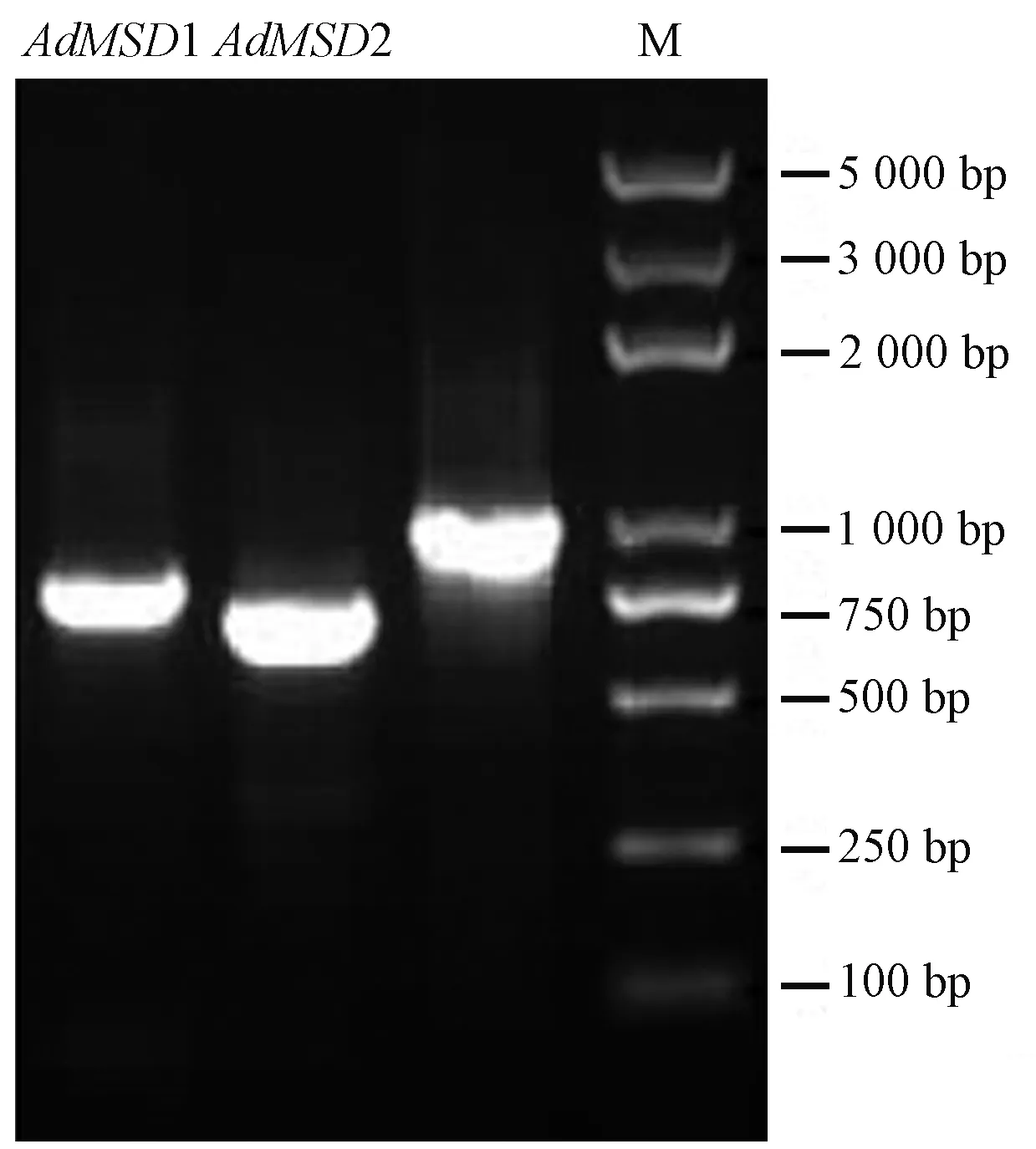
图1 AdMSDs的扩增结果
序列两两比对分析结果显示,AdMSD1与红阳猕猴桃同源基因Ach24g147991的ORF区核苷酸相似性为97.67%,氨基酸相似性为96.93%;AdMSD2与红阳同源基因Ach03g419431的ORF区的核苷酸相似性为99.13%,氨基酸相似性为100.00%。而AdMSD1与AdMSD2的ORF区的核苷酸相似性仅为85.65%,氨基酸相似性仅为83.84%。可见,猕猴桃MnSOD的不同成员在序列上存在较大差异,而不同品种间的同源MnSOD具有较高的一致性,说明同源MnSOD基因在猕猴桃种内具有高保守性。
2.2 AdMSDs的生物信息学分析
2.2.1AdMSDs编码蛋白的特性分析 结构域分析结果如图2所示,AdMSD1和AdMSD2均具有植物锰超氧化物歧化酶的3个保守结构域(SodA、Sod-Fe-C和PLN02471)。与其他植物MnSOD氨基酸序列的多重比对结果亦表明,2个编码蛋白均包含植物MnSOD的保守金属结合域“DVWEHAYY”、Mn2+金属结合位点和特征氨基酸(图3),说明猕猴桃AdMSD1和AdMSD2均具有锰超氧化物歧化酶的基本功能。

图2 AdMSDs蛋白的保守结构域

注:黑色阴影表示氨基酸序列的完全一致,灰色阴影表示氨基酸序列的一致性较低;Mn2+结合位点用井号(#)标示,MnSOD特有的5个氨基酸(甘氨酸、甘氨酸、苯丙氨酸、谷氨酰胺和天冬氨酸)用星号(*)标示,保守的金属结合域 “DVWEHAYY”用红色框标示。植物MnSODs的Genbank登录号:AtMSD(AAC24832),CsMSD1(AJW60327),CsMSD2(AJW60328),VvMSD(AKG51696),MeMSD(XP021618226),HbMSD(XP021687151),XsMSD(AVD97168),CjMSD(ADB10839),TaMSD1(AAB68035),TaMSD2(AAB68036),OsMSD(ATU90093)。
蛋白基本理化性质分析结果表明,AdMSD1和AdMSD2的分子量分别为24.95和25.55 kDa,理论等电点分别为8.81和8.39,总亲水性值分别为-0.328和-0.298,不稳定系数分别为39.23和37.20,所带正电氨基酸数均为24,所带负电氨基酸数分别为21和22,说明其均属于稳定的碱性亲水蛋白。亚细胞定位预测结果显示,AdMSD1和AdMSD2均定位在线粒体的可能性最大,分值分别为9.65和9.70;这与MitoProⅡ 分析显示2种蛋白的N端均具有一段分别为20和24 aa的线粒体运输肽相符。磷酸化位点分析结果显示,AdMSD1拥有17个潜在磷酸化位点,分别为丝氨酸磷酸化位点10个、苏氨酸磷酸化位点2个、酪氨酸磷酸化位点5个;而AdMSD2拥有22个潜在磷酸化位点,分别为丝氨酸磷酸化位点10个、苏氨酸磷酸化位点5个、酪氨酸磷酸化位点7个;说明AdMSD1和AdMSD2在翻译后水平的表达调控存在差异。AdMSD1蛋白的二级结构由50.89%的α-螺旋、12.95%的延伸链、7.14%的β-折叠和29.02%的自由卷曲组成;而AdMSD2的二级结构则由52.84%的α-螺旋、12.23%的延伸链、6.55%的β-折叠和28.38%的自由卷曲组成;这与三维空间结构的预测结果一致。
2.2.2AdMSDs的密码子偏好分析 EMBOSS分析结果显示,AdMSD1基因ORF区的有效密码子数为59.596、GC含量为49.19%、密码子第三位的GC含量为53.78%;AdMSD2的有效密码子数为61.000、GC含量为48.84%、密码子第三位的GC含量为52.17%。说明AdMSD1和AdMSD2基因对密码子的选择偏性较弱,其ORF区均倾向于选择A/T碱基,且密码子偏好以G/C结尾。
2.2.3 调控AdMSDs的miRNA预测分析 应用psRNATarget软件在猕猴桃果实miRNA数据库中分析调控AdMSD1和AdMSD2的miRNA。结果显示AdMSD1的表达受miR172a-5p、miR172b-5p、miR2586a和miR166j的调控,其中miR172a-5p、miR172b-5p和miR166j通过裂解AdMSD1转录本的方式调控其转录,而miR2586a通过抑制AdMSD1翻译的方式调控其表达。AdMSD2的表达则受miR172a、miR172c、miR166j和miR172c-3p的调控,其中miR172a、miR172c和miR172c-3p通过抑制AdMSD2翻译的方式调控其表达,而miR166j通过裂解AdMSD2转录本的方式调控其转录。
2.2.4AdMSDs的外显子与内含子组成分析 基因组的外显子与内含子组成如图4所示,AdMSD1和AdMSD2均由6个外显子和5个内含子组成,外显子大小均在47~289 bp,AdMSD1的内含子大小在94~1 735 bp,AdMSD2的内含子大小在85~726 bp。AdMSD1第1、第2、第3、第4和第6位外显子的长度与AdMSD2对应外显子的长度相同,分别为289、47、126、57和93 bp。此外,AdMSD1和AdMSD2的5个内含子均在GT-AG处发生剪接,符合真核生物的内含子剪接规律。

注:A: AdMSDs的基因结构。B: AdMSDs的外显子与内含子大小,内含子长度用括号标注,长度单位bp。
2.2.5AdMSDs的系统进化树分析 猕猴桃与其他植物MnSODs的系统进化树如图5所示,植物MnSODs共分为两大分支,分别是双子叶植物分支(组Ⅰ)和单子叶植物分支(组Ⅱ)。AdMSD1和AdMSD2均聚在双子叶植物分支(组Ⅰ)中,这与猕猴桃的种属分类一致。其中,AdMSD1聚在双子叶植物分支的a组(组I-a),与茶树MnSOD的亲缘关系近;而AdMSD2聚在双子叶植物分支的b组(组I-b),与金柑MnSOD的亲缘关系近;说明猕猴桃AdMSD1和AdMSD2属于植物锰超氧化物歧化酶家族的不同成员,可能起源于2个不同的基因祖先。

图5 AdMSDs与其他植物锰超氧化物歧化酶的系统进化树
2.3 AdMSDs在猕猴桃不同组织间的转录模式
qRT-PCR结果如图6所示,AdMSD1和AdMSD2在猕猴桃根、茎、叶、花、幼果和成熟果的转录水平存在明显差异。其中,AdMSD1在叶片的转录水平最高(是根部的46.89倍),其次是茎和幼果,而在根和成熟果中的转录水平较低,在花中的转录水平最低(仅为根部的0.14倍);AdMSD2则在花中的转录水平最高(是根部的9.52倍),而在叶片(是根部的2.51倍)、茎(是根部的1.81倍)、幼果(是根部的1.34倍)、根和成熟果(是根部的0.88倍)中的转录水平差异不显著。

注:不同字母表示显著性差异(P<0.05)。下同。
2.4 AdMSDs在猕猴桃果实后熟软化过程的表达特征
猕猴桃AdMSDs基因在果实采后从硬熟期至软烂期的表达模式存在差异(图7)。AdMSD1基因在猕猴桃果实后熟软化过程呈“升-降-升-降”的表达模式,即在软化初期表达显著上调,进入软化Ⅰ期和Ⅱ期时,表达量迅速降至硬熟期的0.39和0.35倍,在软化Ⅲ期时表达量再次升高至硬熟期相当水平,之后继续下降,软烂期时的表达量仅为硬熟期的0.41倍。AdMSD2基因在猕猴桃果实软化初期的表达量略升高,但不显著,在软化Ⅰ期和Ⅱ期时的表达量显著下降至硬熟期的0.65和0.35倍,进入软化Ⅲ期后,表达量显著升高至硬熟期相当水平,之后表达量变化不显著。

注:S1:硬熟期(对照);S2:软化初期;S3:软化Ⅰ期;S4:软化Ⅱ期;S5:软化Ⅲ期;S6:软化末期;S7:软烂期。
2.5 AdMSDs在果实采后贮藏过程中的表达特性
2.5.1 不同贮藏温度对果实AdMSDs表达的影响 进一步采用qRT-PCR分析室温和低温贮藏过程中AdMSDs基因的变化规律,结果如图8所示,AdMSD1在25℃贮藏1和3 d时表达显著下调,5 d时开始上调表达,9 d时的表达量达到最大值,为0 d的4.85倍,11 d时再次下调表达,仅为0 d的0.33倍;而AdMSD1在4℃低温贮藏前5 d的表达量均显著下降(仅为0 d的0.18~0.20倍),7 d时升高至0 d相当水平,之后继续下降至0 d的0.35倍以下;而且与对照(25℃贮藏)相比,AdMSD1在4℃贮藏各时间点的表达量均较低。与上述结果类似,25℃贮藏的猕猴桃果实中AdMSD2的表达量在1和3 d时下降,5 d时显著上升,7 d时达到最大值(为0 d的6.30倍),随后下调;4℃低温贮藏的猕猴桃果实中AdMSD2的表达量在前5 d均显著下降(为0 d的0.27~0.33倍),7 d时升高至0 d的1.31倍,之后继续下降至0 d的0.5倍以下;而且AdMSD2除了在4℃贮藏11 d时的表达量略高于对照(25℃贮藏11 d)外,其余时间点的表达量均比对照低。说明AdMSD1和AdMSD2在果实低温贮藏时表达下调。
2.5.2 不同激素处理对果实AdMSDs表达的影响 果实AdMSD1和AdMSD2在脱落酸和赤霉素处理后的表达模式不同(图8)。ABA处理后猕猴桃果实中AdMSD1表达呈“M”型,即AdMSD1在1 d时的表达量显著升高,3 d时下降至0 d的0.60倍,5 d时再次显著升高,之后下降至0 d的0.4倍以下;而ABA处理后猕猴桃果实中AdMSD2的表达持续下降。GA3处理后,猕猴桃果实中AdMSD1的表达呈下降趋势;而AdMSD2在处理后1 d时表达量显著升高,之后随着贮藏时间的推移虽有波动,但均低于0 d的表达水平。

图8 低温贮藏下和ABA、GA3处理后猕猴桃果实中AdMSD1和AdMSD2的表达
3 讨论
3.1 猕猴桃MnSOD家族的成员数量及其序列特征
不同物种拥有锰超氧化物歧化酶基因的数量存在差异,如黄瓜(Cucumissativus)仅有1个MnSOD基因(CsMSD)[27]、小麦(Triticumaestivum)有3个MnSOD基因(TaSOD2.1、TaSOD2.2、TaSOD2.3)[28]、香蕉(Musaacuminata)有4个MnSOD基因(MaMSD1A、MaMSD1B、MaMSD1C、MaMSD1D)[5]、芥菜(Brassicajuncea)有7个MnSOD基因(BjuAMSD1a、BjuAMSD1b、BjuAMSD1c、BjuAMSD1d、BjuBMSD1e、BjuBMSD1f、BjuBMSD1g)[29]。本研究从猕猴桃中共获得2个MnSOD基因(AdMSD1和AdMSD2)。多项研究表明,不同植物MnSOD基因数量的差异与其基因组经历的多倍化、全基因组重复及基因片段重复等事件相关[28-29],猕猴桃的MnSOD数量可能与其在进化过程经历的1次六倍化和2次全基因组重复事件相关[25]。与小麦MnSOD蛋白具有线粒体靶向序列相似[30],AdMSD1和AdMSD2蛋白的N端均含有一段20~24 aa的线粒体运输肽,这与其亚细胞定位结果相符;而且,与已报道的植物锰超氧化物歧化酶相同,AdMSD1和AdMSD2具有保守金属结合域“DVWEHAYY”、Mn2+金属结合位点和5个特征氨基酸,由此推测AdMSD1和AdMSD2蛋白主要在线粒体中行使活性氧清除功能。此外,AdMSD1和AdMSD2与拟南芥[5]、龙眼[7]、茶树[31]等多数植物的锰超氧化物歧化酶基因相同,均由6个外显子和5个内含子组成,推测植物MnSOD的基因结构具有较高保守性。但在系统进化分析中,AdMSD1和AdMSD2蛋白分别聚在双子叶植物组的不同分支,且其核苷酸和氨基酸序列存在差异,说明2种蛋白属于植物锰超氧化物歧化酶家族的不同成员,可能源自不同的基因祖先。
3.2 AdMSD1和AdMSD2在不同组织器官的表达差异
诸多研究表明,MnSOD基因在植物各组织器官广泛转录表达。茄子(Solamummelongena)SmMSD在根、茎、叶、花瓣、果皮和果肉中均有表达,但以叶片中的表达量最高,果肉中的表达量最低[32]。黄瓜CsMSD在叶片、花和茎中少量表达,而在根和果实中未检测到表达[27]。在香蕉中,4个MnSOD基因在根、假茎和叶中均有表达;其中MaMSD1A、MaMSD1C和MaMSD1D的表达模式相似,均在根部大量表达,其次是叶片,在假茎中的表达量最低;MaMSD1B则在根部的表达量最高,假茎中次之,叶中最低[5]。植物MnSOD各成员在不同组织器官的差异表达可能与其功能多样性和互补性有关。猕猴桃AdMSD1和AdMSD2与茄子SmMSD类似,在所有被检测的组织器官(根、茎、叶片、花、幼果和成熟果)均有转录,但AdMSD1在叶片的转录水平最高,在花中的转录水平最低,而AdMSD2在花中的转录水平最高,在成熟果中的转录水平最低。结合2个蛋白的分子进化不同、磷酸化位点的数量与分布差异、二级结构和三级结构的不同,推测AdMSD1和AdMSD2虽然参与清除猕猴桃各组织间的活性氧,但具体分工有差异,仍待后续进一步验证。
3.3 AdMSD1和AdMSD2参与猕猴桃果实后熟软化和采后贮藏品质的调控
植物MnSOD基因的表达受温度调控。非洲菊(Gerberajamesonni)GjMnSOD基因在4℃低温处理后的表达受到极显著抑制,且在各处理时间点的表达量均低于对照[9]。低温胁迫后,茄子SmMSD基因的转录显著下调,处理3 h的表达量降为对照的20%,之后一直保持该水平[32]。本研究中,果实AdMSD1和AdMSD2在低温贮藏的整个过程一直保持较低的转录水平,而在室温贮藏的5~9 d就显著上调并出现转录高峰。这与桃(Prunnuspersia)果实MnSODs基因(PpaSOD3和PpaSOD4)在低温贮藏下始终保持低表达水平[21]相似,也与猕猴桃Cu/ZnSODs基因(AdCSD1和AdCSD2)在低温和室温贮藏中的转录模式[23]类似。陈金印[35]对猕猴桃在低温和室温贮藏过程的SOD酶活性研究亦表明,低温贮藏过程中果实的SOD酶活性一直保持在较低水平,仅在贮藏后25 d出现小高峰,之后呈下降趋势;而室温贮藏过程中SOD酶活性上升快速,贮藏后10 d出现高峰,且峰值是低温贮藏的2倍。可见,不同温度贮藏下猕猴桃果实的SOD在转录水平和蛋白水平呈现相似的变化规律。前人研究表明,果蔬中活性氧的积累是导致其衰老和品质下降的主要原因之一[20]。宦晨[21]对桃果实的研究发现,超氧阴离子(活性氧种类之一)含量由SOD在蛋白和转录水平共同调控。而SOD催化超氧阴离子发生歧化反应,生成的产物H2O2是重要的信号因子。H2O2可以调控葡萄果实中细胞壁去乙酰化基因(GDSL)、细胞壁降解基因(XTH)等表达,影响果实的成熟[36];H2O2也参与番茄果实成熟相关基因ACO5、ACS6和多聚半乳糖醛酸酶基因PG的表达调控,影响果实的成熟软化[37]。与室温贮藏相比,猕猴桃果实在低温贮藏下的硬度下降缓慢,乙烯合成酶关键基因(ACO1和ACS1)和淀粉酶基因(BAM1和BAM3)等的表达受到抑制,果实软化减缓、耐贮性提高[16,38]。因而,猕猴桃果实在采后可能通过SOD(MnSODs和Cu/ZnSODs)等相关基因转录水平的改变,从而调控SOD等酶活性,参与果实后熟软化进程的活性氧清除,进而影响其采后软化速度与贮藏品质。
外源ABA和GA3调控植物MnSOD基因的表达。丹参(Salviamiltiorrhiza)SmMSD1和SmMSD3在ABA处理后表达下调,SmMSD2在ABA处理6 h时表达显著上调[6]。茶树(Camelliasinensis)CsMSD1基因在GA3处理后下调表达,在24 h时达最低值,而在48 h时显著上调表达[31]。相关研究表明,不同MnSOD基因成员在外源ABA和GA3处理后的表达差异可能与其启动子区的脱落酸响应元件ABRE、赤霉素响应元件GARE的差异有关[5-6]。ABA处理5 d显著诱导猕猴桃果实AdMSD1表达,抑制AdMSD2表达;而GA3处理抑制AdMSD1表达,在处理1 d时诱导AdMSD2表达。AdMSD1和AdMSD2对外源ABA和GA3的不同响应,是否与其启动子区所含响应元件的差异有关仍待试验验证。
4 结论
本研究克隆获得2个猕猴桃锰超氧化物歧化酶基因(AdMSD1和AdMSD2),2个基因编码的蛋白均具有植物MnSOD家族的基本特征,但聚类在进化树的不同分支,属于MnSOD家族的不同成员。AdMSD1在叶中的表达量最高,而AdMSD2在花中的表达量最高。AdMSD1和AdMSD2均参与猕猴桃果实后熟软化过程,且在低温贮藏的转录下调,2个基因在果实中的表达均受ABA和GA3的调控。
