Co2+活化过硫酸盐降解水中的磺胺甲噁唑
2022-05-05刘桂芳管威霆张玉平刘昱含
刘桂芳, 管威霆, 张玉平, 刘昱含, 熊 杰, 柳 威
Co2+活化过硫酸盐降解水中的磺胺甲噁唑
刘桂芳, 管威霆, 张玉平, 刘昱含, 熊 杰, 柳 威
(哈尔滨工程大学 航天与建筑工程学院, 黑龙江 哈尔滨 150001)
为了探究并优化钴离子(Co2+)活化过一硫酸盐(PMS)对水中抗生素的去除能力,以典型抗生素磺胺甲恶唑(SMX)为目标物,研究了反应体系对SMX的降解情况。考察了Co2+投量、SMX浓度、PMS投量、温度和pH等因素对SMX降解效能的影响,并对反应体系的总有机碳(TOC)和活性物种进行分析。结果表明,常温条件下,Co2+浓度为0.05mmol×L-1,PMS浓度为0.1 mmol×L-1,SMX浓度为0.01 mmol×L-1,pH为 3.0时降解效果最佳,当反应时间为30 min时,SMX降解率为62.3%,TOC去除率为47.7%。自由基淬灭分析表明,硫酸根自由基(SO4-·)是Co2+/PMS体系降解SMX的主导自由基。
磺胺甲噁唑;硫酸根自由基;钴离子;过硫酸盐;降解效能
1 前 言
磺胺甲恶唑(sulfamethoxazole, SMX)是一种广泛用于感染治疗的抗生素[1],仅部分能够被人体和动物代谢,大部分作为母体及其代谢物排出体外并且长期存在于环境水体中[2]。尽管SMX的生物蓄积效果不明显[3],但是细菌长期处于微量抗生素环境中会产生抗性基因,提高耐药性[4];并且导致人体内细菌之间的微平衡被破坏[5],进而引发人体代谢紊乱以及免疫学发育改变,更可能会出现人体长期肥胖和影响骨骼发育[6-7]。现有常规水处理工艺无法高效彻底地去除水中的SMX,若进入水体会对生态系统和人类造成威胁,如何有效处理抗生素废水,改善和解决水体中大量存在的抗生素对环境和人类造成的影响,已经成为一个亟待解决的问题。
各类高级氧化技术已经被广泛用于去除水中残留的SMX,例如芬顿,紫外/臭氧,电化学催化等[8-10]。这些都是基于羟基自由基的高级氧化技术,对比发现,硫酸根自由基具有更高的氧化电位(SO4-·为2.5~3.1 V,·OH为1.8~2.7 V)[11]和能适应更广的pH范围(pH=2.0~8.0)[11],另外,在特定条件下,硫酸根自由基具有更好的选择性和更长的半衰期[12-13](SO4-·为30~40 μs,·OH为20 ns[14])。研究表明,活化过一硫酸盐(peroxymonosulfate,PMS)体系对磺酰胺类抗生素具有很高的选择性[12]。在各类活化PMS方法中,过渡金属离子活化具有经济、高效和便于推广应用而成为研究热点,其中Co2+活化PMS的能力最强[15-16]。目前,Co2+/PMS体系已经被广泛用于降解农药[17]、染料[18]、个人护肤品[19]和内分泌干扰物[20]中,大量研究[17-20]表明Co2+/PMS体系能够有效降解难降解有机物,但关于Co2+活化PMS降解SMX研究未见报道。
本研究的主要目的是探究Co2+活化PMS体系(Co2+/PMS)对SMX的降解效能与矿化分析,考察不同参数(Co2+浓度、PMS投量、SMX浓度、pH和温度等)变化对SMX降解效能的影响和矿化进行分析,进一步结合自由基分析过程,探讨Co2+/PMS体系降解SMX的作用机理。
2 材料和方法
2.1 药品与试剂
过一硫酸氢钾(质量分数为99.999%)和磺胺甲恶唑(质量分数为99.999%)购自美国Sigma公司;硫酸钴(分析纯)、氢氧化钠(分析纯)购自天津市致远化学试剂有限公司;叔丁醇(TBA, 分析纯)购自天津市光复精细化工研究院;甲醇(MeOH,HPLC)购自天津市科密欧化学试剂有限公司;硫酸(分析纯)购自北京北化精细化学品有限责任公司;氮气(质量分数为99.999%)购自北京市亚南气体有限公司。所有化学试剂在使用之前不再进一步提纯,溶液均采用超纯水配制。
2.2 目标物降解方法
在铝箔包裹(避免PMS光解)的锥形瓶中加入0.01mmol×L-1的SMX、0.05 mmol×L-1的硫酸钴,体系初始pH=3.0,反应总体积为20 mL。反应前采用高纯度的N2吹脱体系15 min降低溶解氧对降解过程的影响,反应过程中采用低温恒温槽控制体系温度为(25±0.5) ℃并不断进行磁力搅拌,以加入0.1 mmol×L-1的PMS时刻为零点,按一定时间间隔取样并加入已备好的甲醇中,迅速终止反应。基于此方法进一步改变某一种体系参数,研究参数对目标物降解的影响。所有研究至少重复2次,图中的数据为平均值。
2.3 分析方法
SMX浓度由Waters Alliance e2695高效液相色谱仪(美国沃特斯公司)测定,流动相甲醇与0.3% 的甲酸体积比为(MeOH):(HCOOH)=30:70,进样时间为8 min,检测波长为265 nm,进样量为100 µL,体积流量为1.0 mL×min-1,柱温为30 ℃。
TOC分析采用Multi N/C 3100(德国耶拿公司)进行,水样分析前采用NaNO2终止反应。
3 结果与讨论
3.1 SMX的降解及TOC去除
Co2+是一种过渡金属离子,能够有效活化PMS产生氧化自由基降解有机物。为了考察Co2+/PMS体系对SMX的降解效果以及TOC降解能力,进行了Co2+/PMS氧化SMX动力学和TOC降解研究,SMX降解速率如图1所示,动力学反应具体参数:SMX初始浓度0(SMX)=0.01 mmol×L-1,PMS初始浓度0(PMS)=0.1 mmol×L-1,Co2+初始浓度0(Co2+)=0.05 mmol×L-1,初始反应温度=(25±0.5) ℃,pH=3.0。图中为反应时间,纵坐标(SMX)/0(SMX)为降解过程中SMX剩余浓度与SMX初始浓度的比值,其中SMX的降解率为1-((SMX)/0(SMX))。TOC降解速率如图2所示,具体参数:0(SMX)=0.01 mmol×L-1,0(PMS)=0.1 mmol×L-1,0(Co2+)=0.05 mmol×L-1,=(25±0.5) ℃,pH=3.0。图中(TOC)/0(TOC)为降解过程中总有机碳(TOC)与初始TOC质量浓度的比值,其中TOC的降解率为1-((TOC)/0(TOC))。
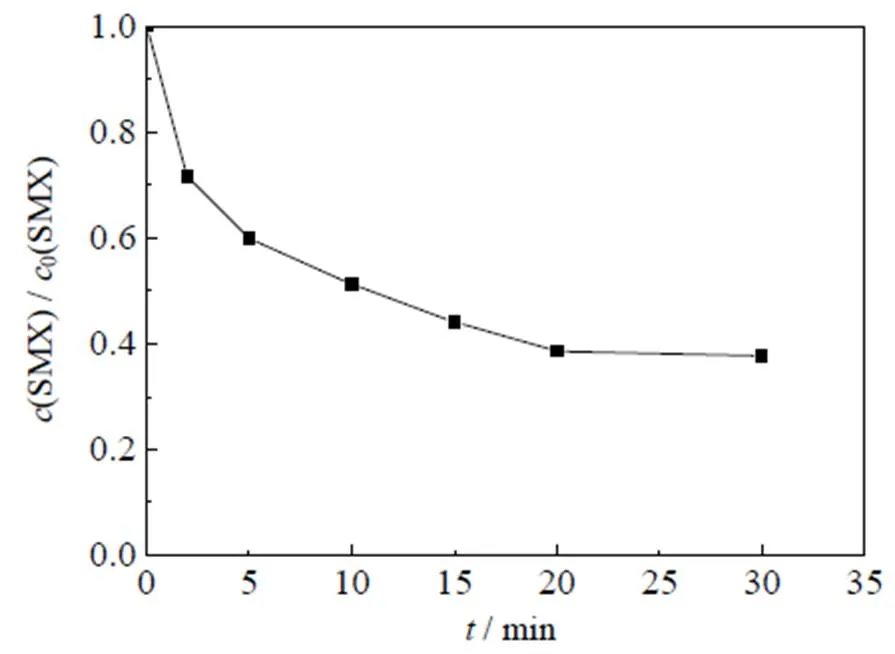
图1 Co2+/PMS体系氧化SMX的效能曲线
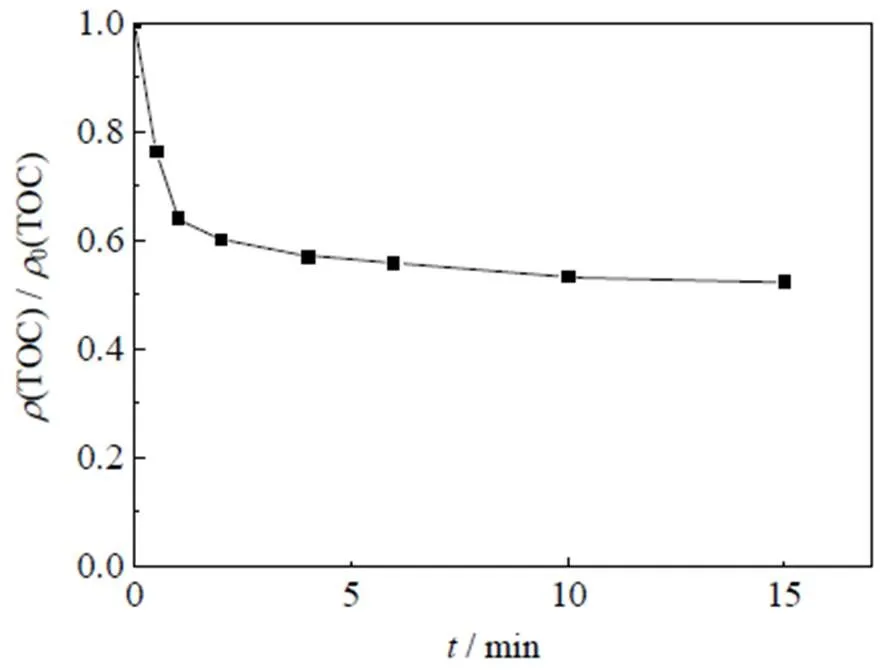
图2 Co2+/PMS体系氧化SMX的TOC降解曲线
由图1中可以看出,随着反应过程的进行,SMX的降解效能明显增加并趋于稳定,氧化2 min即可达到28.4% 的降解率,20 min后,SMX的降解率达到62.3%,这一降解过程可能是Co2+通过式(1)~(6)过程活化PMS产生了活性自由基[21],实现了SMX的快速降解。由式(1)~(6)可以看出,由于Co2+活化PMS的链式反应导致其良好的污染物降解效能,并且如式(3)、(4)、(6),Co3+和Co2+在反应过程中通过循环转化促进了Co2+的产生,从而进一步提高了SO4-·,·OH和SO5-·的产量。其中SO4-·和·OH可能是降解SMX的主导自由基[22-23]。
Kohantorabi等[24]研究金属氧化物/UV/PMS体系降解SMX时发现,降解过程中目标物被分解并产生大量脂肪酸化合物同时伴有CO2和H2O,这说明SMX降解过程中会产生一系列中间产物。从图2中可以看出,在反应开始的3 min内,SMX在Co2+/PMS体系中的TOC降解率急剧增加,随后逐渐趋于稳定,最终达到47.7%。一方面,这可能是由于部分已分解的SMX也并未被完全矿化,使得体系产生了一些中间产物,由于这些中间产物,导致TOC并不能完全去除[25]。另一方面,结合图1发现一部分SMX未被降解,这可能是由于体系中活性物种的数量限制,最终未能完全实现SMX的降解,也是目标物无法完全矿化的原因。
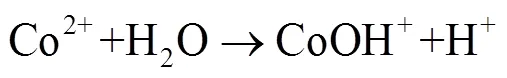
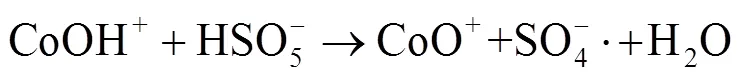
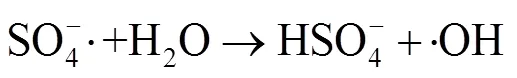
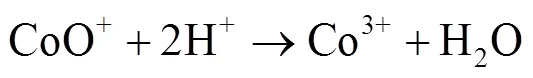
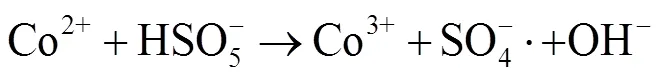
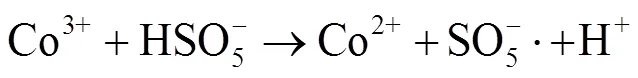
3.2 Co2+浓度影响
在Co2+/PMS体系中,Co2+浓度与活性自由基的产量之间存在重要联系,直接影响着体系SMX的降解效能,如图3所示。其中,反应初始条件:0(SMX)=0.01 mmol×L-1,0(PMS)=0.1 mmol×L-1,=(25±0.5) ℃,pH=3.0。
由图3中可以看出,随着Co2+浓度从0 mmol×L-1逐渐增加到0.05 mmol×L-1,降解率由10.4% 增加至62.3% (=30 min),但是继续增加Co2+浓度至0.07 mmol×L-1时,SMX的降解率却没有明显变化。出现这一变化趋势可能的原因是,低浓度下增加Co2+浓度会促使其与PMS碰撞,从而促进产出活性自由基,但是达到一定浓度后,Co2+浓度已经满足Co2+和Co3+的循环转化[26],所以继续增加Co2+浓度时SMX的降解率没有明显变化。Huang等[26]采用Co2+/PMS体系降解偶氮染料时得出了相同的结论。
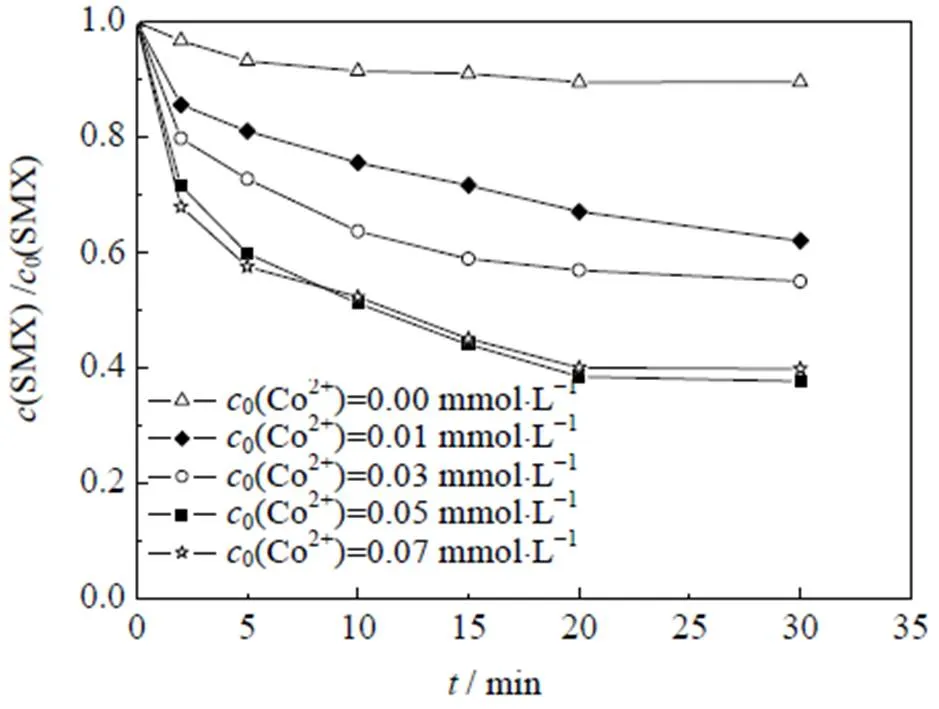
图3 不同Co2+浓度对Co2+/PMS体系降解SMX的影响
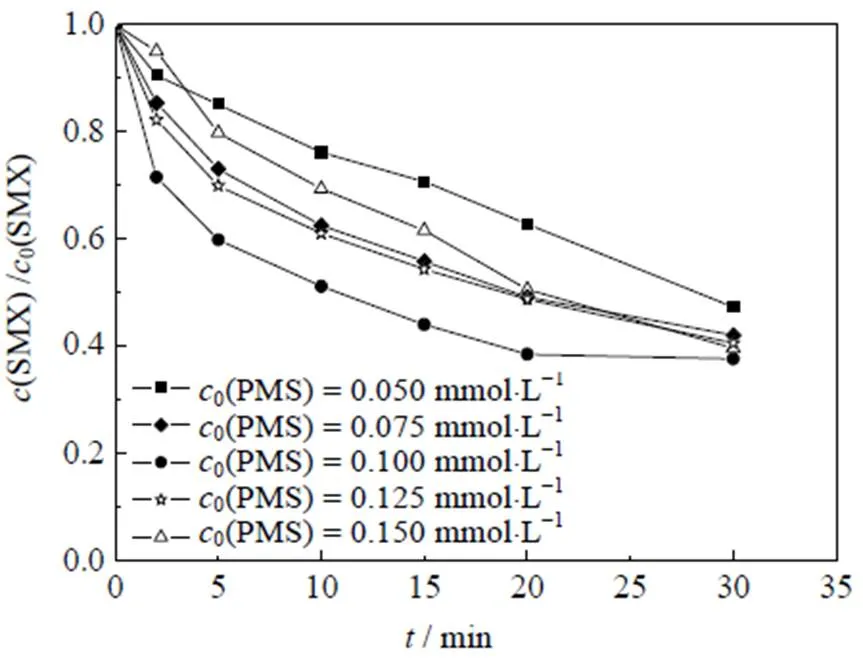
图4 不同PMS浓度对Co2+/PMS体系降解SMX的影响
3.3 PMS浓度的影响
在反应体系中,PMS的浓度直接决定活性自由基的产量,因此,探究不同PMS浓度条件下的SMX降解效能对Co2+/PMS体系的应用具有一定的指导意义,结果如图4所示。其中,反应初始条件:0(SMX)=0.01 mmol×L-1,0(Co2+)=0.05 mmol×L-1,=(25±0.5 )℃,pH=3.0,
由图4可知,在PMS/Co2+体系中随PMS的投加量由0.05 mmol×L-1增加到0.10 mmol×L-1,反应30 min内,SMX的降解率从57.2% 增加到62.3%,继续增大PMS投加量至0.15 mmol×L-1,SMX降解率明显下降。出现此现象可能原因是,当PMS投量增加时,反应体系中的活性物种也将增加,研究表明,活化过硫酸盐产生的SO4-·能够选择性氧化SMX的苯胺键[27],SO4-·产量增加使其可以在短时间内迅速占据活性位点[28],因此,SMX降解率能够迅速增加;继续增加PMS浓度会明显促使活性物种的产率,大量的活性物种可能会发生淬灭反应,从而降低去除污染物效率,如式(3)、(7)~(12)[29],这与Lai[30]等采用Co/Al2O3-EPM活化PMS氧化SMX体系和Yan[31]等采用PMS降解SMX体系的研究结果相似。
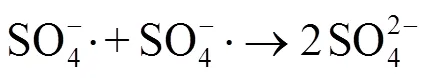
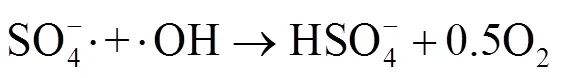
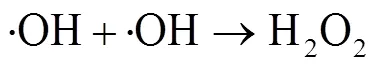
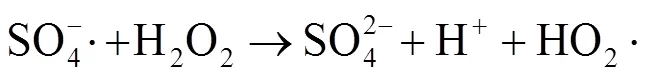
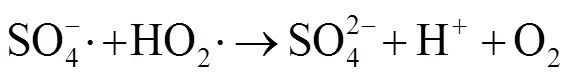
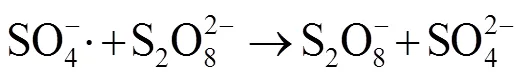
3.4 SMX浓度的影响
目标物初始浓度在高级氧化技术降解有机污染物的研究中占有重要地位,也是在工程降解时所关注的主要因素,其大小直接影响体系的降解效能,对于氧化还原反应,合适的反应物配比能提升反应物的转化率和反应速度。考察了体系中不同目标物浓度体系降解的影响,结果如图5所示。其中,反应初始条件为:0(PMS)=0.1 mmol×L-1,0(Co2+)=0.05 mmol×L-1,=(25±0.5 )℃,pH=3.0,
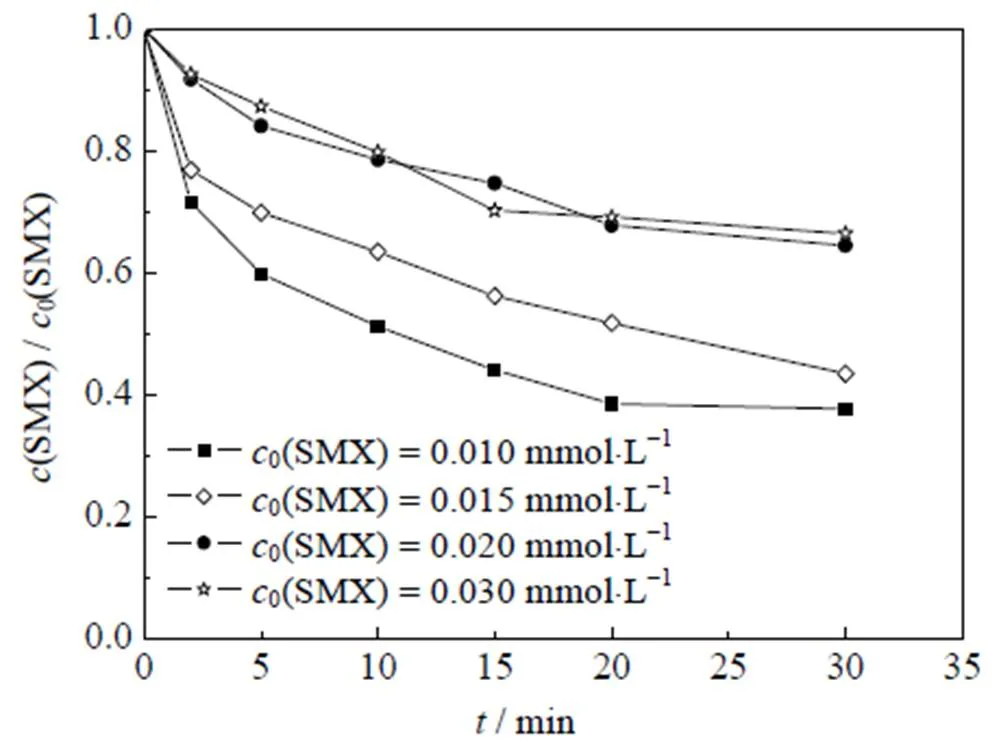
图5 不同SMX浓度对Co2+/PMS体系降解SMX的影响
从图5中可以看出,随着SMX浓度从0.01 mmol×L-1逐渐增加到0.02 mmol×L-1,降解率由62.3% 减少到35.5% (=30 min)。出现这一变化趋势可能的原因是,随着SMX浓度增加,在确定的PMS投量下,活性物种产量是一定的,SMX初始浓度增加会导致活性物种产量不足,致使降解率降低。然而,随着SMX的浓度增加至0.03 mmol×L-1时,降解率几乎不变。增加SMX浓度会提高其与活性物种的碰撞概率,导致活性物种加速占据活性位点[28],从而减少了活性物种之间发生的淬灭反应(如式(7)~(12)),提高了目标物的去除率[32]。
3.5 温度的影响
氧化体系温度的改变不但可以影响扩散传质,还可能强化催化氧化过程活性自由基的释放,从而影响体系对目标污染物的降解效能。如图6所示为不同温度下Co2+/PMS体系中SMX的降解情况。其中,反应初始条件:0(SMX)=0.01 mmol×L-1,0(PMS)=0.10 mmol×L-1,0(Co2+)=0.05 mmol×L-1,pH=3.0。
从图6中可以看出,随着温度的升高,催化剂的活性显著提高,当温度由15 ℃升高到55 ℃时,降解率从4.3% 增加到93.9%,这与Zhou等[33]研究钴负载多孔碳催化PMS降解喹克拉雷克时的温度影响结果相似。产生这一现象的原因可能是,温度的升高加快了分子的布朗运动,增加了活性分子间的碰撞几率,进而促进污染物的降解;另一方面,较高的体系温度能在一定程度上降低PMS分解的活化能[34],强化PMS的过氧键断裂,产生更多的活性物种(如式(13))[25],从而提高体系对SMX的降解效能。研究表明,温度的升高能够显著增加体系对SMX的降解效能,本研究中SMX降解在=55 ℃条件下最佳,但是实际医疗与制药废水中的温度普遍为常温,结合研究与实际处理废水能耗情况,本研究在温度为25 ℃下开展。
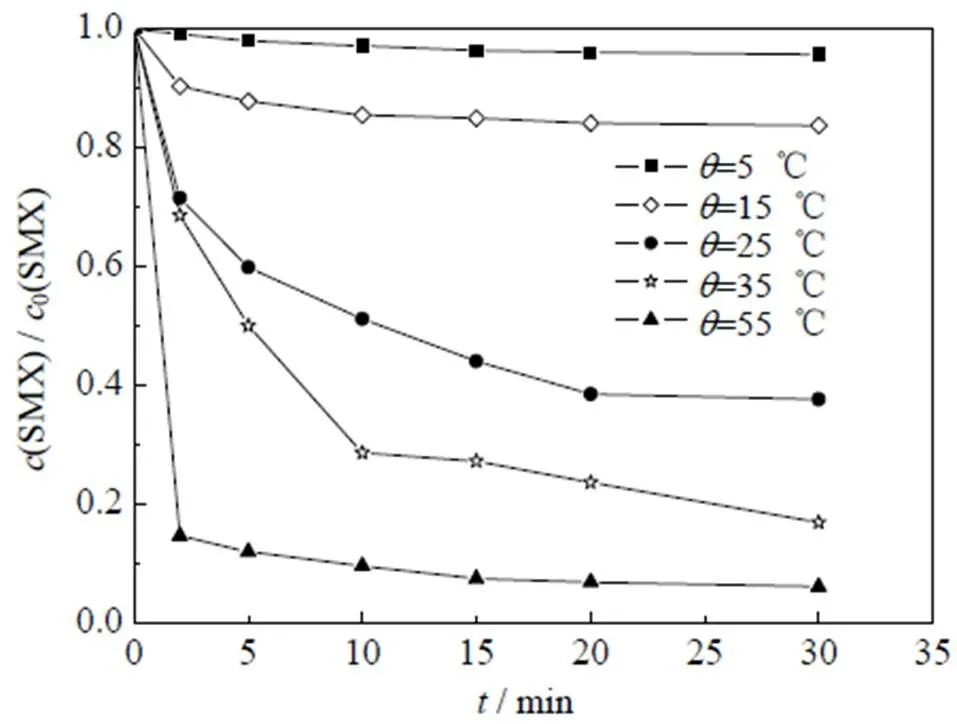
图6 不同温度对Co2+/PMS体系降解SMX的影响
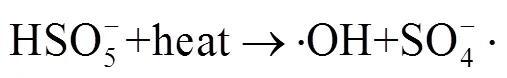
3.6 pH的影响
通常催化氧化体系pH的改变会影响物质的存在形态、催化剂的活性和主导活性物种的改变,考察了体系pH值改变对目标药物SMX的降解效能影响,结果如图7所示。其中,反应初始条件:0(SMX)=0.01 mmol×L-1,0(PMS)=0.10 mmol×L-1,0(Co2+)=0.05 mmol×L-1,=(25±0.5) ℃。
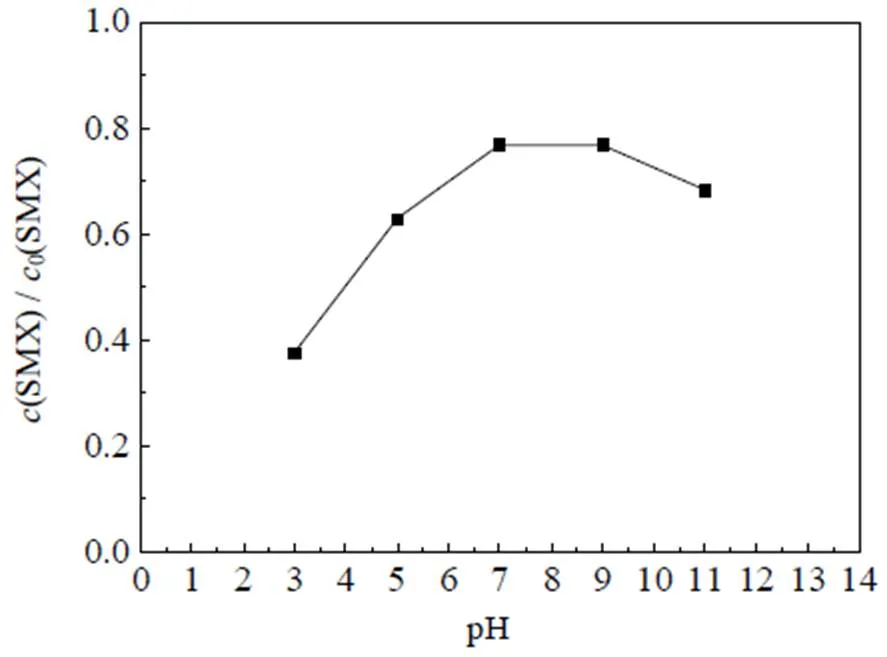
图7 不同pH值对Co2+/PMS体系降解SMX的影响
从图7中可以看出,当pH=3.0时,SMX降解率最高,达到了62.3%,随着pH由3.0增加至9.0,降解率逐渐降低至23.1%,pH进一步增加至11.0,降解率又逐渐增至31.6%。研究表明,酸性条件下体系对SMX降解效能较好,可能是由于Co2+在酸性溶液中活性较高[35],能够活化PMS产生更多的活性物种,并且酸性条件下主导的活性物种为SO4-·(pH<5时更稳定)[35],能够选择性氧化SMX[27],促进SMX降解;同时,在pH=3.0的条件下,SMX电离产生的碱性氨基(─NH2,一级酸解离常数pa1=1.85)含量较多,有利于SMX的降解[36]。当pH增加至9.0时,Co2+的活性逐渐减弱,SMX电离的碱性氨基逐渐变为释放质子的酸性酰胺基(─NH─,二级酸解离常数pa2= 5.60)[36],不利于SMX的降解。当pH值继续增加至11.0,Co2+发生沉淀,逐渐失去了活化PMS的能力[35],反应体系中生成的SO4-·(2.5~3.1V)也将会被转换为氧化电位较低的·OH(1.9~2.7 V)(如式(18))[37],抑制SMX降解;然而,研究表明,强碱条件可以促进PMS分解产生超氧自由基O2·-与氢过氧自由基HO2·(如式(14)~(18))[38],这些自由基能够促进SMX降解,综合作用结果使得pH=11.0时,SMX的降解效率有所增加,Anipsitakis等[15]研究Co2+/PMS体系降解阿特拉津时也得到了相同的结论。
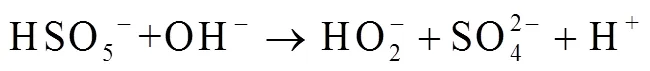
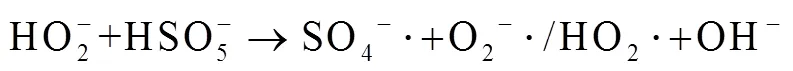
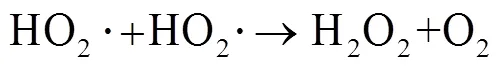
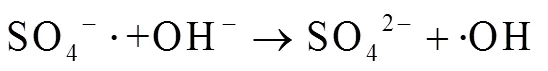
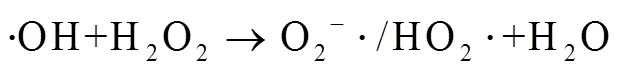
3.7 体系自由基分析
活性物种直接决定催化氧化体系目标污染物的降解效能,本研究采用醇抑制体系,考察了Co2+/PMS体系降解SMX的主导活性物种,结果如图8所示。其中,反应初始条件:0(SMX)=0.01 mmol×L-1,0(PMS)=0.10 mmol×L-1,0(Co2+)=0.05 mmol×L-1,0(MeOH)=0.2 mmol×L-1,0(TBA)=0.2 mmol×L-1,=(25±0.5) ℃,pH=3.0。
由图8可以看出,加入叔丁醇后,SMX降解率仅降低了7.3%,而甲醇的加入则使SMX降解率降低了57.9%。研究表明,甲醇与·OH (=1.2´109~2.8×109mol-1×L×s-1)和SO4-· (=1.6×107~7.7×107mol-1×L×s-1)的反应速率相当(为反应动力学常数),其加入体系后会同时捕获2种自由基,降低SMX的降解率;然而,叔丁醇与·OH (=3.8×108~7.6×108mol-1×L×s-1)的反应速率则是其与SO4-·(=4.9×105~9.1×105mol-1×L×s-1)反应速率的418~1 900倍[39-40],其加入后会主要捕获·OH,降低·OH对SMX的降解。因此,对比分析2种醇抑制剂加入前后SMX的降解率可知,Co2+/PMS体系降解SMX的活性物种主要为SO4-·和·OH,其中SO4-·为降解SMX的主导自由基。
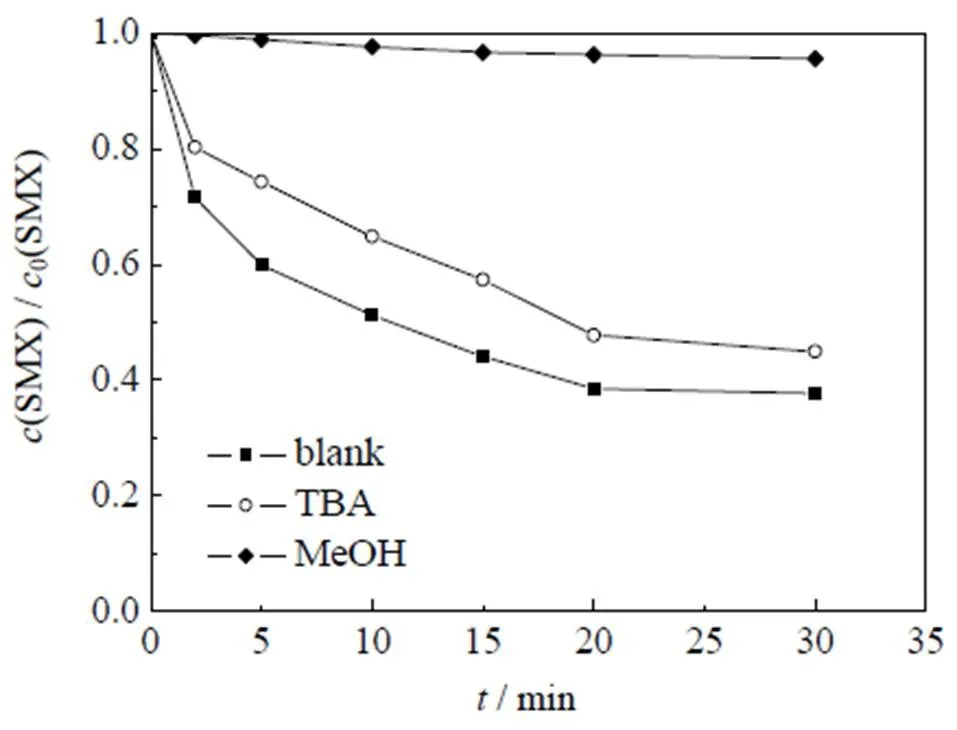
图8 甲醇、叔丁醇对Co2+/PMS体系降解SMX的影响
4 结 论
本研究采用Co2+/PMS体系降解SMX,分析了降解体系对目标物降解与矿化能力,考察了不同体系参数对SMX降解过程的影响,并通过醇抑制研究了降解体系的主导自由基。主要结论如下:
(1) Co2+/PMS体系能够有效降解SMX,当在最优条件下(Co2+浓度为0.05 mmol×L-1,SMX浓度为0.01 mmol×L-1,PMS浓度为0.1 mmol×L-1,pH=3.0,温度为25 ℃),反应时间为30 min,SMX降解率可达62.3%,TOC去除率为47.7%。
(2) 最优条件下,一定范围内(Co2+浓度为0~0.05 mmol×L-1),增加Co2+浓度可以提高SMX的降解率,进一步增加Co2+浓度,SMX的降解率几乎不变;加大PMS投量(0~0.10 mmol×L-1)可以促进SMX降解,继续增加PMS浓度,降解率反而下降;随着体系抗生素SMX浓度的增加,体系对其降解效能明显降低;然而反应温度的升高,可能会通过提高体系自由基的产量,加快SMX的降解。
(3) SO4-·和·OH是Co2+/PMS体系降解SMX的主要活性物种,其中SO4-·起到主导的降解作用。
[1] COLEMAN D C, CROSSLEY D A, INGHAM E R. Use of sulfamethoxazole-penicillin, oxytetracycline, carbofuran, carbaryl, naphthalene and temik to remove key organism groups in soil in a corn agroecosystem [J]. Journal of Sustainable Agriculture, 1994, 4(3): 7-30.
[2] GODFREY E, WOESSNER W W, BENOTTI M J. Pharmaceuticals in on-site sewage effluent and ground water, Western Montana[J]. Ground Water, 2007, 45(3): 263-271.
[3] STRAUB J O. Aquatic environmental risk assessment for human use of the old antibiotic sulfamethoxazole in Europe[J]. Environmental Toxicology Chemistry, 2016, 35(4): 767-779.
[4] LUO Y, MAO D, RYSZ M,. Trends in antibiotic resistance genes occurrence in the Haihe River, China[J]. Environmental Science & Technology, 2010, 44(19): 7220-7225.
[5] ARUMUGAM M, RAES J, PELLETIER E,. Enterotypes of the human gut microbiome [J]. Nature, 2011, 473(7346): 174-180.
[6] CHO I, YAMANISHI S, COX L,. Antibiotics in early life alter the murine colonic microbiome and adiposity [J]. Nature, 2012, 488(7413): 621-626.
[7] COX L M, YAMANISHI S, SOHN J,. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences [J]. Cell, 2014, 158(4): 705-721.
[8] YANG Z, ZHU P, YAN C,Biosynthesized schwertmannite@biochar composite as a heterogeneous Fenton-like catalyst for the degradation of sulfanilamide antibiotics [J]. Chemosphere, 2021, 266: 129175.
[9] LIU X, GAROMA T, CHEN Z,. SMX degradation by ozonation and UV radiation: a kinetic study [J]. Chemosphere, 2012, 87(10): 1134-1140.
[10] MISAL S N, LIN M H, MEHRAEEN S,. Modeling electrochemical oxidation and reduction of sulfamethoxazole using electrocatalytic reactive electrochemical membranes [J]. Journal of Hazardous Materials, 2020, 384: 121420.
[11] KOHANTORABI M, MOUSSAVI G, GIANNAKIS S. A review of the innovations in metal- and carbon-based catalysts explored for heterogeneous peroxymonosulfate (PMS) activation, with focus on radical vs. non-radical degradation pathways of organic contaminants [J]. Chemical Engineering Journal, 2021, 411:127957.
[12] AHMED M M, BARBATI S, DOUMENQ P,Sulfate radical anion oxidation of diclofenac and sulfamethoxazole for water decontamination [J]. Chemical Engineering Journal, 2012, 197(14): 440-447.
[13] WANG J L, WANG S Z. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants [J]. Chemical Engineering Journal, 2018, 334: 1502-1517.
[14] GIANNAKIS S, LIN K Y A, GHANBARI F A. Review of the recent advances on the treatment of industrial wastewaters by Sulfate Radical-based advanced oxidation processes (SR-AOPs) [J]. Chemical Engineering Journal, 2020 , 406: 127083.
[15] ANIPSITAKIS G P, DIONYSIOU D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt [J]. Environmental Science & Technology, 2003, 37(20): 4790-4797.
[16] BALL D L, EDWARDS J O. The kinetics and mechanism of the decomposition of caro's acid. I [J]. Journal of the American Chemical Society, 1956, 78(6): 1125-1129.
[17] JI Y, DONG C, KONG D,. New insights into atrazine degradation by cobalt catalyzed peroxymonosulfate oxidation: kinetics, reaction products and transformation mechanisms [J]. Journal of Hazardous Materials, 2015, 285: 491-500.
[18] XU H, LIU B, YU T,. Online spectrometric decolorization of Rhodamine B and Acid Yellow G by homogeneous cobalt-activated peroxymonosulphate reaction [J]. Nature Environment and Pollution Technology, 2018, 17(1): 93-98.
[19] ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants [J]. Environmental Science & Technology, 2004, 38(13): 3705-3712.
[20] CHEN M, ZHU L, LIU S,. Efficient degradation of organic pollutants by low-level Co2+catalyzed homogeneous activation of peroxymonosulfate [J]. Journal of Hazardous Materials, 2019, 371: 456-462.
[21] 周扬. 过一硫酸盐氧化降解水中典型有机污染物的动力学及反应产物 [D]. 哈尔滨: 哈尔滨工业大学, 2019.
ZHOU Y. Degradation kinetics and products of typical organic pollutants by peroxymonosulfate oxidation [D]. Harbin: Harbin Institute of Technology, 2019.
[22] ZOU J, MA J, CHEN L,. Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(III)/Fe(II) cycle with hydroxylamine [J]. Environmental Science & Technology, 2013, 47(20): 11685-11691.
[23] LIU G, LI X, HAN B,. Efficient degradation of sulfamethoxazole by the Fe(II)/HSO5-process enhanced by hydroxylamine: efficiency and mechanism [J]. Journal of Hazardous Materials, 2017, 322: 461-468.
[24] KOHANTORABI M, MOUSSAVI G, OULEGO P,. Radical-based degradation of sulfamethoxazole via UVA/PMS-assisted photocatalysis, driven by magnetically separable Fe3O4@ CeO2@ BiOI nanospheres [J]. Separation and Purification Technology, 2021, 267: 118665.
[25] 闫红梅. Fe2+/NH2OH联合活化PMS体系氧化水中磺胺甲噁唑的研究 [D]. 哈尔滨: 哈尔滨工程大学, 2016.
YAN H M. Research on oxidation of sulfamethoxazole in aqueous solution by PMS activated with ferrous/hrdroxylamine [D]. Harbin: Harbin Engineering University, 2016.
[26] HUANG Y H, HUANG Y F, HUANG C I,. Efficient decolorization of azo dye Reactive Black B involving aromatic fragment degradation in buffered Co2+/PMS oxidative processes with a ppb level dosage of Co2+-catalyst [J]. Journal of Hazardous Materials, 2009, 170(2/3): 1110-1118.
[27] JI Y F, LU J H, WANG L,Non-activated peroxymonosulfate oxidation of sulfonamide antibiotics in water: kinetics, mechanisms, and implications for water treatment [J]. Water Research, 2018, 147: 82-90.
[28] DING Y, ZHU L, WANG N,. Sulfate radicals induced degradation of tetrabromobisphenol A with nanoscaled magnetic CuFe2O4as a heterogeneous catalyst of peroxymonosulfate [J]. Applied Catalysis B: Environmental, 2013, 129: 153-162.
[29] XU X R, LI X Z. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion [J]. Separation and Purification Technology, 2010, 72(1): 105-111.
[30] LAI L, YAN J, LI J,. Co/Al2O3-EPM as peroxymonosulfate activator for sulfamethoxazole removal: Performance, biotoxicity, degradation pathways and mechanism [J]. Chemical Engineering Journal, 2018, 343: 676-688.
[31] YAN J F, LI J, PENG J L,. Efficient degradation of sulfamethoxazole by the CuO@Al2O3(EPC) coupled PMS system: Optimization, degradation pathways and toxicity evaluation [J]. Chemical Engineering Journal, 2019, 359: 1097-1110.
[32] QI C, LIU X, LIN C,. Degradation of sulfamethoxazole by microwave-activated persulfate: Kinetics, mechanism and acute toxicity [J] .Chemical Engineering Journal, 2014, 249: 6-14.
[33] ZHOU N, ZU J N, YANG L H,. Cobalt (0/II) incorporated N-doped porous carbon as effective heterogeneous peroxymonosulfate catalyst for quinclorac degradation [J]. Journal of Colloid and Interface Science, 2020, 563: 197-206.
[34] FLANAGAN J, GRIFFITH W P, SKAPSKI A C. The active principle of Caro's acid, HSO5–: X-ray crystal structure of KHSO5·H2O [J]. Journal of the Chemical Society, Chemical Communications, 1984 (23): 1574-1575.
[35] QIN W X, FANG G D, WANG Y J,Efficient transformation of DDT by peroxymonosulfate activated with cobalt in aqueous systems: kinetics, products, and reactive species identification [J]. Chemosphere, 2016, 148: 68-76.
[36] QIANG Z, ADAMS C. Potentiometric determination of acid dissociation constants (pKa) for human and veterinary antibiotics [J] . Water Research, 2004, 38(12): 2874-2890.
[37] HU J, CHEN H, DONG H,. Transformation of iopamidol and atrazine by peroxymonosulfate under catalysis of a composite iron corrosion product (Fe/Fe3O4): Electron transfer, active species and reaction pathways [J]. Journal of Hazardous Materials, 2021, 403: 123553.
[38] 相青青. 碱活化过一硫酸盐及其在处理染料废水中的应用研究 [D]. 武汉: 中南民族大学, 2012.
XIANG Q Q. Base activation of permonosulfate and its application in dye wastewater treatment [D]. Wuhan: South-Central Minzu University. 2012.
[39] NETA P, HUIE R E, ROSS A B. Rate constants for reactions of inorganic radicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1988, 17(3): 1027-1284.
[40] ZHOU X, LUO H, SHENG B,Cu2+/Cu+cycle promoted PMS decomposition with the assistance of Mo for the degradation of organic pollutant [J]. Journal of Hazardous Materials, 2021, 411: 125050.
Degradation of sulfamethoxazole in aqueous solution by cobaltous activated peroxymonosulfate
LIU Gui-fang, GUAN Wei-ting, ZHANG Yu-ping, LIU Yu-han, XIONG Jie, LIU Wei
(College of Aerospace and Civil Engineering, Harbin Engineering University, Harbin 150001, China)
In order to explore and optimize the removal ability of antibiotics in water by cobalt ion (Co2+) activated peroxymonosulfate (PMS), a typical antibiotic sulfamethoxazole (SMX) was used as the target, and the degradation of SMX was studied. Effects of Co2+dosage, SMX concentration, PMS dosage, solution temperature and pH value on the degradation of SMX were systematically investigated, and the total organic carbon (TOC) and reactive species in the process were also analyzed. The results indicate that under room temperature conditions, the optimum degradation efficiencies of SMX and TOC are obtained at cobalt ion dosage of 0.05 mmol×L-1, PMS dosage of 0.1 mmol×L-1, SMX concentration of 0.01 mmol×L-1and pH 3.0. The degradation rate of SMX reached 62.3% and the TOC removal rate achieved 47.7% under the optimal conditions. Furthermore, radicals quenching analysis shows that sulfate radical (SO4-·) played a dominant role during the degradation of SMX in the Co2+/PMS process.
sulfamethoxazole; sulfate radical; cobalt ion; peroxymonosulfate; degradation efficiency
1003-9015(2022)02-0268-08
X703.1
A
10.3969/j.issn.1003-9015.2022.02.015
2021-04-29;
2021-08-29。
中央高校基本科研业务费专项资金 (3072020CF0209);国家自然科学基金(51509044)。
刘桂芳(1980-),女,黑龙江大庆人,哈尔滨工程大学副教授,博士。
刘桂芳,E-mail:liuguifang@126.com
刘桂芳, 管威霆, 张玉平, 刘昱含, 熊杰, 柳威. Co2+活化过硫酸盐降解水中的磺胺甲噁唑[J]. 高校化学工程学报, 2022, 36(2): 268-275.
:LIU Gui-fang, GUAN Wei-ting, ZHANG Yu-ping, LIU Yu-han, XIONG Jie, LIU Wei. Degradation of sulfamethoxazole in aqueous solution by cobaltous activated peroxymonosulfate[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(2): 268-275.
