电化学介导胺再生CO2捕集系统电化学性能研究
2022-05-05范会峰吴小梅刘广鑫MaimoonaSharif余云松张早校
范会峰, 吴小梅, 刘广鑫, Maimoona Sharif, 余云松, 张早校
电化学介导胺再生CO2捕集系统电化学性能研究
范会峰1,2, 吴小梅1, 刘广鑫1, Maimoona Sharif1,2, 余云松1, 张早校1,2
(1. 西安交通大学 化学工程与技术学院, 陕西 西安 710049;2. 西安交通大学 动力工程多相流国家重点实验室, 陕西 西安 710049)
二氧化碳(CO2)捕集是实现我国碳中和目标的重要手段。电化学介导胺再生(EMAR)CO2捕集系统是一种极具应用前景的碳捕集技术。为了进一步研究EMAR的电化学性能,利用H型电解池,对以乙醇胺(MEA)溶液为吸收剂,铜离子为金属配体的体系开展电化学行为研究。结果表明:阴极和阳极反应均是分步进行的,且均由扩散和电荷传递共同控制,阴极过程更缓慢,是系统的控制步骤。同时,增大阴阳极之间配合物浓度差,在较低阳极配合物浓度和较高阴极配合物浓度的情况下,更有利于系统反应的进行。研究结果有望为EMAR CO2捕集技术的放大研究和实际应用提供一定的理论支撑。
二氧化碳捕集;电化学介导胺再生;H型电解池;电化学性能
1 前 言
二氧化碳的捕集和封存(carbon dioxide capture and storage, CCS)是实现我国“双碳”目标非常重要的技术手段[1]。以醇胺溶液为吸收剂的化学吸收法被认为是目前最为成熟、最可能实现大规模工业应用的CO2捕集方法之一[2-3]。但是,醇胺溶剂再生过程中的高能耗(每吨CO2耗能3.5~4.0 GJ),限制了其工业规模推广应用[4]。电化学介导分离技术与化学吸收法CO2捕集技术的高效结合,为克服以上问题提供了新的技术路线。Jemaa等[5]、Appel等[6]利用电化学介导分离技术,设计了一种连续的电化学媒介配位过程用以提取杂环氮化物,并揭示了该方法用于输运CO2、CO和H2S的可行性。后有研究发现Cu(II)可以与胺形成具有较大稳定常数的络合物[7-8],与CO2和胺生成碳酸盐或氨基甲酸酯的过程形成竞争关系,同时Cu(II)的加入可以降低胺液的挥发损失,并可以作为催化剂加速CO2的解吸[9-10]。于是,Tern和Wang等提出了一种基于Cu(II)与乙二胺(ethanediamine, EDA)的电化学介导胺再生(electrochemically-mediated amine regeneration, EMAR) 系统,证明了该方法的可行性[11-13]。Cheng等[14]针对Cu(II)与乙醇胺(monoethanolamine, MEA)形成络合物的相关反应过程建立了热力学模型。Liu等[15]基于EMAR系统,提出了一种热电共驱CO2捕集系统(thermal–electrochemical co-driven system, TECS),研究了Cu(II)-MEA配合物浓度、温度、CO2负荷和支持电解质(KNO3)浓度对TECS电化学行为的影响,结果显示胺再生能耗降低至每吨CO2约1.3 GJ,并具有90% 以上的解吸率。由此可见电化学介导的CO2捕集技术在CO2捕集方面所展现出来的潜力不容忽视。
作为一种新型的CO2捕集技术,尽管研究者们对其进行了一些研究,仍缺乏对原理的深入探讨,对于在实际应用中的变量分析仍有待考究。本研究重点关注以MEA为吸收剂,Cu(II)为配位金属的电化学介导胺再生捕集CO2过程,在现有研究基础上,结合实际应用条件,利用H型电解池设计电化学测试实验,对不同操作条件下的EMAR电化学动力学特征进行深入探讨;研究阴阳极反应机理,理清Cu(II)的加入对以MEA溶液为基础的CO2捕集过程电化学行为的影响机制,为该技术的理论及放大应用提供参考。
2 EMAR原理
以MEA为吸收剂,Cu为工作介质的电化学介导胺再生系统工作过程如图1所示。
工作过程可以分为2部分:CO2吸收部分和解吸部分。吸收部分与传统吸收操作相同,在常压下烟气与吸收液在吸收塔内逆流接触,吸收CO2后的烟气从吸收塔塔顶排出,吸收CO2后的吸收液成为CO2富液,进入解吸过程。解吸过程中利用电化学介导胺再生的方法,与传统热解吸相比,电化学介导的解吸过程可以在较高压力下进行,进而有望减少后续压缩过程中的能耗。在一定电压下阳极铜溶解进入溶液取代CO2与MEA配位,此时解吸出的CO2与电解质溶液共存,形成高压气液混合物,接着阳极液进入闪蒸罐。由于压力变化,溶液中CO2与电解质溶液发生分离,分离后CO2气体进入后续压缩运输环节,Cu(II)-MEA配合物溶液进入阴极槽析出铜后实现溶剂再生,再生后的MEA溶液可以回流入吸收塔再次参与CO2吸收,进而实现吸收-解吸循环。

图1 电化学介导胺再生系统工作过程图
1.absorption column 2.flash tank 3.Cathode 4.membrane 5.anode
分析可得该循环可由以下3个反应过程表示,分别发生在吸收塔内、阳极槽和阴极槽。
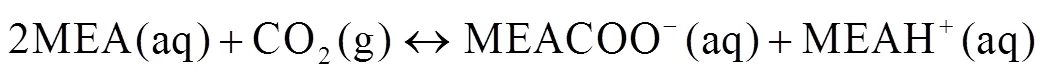


式中:为一个铜离子结合胺分子的数目,在文献[15]中研究者通过实验证明值约为2.6,并得出Cu-MEA配合物结构为[Cu(MEA)2−2H(OH)2]和[Cu(MEA)3]2+的结论。
在实际工作过程中,阴阳极Cu(II)-MEA配合物浓度都会随着系统的运行而发生变化。但在以往的研究中,为研究电化学反应机理及反应状况,研究者往往将阴极和阳极置于同一电解池内,或将阴极和阳极分开,但两侧溶液仍为同等负荷的溶液,电化学测试时也未单独考虑阴极槽和阳极槽内各自的电化学情况,这与实际应用场景有很大差异。同时铜金属本身可作为CO2电化学还原催化剂,可在水溶性电解质溶液中将CO2还原成CO、HCOOH、CH4、C2H6、C2H4及含氧碳氢化合物(醇类)等不同的还原产物[16],对实验结果产生影响。为更加贴合实际工况,本研究设计了H型电解池实验,将阳极区和阴极区用膜隔开,防止阳极区生成的CO2进入阴极区,在阴极铜电极表面发生电化学还原反应,减小副反应发生的可能性,进而分别对含不同Cu(II)-MEA配合物浓度溶液的阴阳极的电化学性能进行研究。
3 实 验
3.1 材料与溶液制备
实验中阴阳极材料均为紫铜,牌号为GB T2(ASTM C11000, ISO Cu-FRHC),其组成(质量分数)为Cu+Ag≥99.90%,Bi≤0.001%,Sb≤0.002%,As≤0.002%,Fe≤0.005%,Pb≤0.005%,S≤0.005%。硝酸铜水合物(Cu(NO3)2×3H2O,分析纯AR)和硝酸钾(KNO3,AR)作为添加介质。首先,硝酸盐为强电解质,在溶液中可完全电离增强溶液导电性;其次,硝酸根可作为辅助配体参与配位,形成[Cu(MEA)2](NO3)2×4H2O,减小电荷传递阻抗[17];另外,Cu(II)在硝酸盐作为支持电解质中可直接还原为Cu,且反应速度较快[15]。
电解质溶液的制备:首先用去离子水和MEA(AR)制备质量分数为30% 的MEA水溶液。然后,基于设计的Cu(II)负荷,加入一定量的硝酸铜水合物(Cu(NO3)2×3H2O,AR)以产生二价铜离子,得到特定负荷的Cu(II)-MEA配合物溶液。加入硝酸钾(KNO3,AR)作为支持电解质,减小溶液的阻抗。随后,利用电磁搅拌器搅拌溶液直到所有物质溶解,形成均一溶液。将所得溶液放入预定温度的水浴槽保温10 min,再将CO2气体(纯度≥99.99%)经过流量计控制流量后鼓入溶液,利用称量法称量溶液质量变化情况,以确保CO2负荷达到设计值。在制备过程中,为了避免溶液与空气接触,采取了必要的密封和冷却回流措施。此处,定义溶液Cu(II)负荷为每mol MEA溶液中含有Cu(II)物质的量;CO2负荷为每mol MEA溶液中含有CO2物质的量。
3.2 电化学测试
电化学测试采用三电极体系,其中工作电极和辅助电极均为铜盘电极(表面积为0.282 6 cm2),参比电极为标准Ag/AgCl参比电极。所有电化学测试均在单池体积为100 mL的H型可换膜密封电解池内进行,质子交换膜(N117,美国杜邦)将电解池分为阴极槽和阳极槽。使用电化学工作站(CS350H,Corrtest Instruments)进行测量,并利用水浴控制测试温度。
先进行阳极测试,将工作电极和参比电极置于阳极槽内,辅助电极置于阴极槽内。在满足测试条件后,开始电化学测试。首先进行开路电位(open circuit potential,OCP)测量。当开路电位波动小于±0.5 mV后,则认为达到稳定状态,并记录此时开路电位。然后进行动电位扫描(potentiodynamic polarization,PP)测试,电位范围为-0.02 ~0.4 V(vs. OCP(相对于开路电位)),扫描速率为1 mV×s-1。紧接着做电化学阻抗谱(electrochemical impedance spectroscopy,EIS)测试,分别在相对于开路电位下以0、0.1、0.2、0.3、0.4 V的幅值下进行测量,频率范围均为0.1~100 kHz。最后进行循环伏安(cyclic voltammetry,CV)测试,电位扫描范围为-0.9 ~0.5 V (vs.饱和Ag/AgCl电极),扫描速率为 70 mV×s-1。
阳极测试完成后,进行阴极测试。重新对电极进行处理并更换溶液,将工作电极和参比电极置于阴极槽内,辅助电极置于阳极槽内。满足测试条件后,进行阴极测试,同样先进行开路电位测量,再进行动电位扫描测试,但此时电位范围为0.02 ~-0.4 V (vs. OCP),其他参数不变。之后进行电化学阻抗谱(EIS)测试,依次在相对于开路电位以0、-0.1、-0.2、-0.3、-0.4 V的幅值进行测量,频率范围仍为0.1~100 kHz。最后进行循环伏安测试,参数设置与阳极测试时相同。
此外,每次测量前都要对工作电极进行处理。首先用1 200目的金相砂纸打磨平整,接着依次使用1.0、0.3和0.05mm氧化铝粉对电极进行抛光。然后在去离子水和异丙醇中进行超声波清洗,其后放入干燥箱中干燥。为了保证测试的准确性,每项测试均进行至少3次平行试验。电位和电流测量的标准不确定度分别为6×10–4V和1.2×10–4A,质量和温度测量设备精确度分别为0.001 g和0.1 ℃。
4 结果与讨论
4.1 循环伏安曲线分析
阳极槽Cu(II)负荷为0.025 mol,不同阴极槽Cu(II)负荷情况下的阳极和阴极循环伏安曲线如图2所示。测试条件为:阳极Cu(II)负荷均为0.025 mol,阴极Cu(II)负荷分别为0.1、0.2、0.3、0.4 mol,CO2负荷均为饱和状态,温度:=30 ℃,KNO3质量摩尔浓度KNO3=0.45 mol×kg-1。
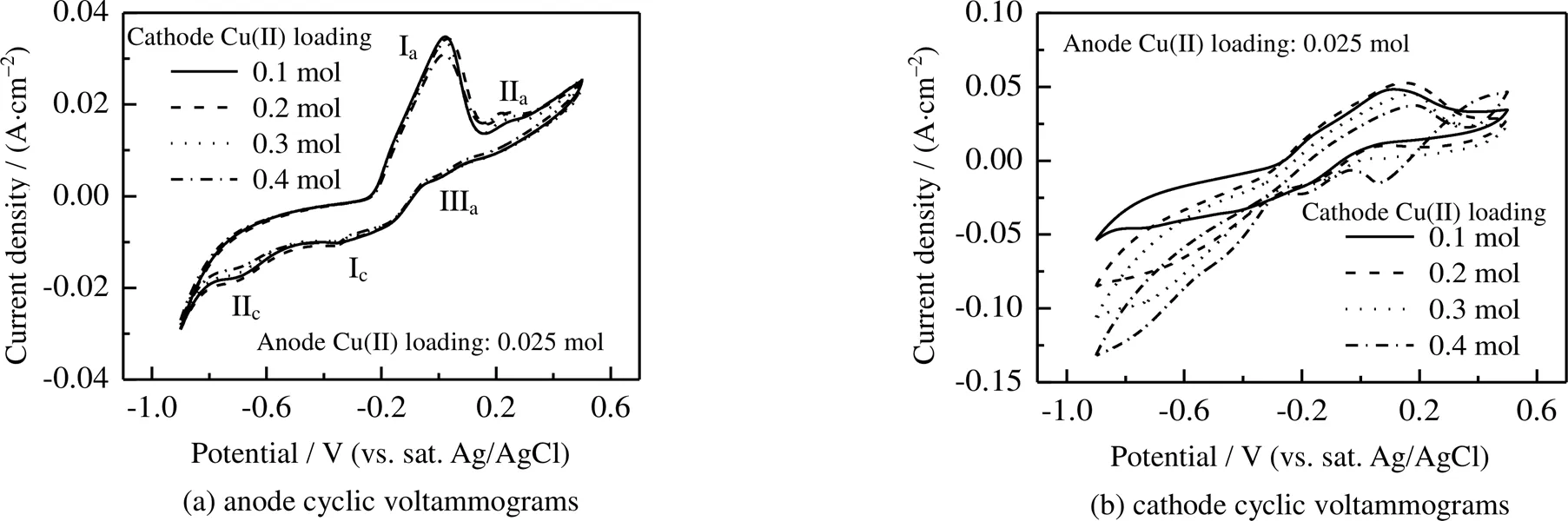
图2 相同阳极Cu(II)负荷时,不同阴极Cu(II)负荷下的循环伏安曲线
由图2(a)可知,在阳极槽Cu(II)负荷相同,阴极槽Cu(II)负荷不同的情况下,阳极测试循环伏安曲线基本重合,说明H型电解池中质子交换膜的存在减少了阴阳极溶液的互相干扰,阴极槽Cu(II)负荷的不同并不会对阳极槽内的反应产生明显影响。从循环伏安曲线可以看出,当电位正向扫描时,循环伏安曲线出现了2个氧化峰(Ia,IIa),当电位反向扫描时,出现1个氧化峰(IIIa)和2个还原峰(Ic,IIc)。当电位超出-0.8 ~0.5 V (vs.饱和Ag/AgCl电极)时,电流会急剧上升,分别对应析氢(电位<−0.8 V)和析氧(>0.5 V)反应。
反应过程中的2个还原峰(Ic,IIc),主要是Cu(II)-MEA配合物分步还原的结果。Ic归因于Cu(II)被还原为Cu(I)的反应,IIc则归因于Cu(I)被还原为Cu的反应。其发生的反应如下所示:

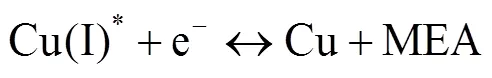
反应过程中出现的3个氧化峰,其中Ia与其他峰相比更高大、对称,这表明其对应的反应是可逆的,且在电化学控制下。因此,可以判断该氧化峰代表金属铜直接被氧化为Cu(II)的反应,即:
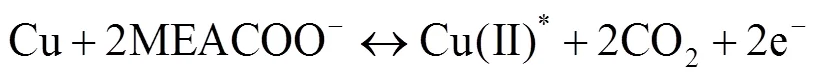
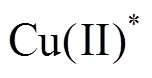
循环伏安曲线中出现了3个氧化峰,比文献[15]中的6个峰要少,其原因可能是文献中将阴极和阳极同时置于同一电解池内,并没有进行分隔,阴阳极产物相互作用,发生更多副反应。由此可见,在实际应用中避免阴极和阳极的溶液混合,可有效减少副反应的发生,并且使反应更加稳定。
从阴极槽循环伏安曲线图2(b)可以看出Cu(II)负荷大小对峰电势影响很小,但对阳极峰电流有消极作用,对阴极峰电流有积极作用,说明增大Cu(II)负荷有利于铜的还原和胺的再生,但不利于金属铜的氧化和CO2的解吸。并且值得注意的是,阳极和阴极过程中电荷转移出现了不平衡的情况,阴极过程电荷转移量总是小于阳极过程,意味着阴极反应过程是限速步骤,随着阴极配合物浓度增大,不平衡现象得到改善。因此,增大阴极配合物浓度可有效改善系统整体反应速率。
4.2 极化曲线分析
保持阳极Cu(II)负荷相同,不同阴极Cu(II)负荷下的极化曲线如图3所示。测试条件为:阳极Cu(II)负荷均为0.025 mol,阴极Cu(II)负荷分别为0.1、0.2、0.3、0.4 mol,CO2负荷均为饱和状态,=30 ℃,KNO3=0.45 mol×kg-1。
从图3(a)中可以看出,不同阴极Cu(II)负荷下的阳极极化曲线基本重合,同样说明在H型电解池中,阴极溶液浓度的大小并不会对阳极的电化学性质产生影响。阴极反应对应于单质铜的生成和MEA的再生过程,从阴极极化曲线图3(b)中可以看出,随着阴极Cu(II)-MEA 配合物浓度的增大,开路电位向正向移动,意味着金属还原析出的可能性在逐步增大,并且可观察到极限电流密度也不断增大,表明随着阴极Cu(II)负荷的增大,更有利于单质铜的生成和MEA的再生。
图3 阳极Cu(II)负荷相同,不同阴极Cu(II)负荷下的极化曲线
Fig.3 Polarization curves under different cathode Cu(II) loadings
保持阴极Cu(II)负荷一定的情况下,不同阳极Cu(II)负荷下的极化曲线如图4所示。测试条件为:阴极Cu(II)负荷均为0.2 mol,阳极Cu(II)负荷分别为0.025、0.05、0.1、0.15 mol,CO2负荷均为饱和状态,=30 ℃,KNO3=0.45 mol×kg-1。
由图4(b)可见,不同条件下的阴极极化曲线走势大致相同,而由图4(a)可见,不同条件下的阳极极化曲线走势有较大变化。阳极对应Cu(II)的生成和CO2的解吸过程,在Cu(II)负荷为0.15 mol的情况下阳极极化曲线存在明显Tafel区,这表明此时阳极反应受到电荷转移控制,随着阳极槽内Cu(II)负荷减小,逐渐观察不到Tafel区,阳极活性溶解区也在逐步减小。因此,Cu(II)负荷的减小会显著促进阳极反应速率,即有利于Cu(II)的生成和CO2的解吸过程。同时,也可看出随阴阳两极间浓度差减小,阳极极化曲线整体有向左上移动的趋势,极限电流密度逐渐减小,这限制了CO2解吸速率的进一步提高。因此,较小的阳极Cu(II)负荷和较大的阴阳极间浓度差,有利于Cu(II)的生成和CO2的解吸过程。
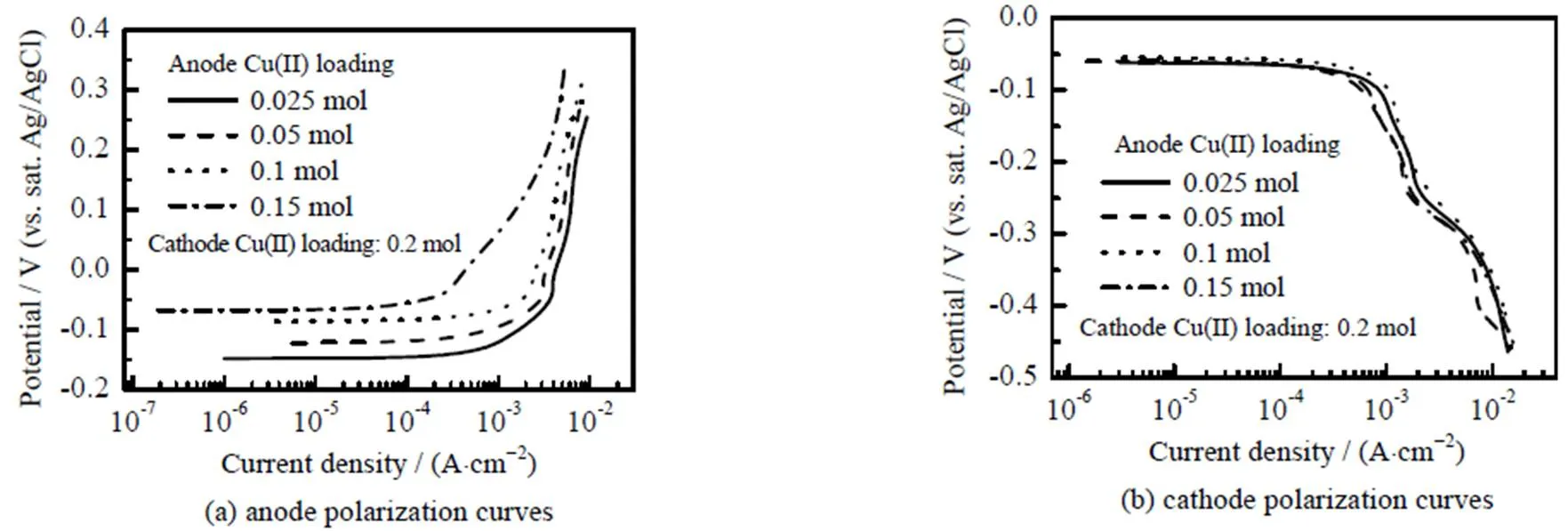
图4 阴极Cu(II)负荷相同,不同阳极Cu(II)负荷下的极化曲线
4.3 电化学阻抗谱分析
电化学阻抗谱(EIS)测量用于对研究体系的电化学阻抗构成进行定量分析。系统典型的Nyquist图及其等效电路如图5所示,图中¢为阻抗的实部,²为阻抗的虚部。

图5 系统典型的Nyquist图及其等效电路
图5(a)为阴阳极槽内Cu(II)负荷均为0.1 mol,CO2负荷均为饱和状态,=30 ℃,KNO3=0.45 mol×kg-1,在−0.2、0、0.3、0.4 V (vs. OCP)的极化电位下的Nyquist图,为完整反映电化学过程,可将图概括性地划分为3部分:高频区的容抗弧、中频区的感抗弧和低频区的扩散弧。
高频区的容抗弧是由电极和溶液双电层电容引起的,该容抗弧呈现压扁的半圆形,出现这样的形状是由于弥散效应,即与电极/电解液界面性质的不均匀性有关。容抗弧可以等效为电阻与常相位角元件CPE并联电路,即电路。常相位角元件能够对纯电容元件做出补偿,以正确表征上面提到电极/电解液界面性质的非均匀问题。
中频区在高电位时出现较明显的感抗弧,说明电极反应中间产物在电极表面吸附。随着极化电位的减小,感抗弧逐渐减小最后消失,表明合理控制极化电位可以有效减小反应中间产物在电极表面吸附的概率。感抗弧可以等效为电阻与感抗线圈串联电路,即电路。
低频区的扩散弧,由接近45°的直线段和弧形段构成,出现了平面电极的有限层扩散过程的典型特征,说明扩散传质过程是电极过程的控制步骤。扩散弧可用广义有限Warburg阻抗元件来表征。
通过以上分析可以建立如图5(b)的等效电路图,s为工作电极与参照电极间溶液的阻抗,ct为阴阳极电极反应电荷传递阻抗,CPE为常相位角元件,W是广义有限Warburg阻抗元件。于是,总阻抗的数学表达式为
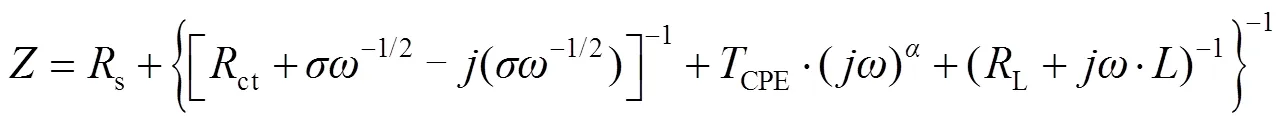
阴极槽Cu(II)负荷为0.2 mol,不同阳极槽Cu(II)负荷情况下的阳极Nyquist图如图6所示。其测试条件为:阴极Cu(II)负荷均为0.2 mol,阳极Cu(II)负荷分别为0.025、0.05、0.1、0.15 mol,电势幅值为0.4 V,CO2负荷均为饱和状态下,=30 ℃,KNO3=0.45 mol×kg-1。
溶液中配合物浓度与Cu(II)负荷相对应,当阳极Cu(II)负荷从0.025提高到0.15 mol时,中频区的感抗弧逐渐变大,说明随着配合物浓度的增大,反应中间产物在电极表面吸附的几率会变大。同时可观察到,随着阴阳极之间配合物浓度差的增大,电荷传递阻抗从14.21减小至7.48 Ω×cm2。说明增大阴阳极之间配合物浓度差能够增大电极反应速率。
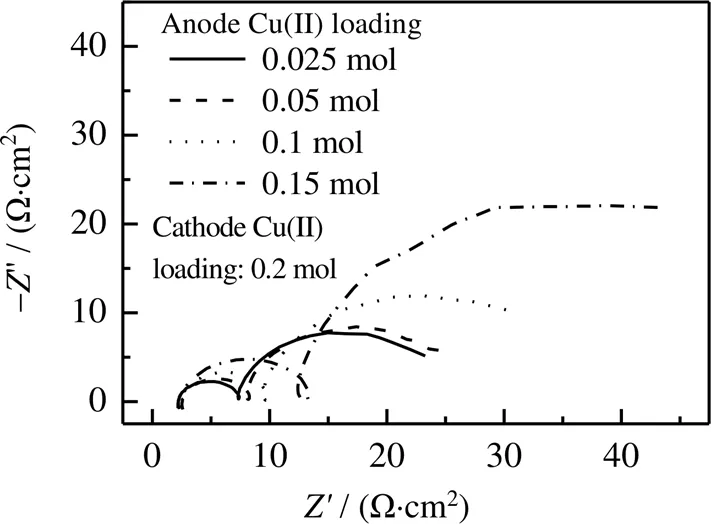
图6 阴极Cu(II)负荷相同,不同阳极Cu(II)负荷下的阳极Nyquist图
5 结 论
分析了电化学介导胺再生(EMAR)的CO2捕集系统的工作原理,并结合实际运用工况设计实验,利用H型电解池研究了阴阳极槽内配合物浓度对电极反应的影响,利用循环伏安法、动电位扫描法以及电化学阻抗谱等测试方法对系统电化学动力学特征进行了深入研究,结果表明:
(1) 用膜隔开阴极区和阳极区可以有效降低阴阳极之间的相互干扰,减小副反应发生的可能性,并且阴阳极反应均是分步进行的,阴极反应为整个过程的控制步骤。
(2) 阴阳极电极反应均由扩散和电荷传递共同控制,较低阳极Cu(II)负荷和较高阴极Cu(II)负荷的条件下,更有利于系统反应的进行。
(3) 系统典型的Nyquist图一般由高频区的容抗弧、中频区的感抗弧和低频区的扩散弧组成。增大阴阳极之间配合物浓度差能够有效促进电极反应速率,但较大配合物浓度会增大反应中间产物在电极表面吸附的几率,这一点需要根据具体应用场景综合考虑。
[1] MILLAR R J, ALLEN M R. Carbon capture and storage [M]. London: The Royal Society of Chemistry, 2019.
[2] 陆诗建, 耿春香, 赵东亚, 等. 基于AEEA的二元复合胺试剂吸收CO2降解性能研究 [J]. 高校化学工程学报, 2017, 31(6): 1442-1451.
LU S J, GENG C X, ZHAO D Y,. Study on the degradation of AEEA based mixed amines in CO2absorption [J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(6): 1442-1451.
[3] 孙铖, 刘凡, 沈丽, 等. [N_(1111)][Lys]水溶液吸收二氧化碳的机理与动力学 [J]. 高校化学工程学报, 2020, 34(5): 1135-1142.
SUN C, LIU F, SHEN L,. Mechanism and kinetics of CO2absorption with aqueous solution of [N_(1111)][Lys] [J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(5): 1135-1142.
[4] KAI J, PETA A. The development of carbon capture utilization and storage (CCUS) research in China: A bibliometric perspective [J]. Renewable and Sustainable Energy Reviews, 2021, 138(1): 110521.
[5] JEMAA N, WALLS H J, NOBEL R D,. Continuous electrochemically modulated complexation separations process [J]. AIChE Journal, 1993, 39(5): 867-875.
[6] APPEL A M, NEWELL R, DUBOIS D L,. Concentration of carbon dioxide by electrochemically modulated complexation with a binuclear copper complex [J]. Inorganic Chemistry, 2005, 44(9): 3046-3056.
[7] DJURDJEVIC P, BJERRUM J. Metal ammine formation in solution. XXIV. The copper(II) and some other metal(II) mono and diethanolamine systems [J]. Acta Chemica Scandinavica Series a Physical and Inorganic Chemistry, 1983, 37(10): 881-890.
[8] HE F, HEMMATIFAR A, BAZANT M Z,. Selective adsorption of organic anions in a flow cell with asymmetric redox active electrodes [J]. Water Research, 2020, 182(1): 115963.
[9] LI K, POEL P, CONWAY W,. Mechanism investigation of advanced metal–ion–mediated amine regeneration: A novel pathway to reducing CO2reaction enthalpy in amine-based CO2capture [J]. Environmental Science and Technology, 2018, 52(1): 14538-14546.
[10] WU X M, FAN H F, SHARIF M,. Electrochemically-mediated amine regeneration of CO2capture: From electrochemical mechanism to bench-scale visualization study [J]. Applied Energy, 2021, 302: 117554.
[11] TERN M C, SIMEON F, HERZOG H,. An electrochemically-mediated gas separation process for carbon abatement [J]. Energy Procedia, 2013, 37(1): 1172-1179.
[12] WANG M, RAHIMI M, KUMAR A,. Flue gas CO2capture via electrochemically mediated amine regeneration: System design and performance [J]. Applied Energy, 2019, 255(12): 113879.1-113879.8.
[13] WANG M, HATTOM T A. Flue gas CO2capture via electrochemically mediated amine regeneration: Desorption unit design and analysis [J]. Industrial & Engineering Chemistry Research, 2020, 59(21): 10120-10129.
[14] CHENG C H, LI K, YU H,. Amine-based post-combustion CO2capture mediated by metal ions: Advancement of CO2desorption using copper ions [J]. Applied Energy, 2018, 211(2): 1030-1038.
[15] LIU G X, YU Y S, HONG Y T,. Identifying electrochemical effects in a thermal-electrochemical co-driven system for CO2capture [J]. Physical ChemistryChemical Physics, 2017, 19(20): 13230-13244.
[16] KUHL K P, CAVE E R, ABRAM D N,. New insights into the electrochemical reduction of carbon dioxide on metallic copper surfaces [J]. Energy and Environmental Science, 2012, 5(5): 7050-7059.
[17] ABDULLAEV G K, GASANOV B G. Radiographic investigation of tetramonoethanolamine cupronitrate tetrahydrate [Cu(H2NCH2CH2OH)4](NO3)2·4H2O [J]. Journal of Structural Chemistry, 1969, 10(3): 468-469.
Electrochemical performance of electrochemically-mediated amine regeneration CO2capture systems
FAN Hui-feng1,2, WU Xiao-mei1, LIU Guang-xin1,Maimoona Sharif1,2, YU Yun-song1, ZHANG Zao-xiao1,2
(1. School of Chemical Engineering and Technology, Xi’an Jiaotong University, Xi’an 710049, China;2. State Key Laboratory of Multiphase Flow in Power Engineering, Xi’an Jiaotong University, Xi’an 710049, China)
Carbon dioxide (CO2) capture is important for achieving carbon neutrality of China. The electrochemically-mediated amine regeneration (EMAR) CO2capture system is promising for CO2capture. A H-cell was designed for electrochemical experiments to study the electrochemical performance of EMAR. Electrochemical behaviors in the EMAR CO2capture process using MEA as an absorbent and copper ions as metal ligands were studied. The results show that both cathode and anode reactions happen step by step, and both are controlled by diffusion and charge transfer. The cathode reaction is slower and more difficult, which means the cathode process is the control step. Meanwhile, increasing the complex concentration difference between the anode and cathode chambers (i.e. with a lower anode complex concentration and a higher cathode complex concentration) contributes to the EMAR CO2capture process. Finally, the results obtained are expected to provide theoretical support for the scale-up and practical application of EMAR CO2capture technology.
carbon capture; electrochemically-mediated amine regeneration(EMAR); H-cell; electrochemical performance
1003-9015(2022)02-0235-07
TQ150.9
A
10.3969/j.issn.1003-9015.2022.02.011
2021-06-18;
2021-08-21。
国家自然科学基金(51876150,52050027);中国博士后基金(2020M673390);陕西省青年科学基金(2020JQ-058)。
范会峰(1992-),男,河南周口人,西安交通大学博士生。
张早校,E-mail:zhangzx@mail.xjtu.edu.cn
范会峰, 吴小梅, 刘广鑫, Maimoona Sharif, 余云松, 张早校.电化学介导胺再生CO2捕集系统电化学性能研究[J]. 高校化学工程学报, 2022, 36(2): 235-241.
:FAN Hui-feng, WU Xiao-mei, LIU Guang-xin, Maimoona Sharif, YU Yun-song, ZHANG Zao-xiao. Electrochemical performance of electrochemically- mediated amine regeneration CO2capture systems [J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(2): 235-241
