甲醛交联板栗壳色素树脂吸附水中Ni(II)的研究
2022-05-05王思展康海生姚增玉
王思展,康海生,姚增玉
(西南林业大学 西南山地森林资源保育与利用教育部重点实验室,昆明 650224)
随着工业化发展,重金属废水排放量随之增加,重金属毒性大,对生态环境和人体健康构成了严重威胁[1]。处理含重金属废水的方法有很多,如电解法、化学沉淀法、反渗透法、电渗析法等[2]。但这些处理方法存在运行费用高、易产生二次污染等问题,因而工业应用受到限制。利用吸附剂去除水中重金属虽然效果较好,但是传统吸附剂通常为石油基产品,在环境中难以降解,且其原材料为消耗性资源,不可再生,不符合“绿色化学”发展趋势。因此,在石油价格不断攀升的情况下,人们逐渐把目光投向天然生物高分子领域,且改性后的天然高分子对重金属离子吸附剂吸附效果良好,同时来源广、成本低、易于降解[3]。当前这类吸附剂的研究主要集中于壳聚糖、双醛淀粉、海藻酸钠等低价高效天然产物衍生物[4-6]。
板栗(Castaneamollissima)是我国重要经济林树种之一,板栗壳作为林业生产与加工中产生的副产品或废弃物,产量高、数量大,由于没有得到转化利用造成了资源浪费和环境污染[7]。板栗壳中约含有的15 %板栗壳色素[8],具有丰富的羟基、羧基等官能团,这些官能团能够吸附固定重金属,因此板栗壳色素在重金属废水处理领域具有良好的应用前景。板栗壳色素在碱性水中溶解,在酸性水中溶胀,难以直接用作吸附剂,因此利用氨催化、热固法将板栗壳色素与甲醛交联以合成树脂,增加板栗壳色素的抗溶解性。本研究通过吸附性能和吸附机理分析,探讨甲醛交联板栗壳色素对废水中Ni(II)的吸附可行性,以期为废水中Ni(II)的去除和林产剩余物的资源化利用提供方案。
1 材料与方法
1.1 材料
板栗采购自昆明本地市场,人工剥取板栗壳,参照文献[9]制备板栗壳色素。Ni(II)标准溶液购自国家有色金属及电子材料分析测试中心,其它试剂均是国产分析纯。
1.2 甲醛交联板栗壳色素树脂的合成
用氨水催化热固法合成甲醛交联板栗壳色素树脂,方法参照参考文献[10]。将一定量的板栗壳色素与浓度为0.38%(m/v)的氨水混合,50 ℃磁力搅拌24 h,使其完全溶解,得到4%(m/v)板栗壳色素溶液。取上述溶液25 ml置于80 ℃的水浴锅预热,加入1.75 g多聚甲醛。反应温度为80 ℃,反应时间为2 h,得到胶状甲醛交联板栗壳色素树脂,自然冷却至室温。在蒸馏水中清洗2~3次,以去除未完全反应的甲醛、氨水和板栗壳色素,然后将其均匀地摊放于表面皿中,150 ℃鼓风干燥固化3 h ,研磨并过0.25 mm的分样筛,即得甲醛交联板栗壳色素树脂。
1.3 零电荷点的测定
参考Nomanbhay[11]方法测定甲醛交联板栗壳色素树脂的零电荷点。将0.05 g的甲醛交联板栗壳色素树脂分别加入0.01 mol·L-1pH值为2、4、6、8、10的KCl溶液,300 K恒温摇床中以120 r·min-1振荡24 h,测定上清液pH值。吸附前后两者差值为0时所对应的pH值就是零电荷点(pHpzc)。
1.4 Ni(II)溶液配制
将NiCl2·6H2O溶于纯水中配制成1 g·L-1Ni(II)储备液,实验过程中根据需要稀释成不同浓度。
1.5 吸附实验
1.5.1 pH值优化实验 将0.1 g合成树脂,加入三角瓶中,装入50 ml浓度100 mg·L-1的Ni(II)溶液,使用HCl与NaOH调节不同pH值(2.5、3、4、5、6、7、8),然后将这些三角瓶置于120 rpm的摇床中26.8 ℃恒温振荡24 h。用装有滤膜的针头式过滤器过滤,收集滤液,测定滤液中Ni(II)浓度。
1.5.2 等温吸附实验 将0.1 g合成树脂分别投入50 ml pH值为7不同浓度Ni(II)溶液中。分别置于285、295、305、315 K的摇床上,120 rpm振荡24 h。再用装有滤膜的针头式过滤器过滤,测定滤液中Ni(II)浓度。
1.5.3 接触时间与吸附动力学实验 在磁力搅拌水浴锅中分别预热500 ml pH值为7,浓度为50、100、200 mg·L-1的Ni(II)溶液,加入1 g合成树脂,设置水浴锅磁力搅拌转速120 rpm,温度26.8 ℃。一定时间间隔取样,过滤并检测滤液中Ni(II)浓度。
1.5.4 Ni(II)浓度测定 在火焰原子吸收分光光度仪(AA320CRT,美国铂金埃尔默仪器公司)上进行测定Ni(II)。
1.6 计算方法
1.6.1 吸附量计算 合成树脂对重金属的吸附量(qe)用以下公式计算:
(1)
式中:qe为平衡吸附量(mg·g-1);C0为起始时Ni(II)的浓度(mg·L-1);C1为吸附后Ni(II) 的残余浓度(mg·L-1);v为吸附质溶液体积(L);m为吸附剂用量(g)。
1.6.2 等温吸附方程拟合 Langmuir等温吸附方程表达式为:
(2)
Freundlich等温吸附方程表达式为:
(3)
式中:qm为最大吸附量(mg·g-1);qe为平衡吸附量(mg·g-1);Ce为平衡时溶液中Ni(II)的浓度(mg·L-1);KL为Langmuir系数;KF为Freundlich系数;n为Freundlich模型指数。
1.6.3 动力学方程拟合
准一级动力学方程式为:
(4)
准二级动力学方程式为:
(5)
粒内扩散方程式为:
qt=kdt0.5+I
(6)
式中:qe为平衡吸附量(mg·g-1);qt为时刻吸附量(mg·g-1);t为接触时间(min);k1为准一级动力学速率常数(L·mg-1);k2为准二级动力学速率常数(g·g-1·min-1);kd为粒内扩散速率常数(mg·g-1·nin-0.5);I为一个与界面厚度有关的常数(mg·g-1)。
1.6.4 吸附热力学分析 对吸附过程进行热力学分析,有助于更好地理解吸附机理,为吸附工艺设计提供依据。为了解甲醛交联板栗壳色素树脂吸附Ni(II)的吸附机理,进行热力学分析时,Gibbs自由能变△G°(KJ·mol-1)用van’t Hoff方程计算[12]:
△G°=-RTlnKc
(7)
式中:△G°是吉布斯自由能变化量(KJ·mol-1);R是理想气体常数(8.314 J·mol-1·K-1);T为绝对温度(K)。
很多文献用Langmuir吸附常数KL和Freundlich吸附常数n为表观吸附平衡常数KC,本实验采用更符合数据的Langmuir方程吸附常数n或Langmuir方程吸附常数KL[13]。
△G°与焓变△H°(KJ·mol-1)和熵变△S° (J·mol-1·K-1)的关系如下:
△G°=△H°-T△S°
(8)
若△G°<0,吸附过程为自发过程;△G°>0,则吸附过程为非自发过程。△H°<0则表明吸附过程为放热反应,△H°>0表明吸附过程为吸热反应。△S°<0表明吸附过程体系变有序,△S°>0表明吸附过程体系混乱[14]。
1.7 数据处理
所有实验均独立重复3次,平均值作为测定结果。
2 结果与讨论
2.1 pH对甲醛交联板栗壳色素树脂吸附性能的影响
从图1可以看出,当pH值在2.5~3时吸附量只有0.73 mg·g-1,进一步增高pH值,吸附量增加,当pH值为7时吸附量达到最高,为20.02 mg·g-1。再进一步增加pH值,吸附量下降至19.28 mg·g-1。pH值在2.5~3.0时吸附量较低,因为此时溶液中存在大量的H+与Ni(II)竞争吸附位点。随着pH值的增加H+的含量逐渐减少,对重金属的吸附量逐渐升高[15-16]。pH值为5~6时吸附量增幅加大,可能是因为零电荷点(pHpzc)为5.7处于5~6之间,此过程中吸附剂表面电荷由正转负,作用力由斥转吸[17]。碱性条件下吸附量呈下降趋势,这可能与金属离子形成氢氧化物有关,从而阻碍了吸附剂对离子的吸附[18]。
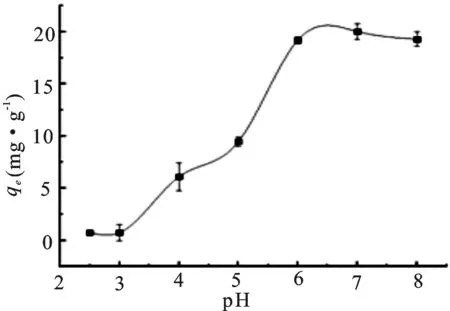
图1 吸附质溶液pH对甲醛交联板栗壳色素树脂吸附Ni(II)的影响
2.2 接触时间和初始浓度对甲醛交联板栗壳色素树脂吸附效果的影响
不同初始Ni(II)浓度下吸附量的变化如图2所示,在100 min内合成树脂吸附Ni(II)的速率很快,随后缓慢上升直至平衡。平衡时间因初始浓度而异,初始浓度为25 mg·L-1时平衡时间为300 min,初始浓度为200 mg·L-1时平衡时间为360 min,而100 mg·L-1则推迟至720 min才达到平衡。吸附量随时间变化的曲线却大致相同。这是因为吸附剂吸附重金属离子有三个步骤:重金属离子突破界面张力到达吸附剂表面;重金属离子由吸附剂表面向内部迁移;重金属离子在吸附剂内部与活性基团发生化学反应[19]。
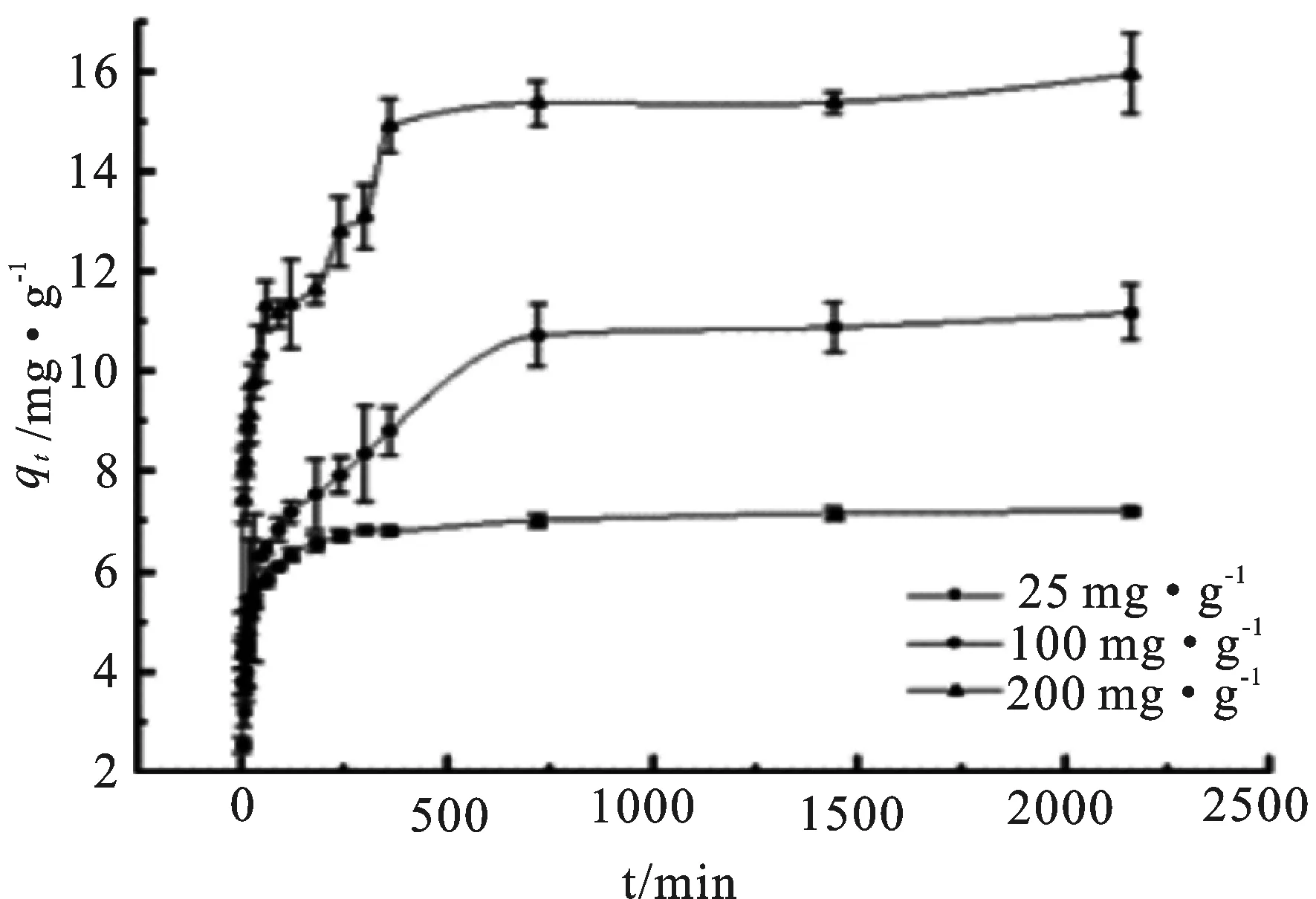
图2 不同接触时间和初始浓度下的甲醛交联板栗壳色素树脂吸附Ni(II)变化
2.3 甲醛交联板栗壳色素树脂吸附Ni(II)等温线分析
吸附等温线模型相关系数值接近1表明吸附过程符合该模型[20]。从图3和表1可以看出,Langmuir方程与Freundlich方程都能较好地描述甲醛交联板栗壳色素树脂对Ni(II)的吸附等温特征。相比较而言,Langmuir方程对该过程的描述更为准确,R2最高达到0.991 0。根据Langmuir模型计算出的理论最大吸附量与试验结果相近,这表明溶液中的Ni(II)在甲醛交联板栗壳色素树脂表面的单分子层吸附,即单层吸附在吸附过程中占主要地位。模型中KL表示吸附位点对吸附质亲和力大小,KL越大表示吸附结合的稳定性越强[21]。如表1,285 K至315 K KL逐渐增大,说明温度升高,吸附结合逐渐稳定,此吸附为吸热反应。
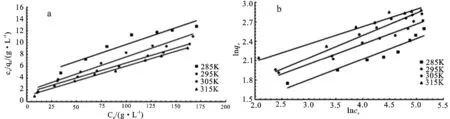
图3 甲醛交联板栗壳色素树脂对Ni(II)的Langmuir(a)和Freundlich(b)吸附等温线模型
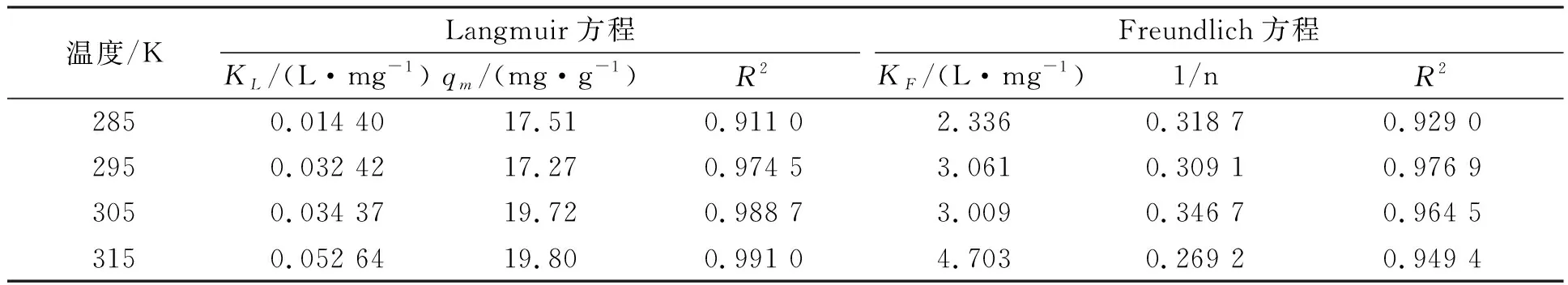
表1 不同温度下甲醛交联板栗壳色素树脂对Ni(II)的等温吸附参数
Freundlich模型中1/n是表现甲醛交联板栗壳色素树脂吸附Ni(II)的强度参数,当1/n<1时有利于吸附,特别是当1/n在0.1~0.5之间时吸附容易进行,而1/n>2时更难发生吸附[22]。由表1可得,4种温度的1/n相近,均小于1,这表明甲醛交联板栗壳色素树脂容易吸附Ni(II)。
2.4 甲醛交联板栗壳色素树脂吸附Ni(II)动力学模型分析
准一级和准二级动力学模型为常用的动力学拟合模型,前者基于扩散是吸附过程的速控步骤假设,后者则基于化学吸附机理控制速率假设[23]。从合成树脂对Ni(II)吸附动力学模型的拟合结果图4 a、b和表2可看出,二级动力学模型的决定系数大于其他两个模型更接近1,最大达到0.999 6,因此可以用准二级动力学模型描述合成树脂吸附Ni(II)的过程;准二级动力学理论平衡吸附量和实际平衡吸附量接近。因此吸附过程受化学吸附机理控制,化学键的形成是吸附过程的关键,涉及到吸附剂与吸附质之间的电子共用[24]。
粒内扩散模型拟合时,若直线通过原点,则表明粒内扩散是吸附的限速步骤;若不通过原点,则吸附过程还有其他重要方式。从使用粒内扩散拟合合成树脂对Ni(II)的吸附过程图4c可看出,分段拟合均不过原点,表明粒内扩散不是甲醛交联板栗壳色素树脂吸附Ni(II)的唯一控速环节。从拟合得出的速率常数表(表2)可看出,25 mg·L-1至200 mg·L-1kd逐渐增大,说明初始吸附质浓度越大越容易发生粒内扩散[25]。
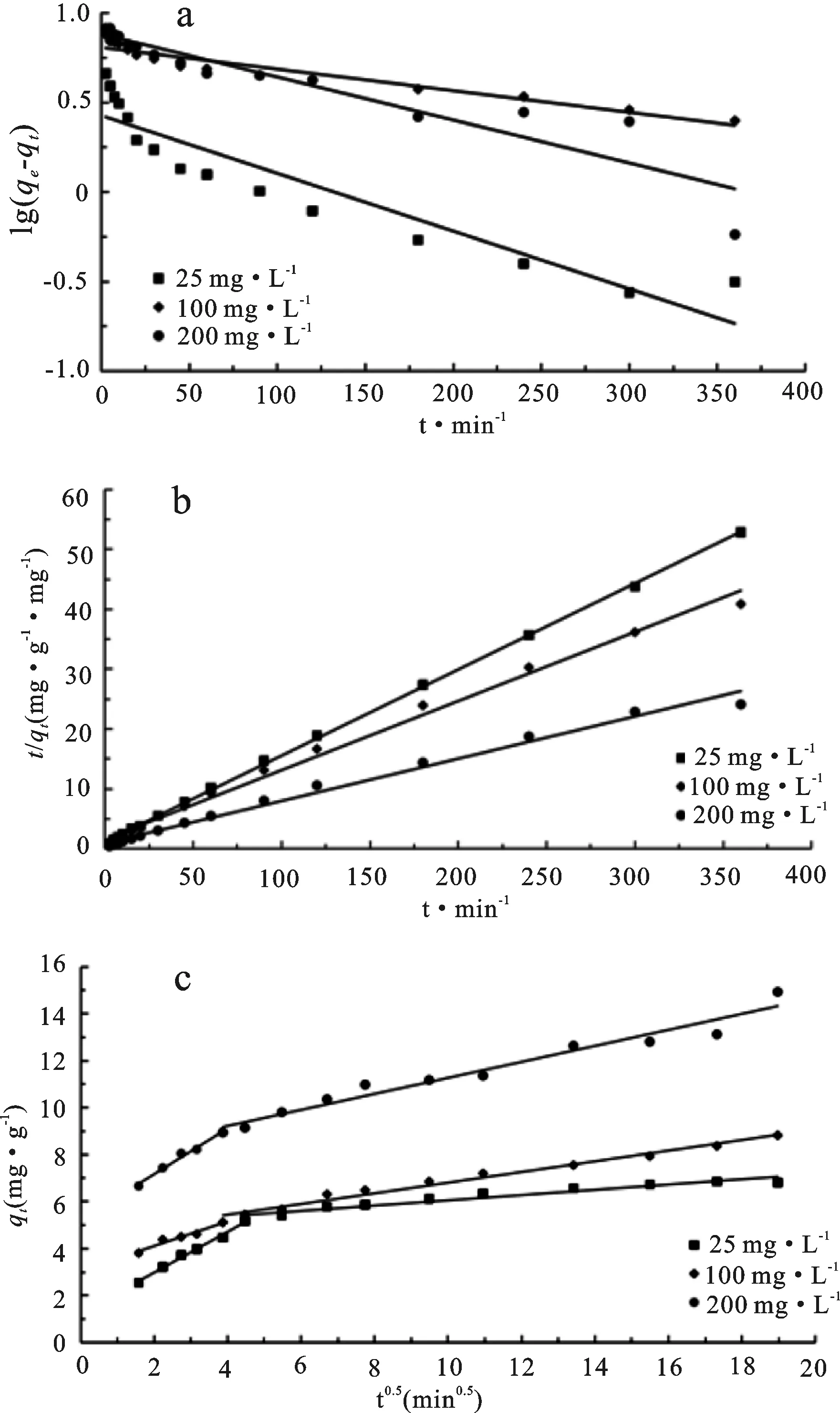
图4 甲醛交联板栗壳色素树脂吸附Ni(II)的线性准一级(a)、准二级(b)和粒内扩散(c)动力学模型
2.5 吸附热力学分析
从甲醛交联板栗壳色素树脂吸附Ni(II)热力学分析结果(图5、表3)看出,△G°<0,该吸附过程为自发过程,随着温度升高△G°的绝对值增大,表明温度升高有利于吸附进行;△H°>0表明吸附过程为吸热反应;△S°>0说明吸附过程体系混乱,自由度增加[14]。根据本实验△G°、△H°、△S°值的正负可以推断出甲醛交联板栗壳色素树脂吸附Ni(II)过程受熵驱动。
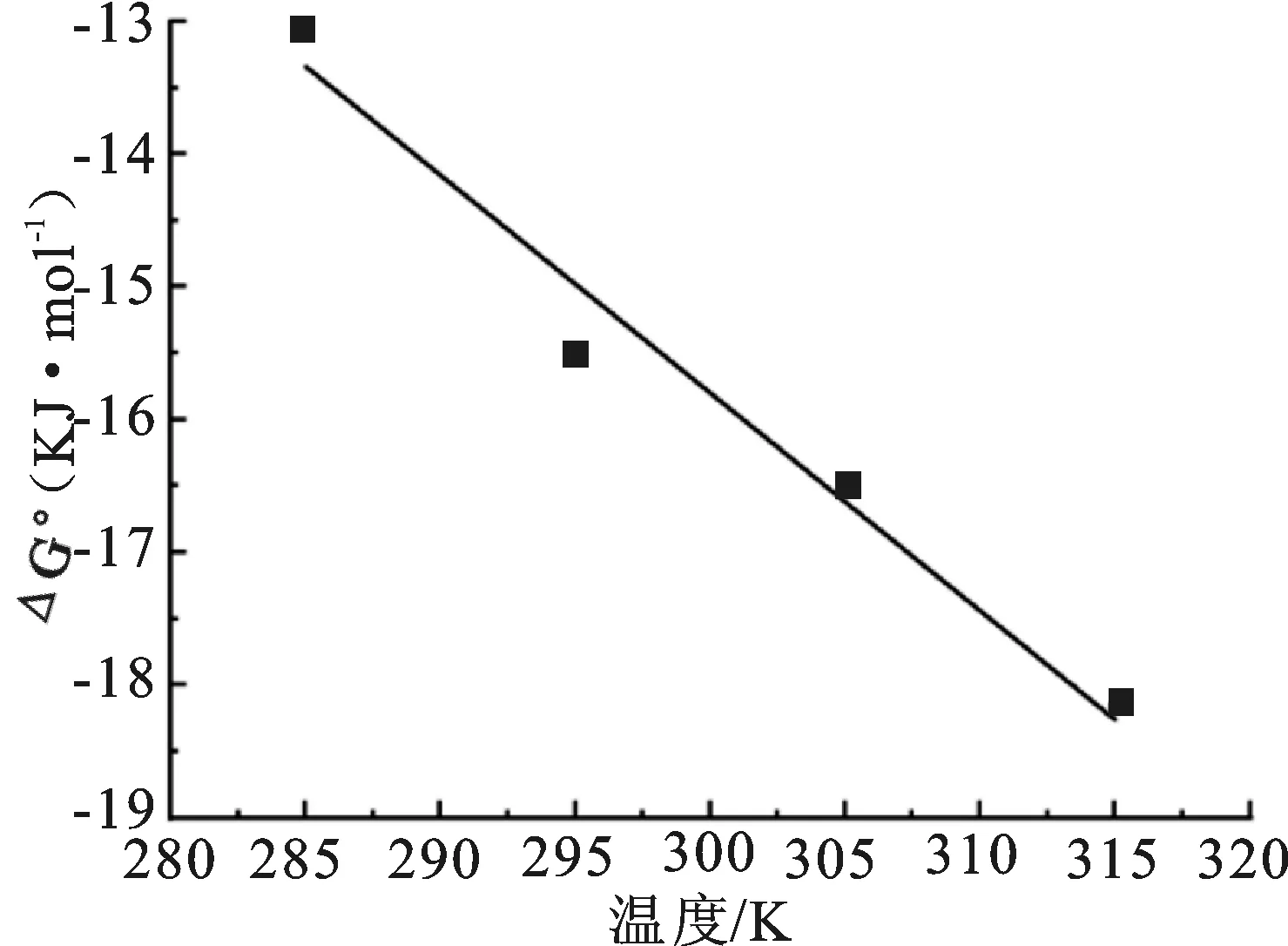
图5 甲醛交联板栗壳色素树脂吸附Ni(II)的van’t Hoff曲线
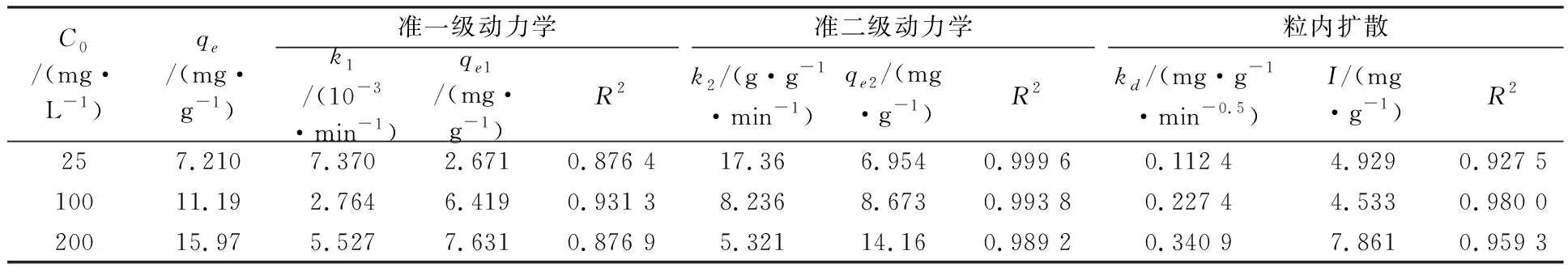
表2 不同初始浓度下甲醛交联板栗壳色素树脂吸附Ni(II)的动力学参数
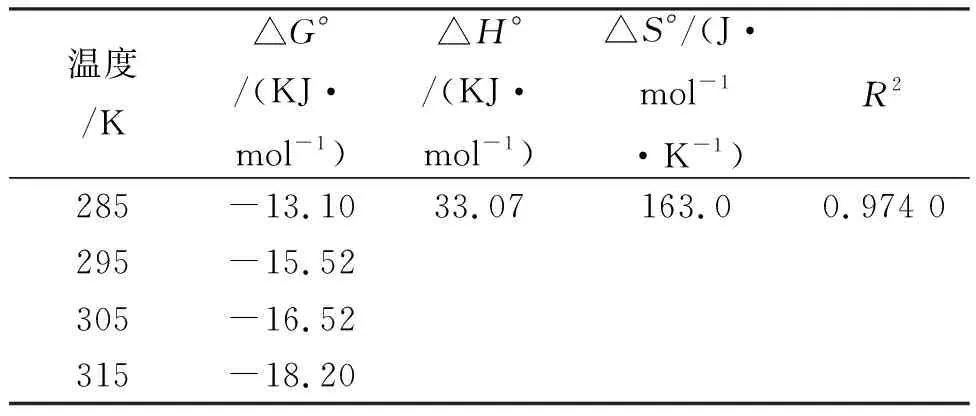
表3 甲醛交联板栗壳色素树脂吸附Ni(II)的热力学参数
3 结论与讨论
(1)利用板栗壳,采用氨水催化热固法合成的甲醛交联板栗壳色素树脂吸附Ni(II)的适宜pH值为7,720 min内吸附达到平衡。
(2)Langmuir方程与Freundlich方程都可以描述甲醛交联板栗壳色素树脂吸附Ni(II)的等温特征,而Langmuir方程描述得更为准确。因此吸附过程符合Langmuir模型,饱和吸附量为19.80 mg·g-1。表明吸附为单分子层吸附,温度升高 KL逐渐增大,说明温度升高,吸附结合逐渐稳定。
(3)二级动力学模型的决定系数大于其他两个模型更接近1,因此可以用准二级动力学模型描述合成树脂吸附Ni(II)的过程,证明吸附过程以化学吸附为主导,粒内扩散并非唯一的限速步骤。
(4)甲醛交联板栗壳色素对Ni(II)的吸附过程为吸热反应,可自发进行,受熵驱动。
