苯酚与碳酸钠反应再探究
2022-05-05张立惠贾卫国后勇军孙影
张立惠 贾卫国 后勇军 孙影




摘要:针对苯酚和碳酸钠反应实验过程中出现的异常现象,通过设计对比实验,运用紫外分光光度计检验反应产物,提供证据支持,详细分析并阐释苯酚与碳酸钠溶液反应过程中产生二氧化碳的原因。
关键词:苯酚;碳酸钠;数字化实验;紫外光谱
文章编号:1008-0546(2022)05-0095-03中图分类号:G632.41文献标识码: B
doi:10.3969/j.issn.1008-0546.2022.05.021
一、问题的提出
人教版高中化学教材(2019版)[1]中介绍了苯酚和碳酸钠溶液反应生成苯酚钠和碳酸氢钠,而在实验过程中,笔者采用CO2传感器测量密闭体系内碳酸钠溶液和苯酚溶液混合之后CO2含量的变化,一段时间后发现 CO2的含量增加。为什么会出现“CO2含量增加”的异常现象?已有文献对该问题的研究较少,多集中在通过平衡常数的计算,从理论上进行分析和讨论说明苯酚和碳酸钠反应只能生成苯酚钠而不能产生CO2[2-3]。为探究实验结果与理论相违背的原因,本研究利用数字化实验与现代仪器分析技术,对实验现象进行详细的原理分析及证据推理,以期帮助学生克服认知困难,并对中学化学教学提出建议。
二、实验过程
1.实验目的
从理论上分析,苯酚与碳酸钠溶液反应生成碳酸氢钠与苯酚钠,但在实验过程中,却检测出大量的二氧化碳气体产生。本研究使用Vernier无线 CO2传感器,对苯酚与碳酸钠混合溶液中的CO2含量进行测定。
2.实验仪器与试剂
Vernier无线 CO2传感器、恒温油浴锅(含搅拌功能)、电脑及配套软件(Vernier Graphical Analysis)、锥形瓶(250 mL)、量筒(50 mL)、磁子、0.5 mol/L碳酸钠溶液、0.5 mol/L苯酚溶液
3.实验装置
见图1。
4.实验步骤
(1)检查装置气密性:向锥形瓶中通入适量CO2气体,将CO2传感器插入锥形瓶,观察CO2测定含量示数是否稳定,若不稳定则需要对瓶口磨口部分进行进一步处理,示数稳定后方可进行实验;
(2)分别取0.5 mol/L碳酸钠溶液、0.5 mol/L 苯酚溶液各20 mL置于同一锥形瓶(250 mL)中,迅速插入 CO2传感器,置于30℃油浴锅中;
(3)启动磁力搅拌功能,点击数据采集按钮,待曲线趋于稳定时停止采集,重复实验3次,以取得最佳实验曲线。
(4)以相同实验步骤测定20 mL 0.5 mol/L碳酸钠溶液与20 mL水混合时CO2含量。
5.实验结果与分析
通过图2可以发现,0.5 mol/L碳酸钠溶液与0.5 mol/L苯酚溶液反应时,测定体系CO2含量持续缓慢上升;将 20 mL苯酚替换为20 mL水后,测定体系 CO2含量持续下降,且下降速率较快直至趋于稳定。
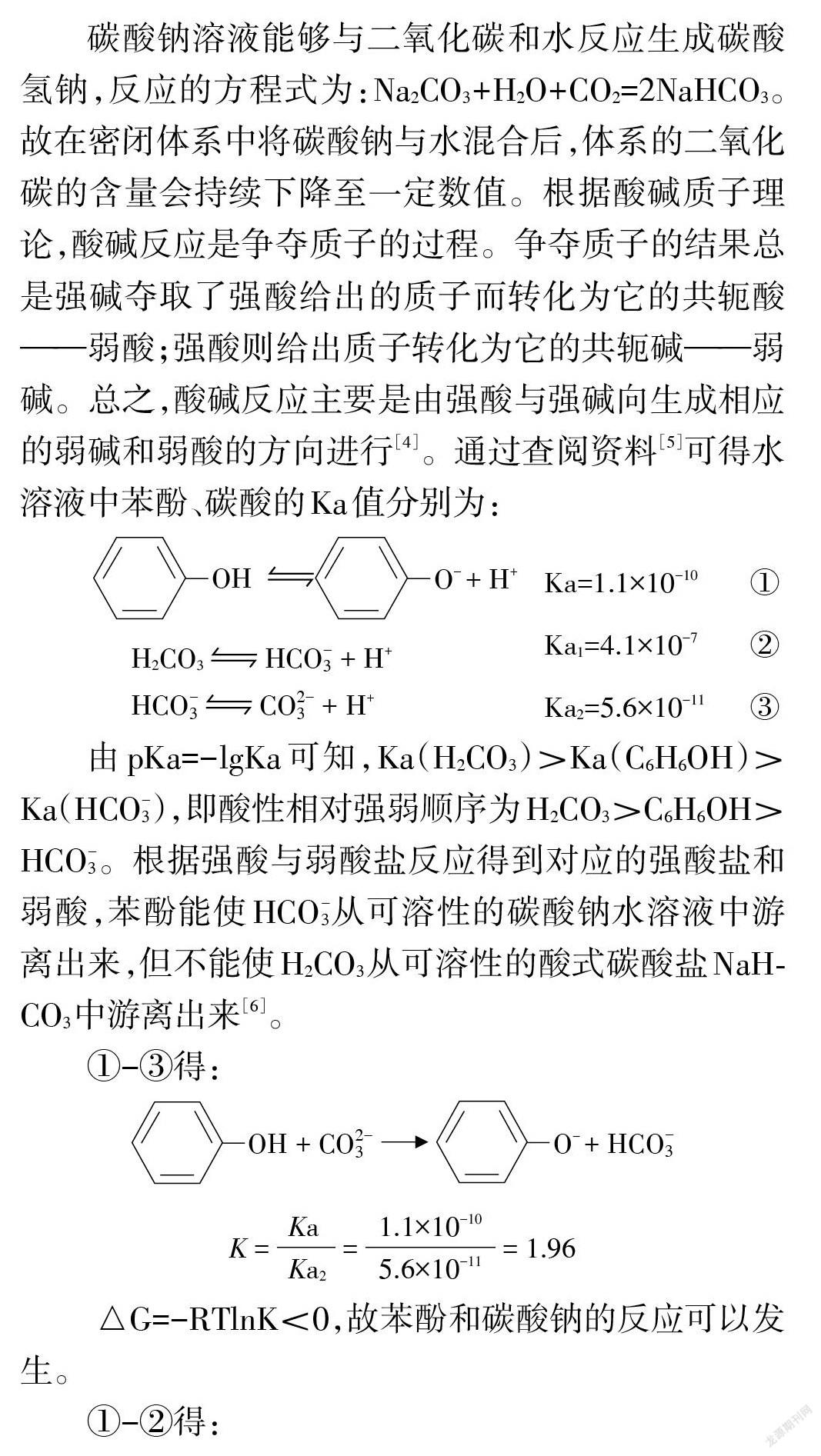
碳酸钠溶液能够与二氧化碳和水反应生成碳酸氢钠,反应的方程式为: Na2CO3+H2O+CO2=2NaHCO3。故在密闭体系中将碳酸钠与水混合后,体系的二氧化碳的含量会持续下降至一定数值。根据酸碱质子理论,酸碱反应是争夺质子的过程。争夺质子的结果总是强碱夺取了强酸给出的质子而转化为它的共轭酸——弱酸;强酸则给出质子转化为它的共轭碱——弱碱。总之,酸碱反应主要是由强酸与强碱向生成相应的弱碱和弱酸的方向进行[4]。通过查阅资料[5]可得水溶液中苯酚、碳酸的Ka值分别为:
由pKa=-lgKa 可知,Ka(H2CO3)>Ka(C6H6OH)> Ka(HCO-3),即酸性相对强弱顺序为H2CO3>C6H6OH> HCO-3。根据强酸与弱酸盐反应得到对应的强酸盐和弱酸,苯酚能使 HCO-3從可溶性的碳酸钠水溶液中游离出来,但不能使H2CO3从可溶性的酸式碳酸盐NaH⁃ CO3中游离出来[6]。
①-③得:
△G=-RTlnK<0,故苯酚和碳酸钠的反应可以发生。
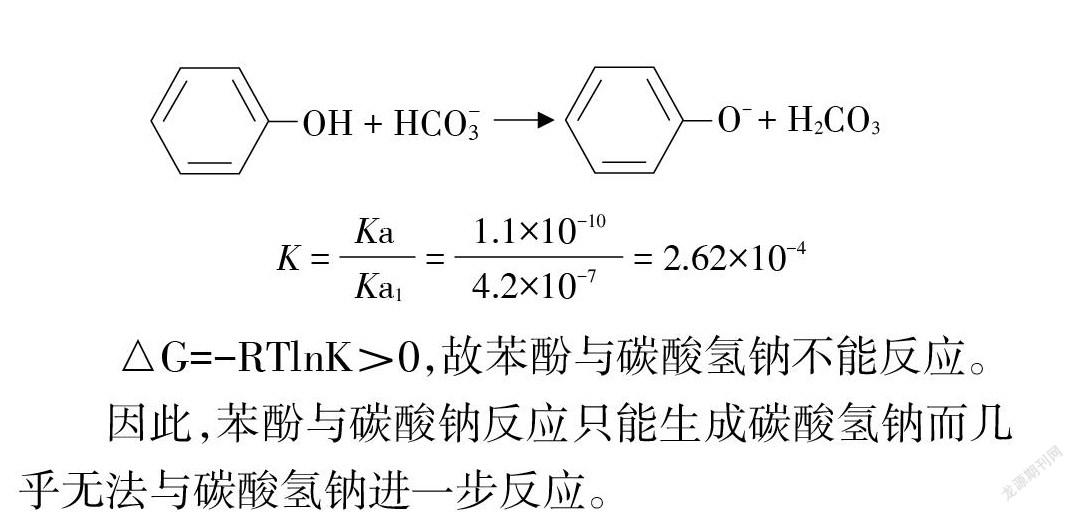
①-②得:
△G=-RTlnK>0,故苯酚与碳酸氢钠不能反应。
因此,苯酚与碳酸钠反应只能生成碳酸氢钠而几乎无法与碳酸氢钠进一步反应。
6.对实验异常现象的解释探究
通过理论分析可以得出结论,苯酚与碳酸钠反应产物不可能产生 CO2,而实验测定碳酸钠溶液与苯酚溶液反应体系CO2含量确实有所升高,对此提出猜想:是否是碳酸氢钠的分解导致体系CO2含量的升高?基 于此,利用无线CO2传感器测定碳酸氢钠溶液和苯酚共体系及理论计算浓度下碳酸氢钠溶液单体系的CO2 含量变化,结果如图3所示:
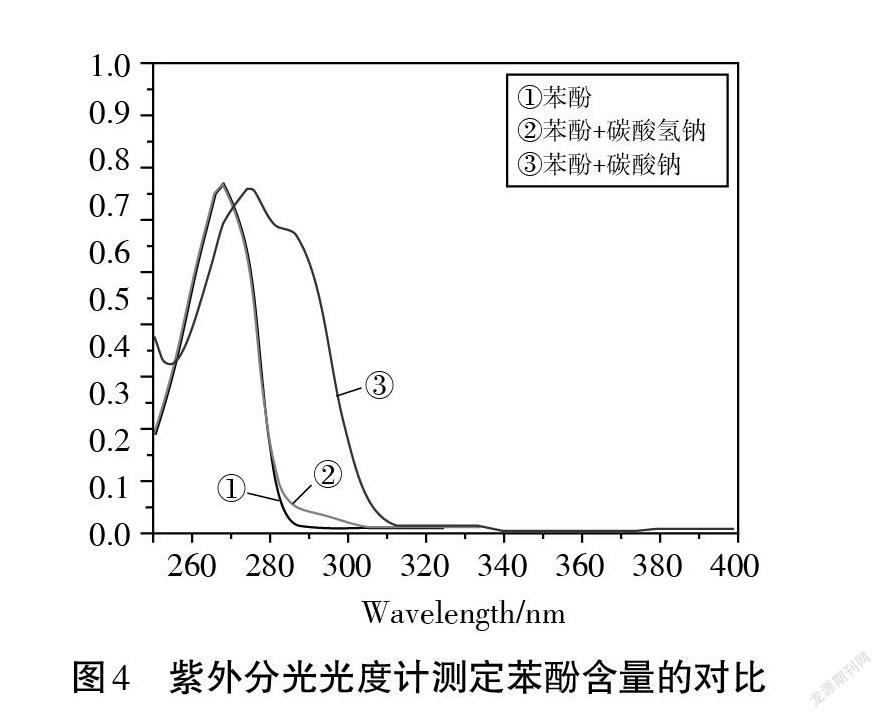
通过图3可以发现,尽管理论上碳酸氢钠溶液和苯酚溶液并不会反应,但实验测得相同温度下,碳酸氢钠溶液与苯酚溶液共体系下CO2含量比碳酸氢钠溶液单体系的CO2含量更高。为了进一步探究苯酚与碳酸氢钠是否真的发生反应产生少量 CO2。为此,本实验采用紫外分光光度计来监测苯酚与碳酸氢钠体系,测定反应前后苯酚含量的变化,并将其与苯酚与碳酸钠进行对比,结果如图4所示:
查阅文献可知,苯酚的最大吸收波长为270 nm[7],由图4可知,苯酚与碳酸氢钠混合之后的溶液与苯酚溶液的紫外吸收光谱均在270 nm 出现了峰值且基本重合,苯酚的量几乎没有减少,说明苯酚几乎未与碳酸氢钠发生反应。而苯酚与碳酸钠混合之后的溶液紫外吸收光谱发生了红移,这是由于苯酚与碳酸钠反应过程中,生成的苯酚负离子,由于其与苯环的共轭增强,使其紫外吸收发生了红移,由此说明了苯酚和碳酸钠发生反应生成了苯酚钠。
Na2CO3溶液与苯酚反应生成 NaHCO3和苯酚钠, NaHCO3溶液从室温升高到30℃,有利于反应④、⑤、⑥平衡右移,CO2浓度升高。
在 NaHCO3+ 苯酚的体系中存在可逆反应⑦,由于该反应的平衡常数K=2.62×10-4,宏观上可以认为苯酚与 NaHCO3不反应,但该反应在实验条件下可以很快建立平衡,所以,有少量 H2CO3生成,从而有少量 CO2气体放出,通过传感器检出。
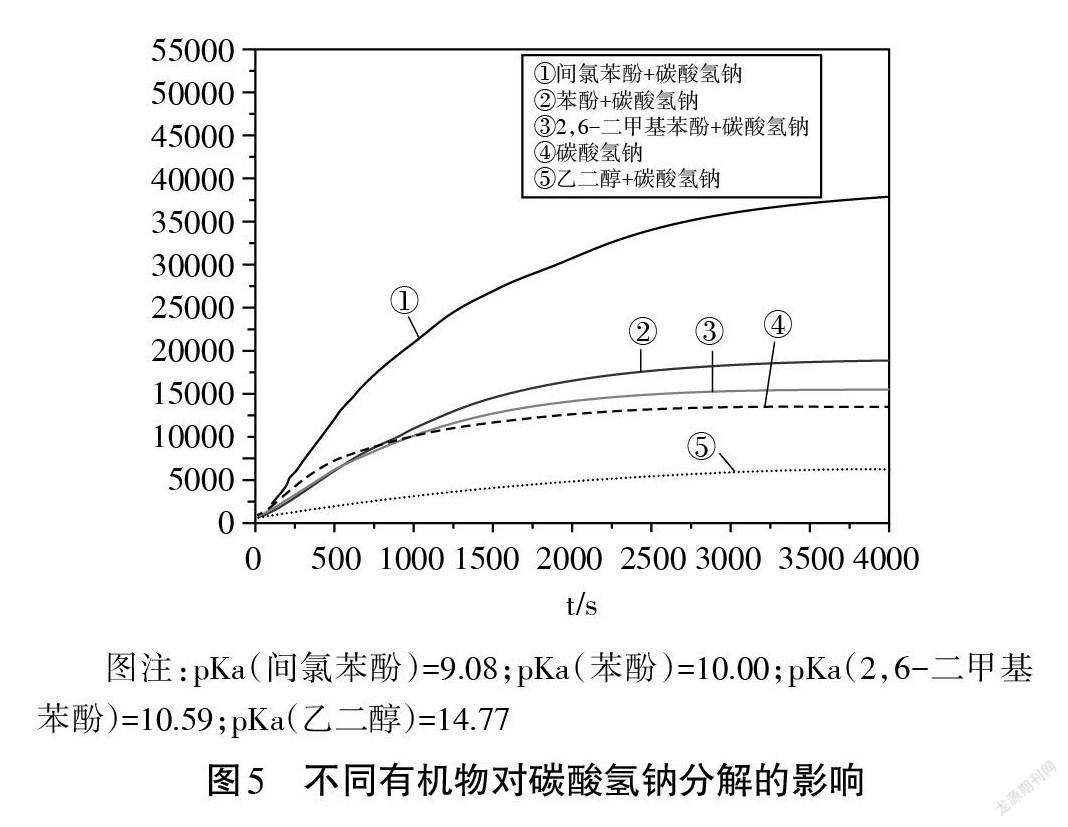
为此,本研究继续探究了不同pKa 的有机物是否会对碳酸氢钠的分解产生影响。研究选取几种均不与碳酸氢钠反应且 pKa 各不相同的有机物(间氯苯酚、苯酚、2,6-二甲基苯酚、乙二醇),并将上述有机物分别与碳酸氢钠溶液混合后,测定体系内二氧化碳含量的变化。
由图5可以看出,在30℃条件下,20 mL 0.5 mol/L 的上述几种有机物分别与相同体积、相同浓度的碳酸氢钠溶液混合后,测定体系内CO2含量的变化。结果发现,有机物pKa值越大,碳酸氢钠分解产生的CO2越少。因此,在相同温度下碳酸氢钠溶液与苯酚溶液共体系产生的CO2比单独碳酸氢钠溶液产生的CO2含量更高。
三、实验结论与启示
1.实验结论
碳酸钠溶液与苯酚发生反应,生成了苯酚钠和碳酸氢钠。数字化实验中检测到的二氧化碳,来源于反应产物碳酸氢钠的分解,且苯酚体系对碳酸氢钠分解有促进作用。曲线表征为学生深刻理解苯酚与碳酸钠溶液的反应提供了强有力的证据支持。同时运用现代技术,如紫外光谱的吸收峰再一次佐证了苯酚与碳酸钠溶液反应生成了碳酸氢钠的结论。
2.实验启示
本研究利用CO2传感器多角度逐步探究苯酚与碳酸钠的反应,以“发现问题-解决问题-发现新问题-解决新问题”的探究进程,促进学生对化学反应异常现象的深度研究。利用现代实验测试技术为化学反应提供强有力的证据,回应并澄清了学生存在的疑惑,让学生感受到化学技术进步的同时,引导学生基于证据进行推理,引发学生高阶思维。
参考文献
[1]人民教育出版社,課程教材研究所,化学课程教材研究开发中心.普通高中教科书:化学(选择性必修3)[M].北 京:人民教育出版社,2019:62.
[2]魏钊,林丹.关于苯酚和碳酸钠反应的再探讨[J].化学教学,2009(8):46-47.
[3]季美娟.关于苯酚和碳酸钠反应的探讨[J].化学教育,2007(3):51.
[4]大连理工大学无机化学教研室.无机化学(第五版)[M].北京:高等教育出版社,2006:112.
[5]武汉大学.分析化学(第五版)[M].北京:高等教育出版社,2006:383-384.
[6]万新军,宋明友.苯酚溶于碳酸钠吗?[J].化学教育,1994(9):37-38.
[7]麦麦提图尔荪·塔伊尔,亚森江·吾甫尔,买买提热夏提·买买提,等.紫外吸收光谱法测定污染废水中苯酚含量的研究[J].环境污染与防治,2015,37(2):111.