特发性肺间质纤维化患者预后不良的影响因素及预测价值
2022-05-02刘薇张玲鲍洁高勇
刘薇,张玲,鲍洁,高勇
(河北省胸科医院呼吸与危重症医学一科,河北 石家庄 050000)
特发性肺间质纤维化是一种弥漫性结构破坏性肺部疾病,目前发病机制尚未完全阐明,多数研究者认为是由于肺泡上皮细胞受损后分泌过多的纤维生长因子和细胞因子,使上皮间质转化,活化成纤维细胞,形成成纤维细胞灶,并出现细胞外基质大量沉积,最终形成纤维条索并牵拉周围肺组织形成蜂窝肺[1-2]。该病起病较为隐匿,早期以肺泡炎为主,多表现为干咳少痰、胸闷、进行性呼吸困难等,影像学可见胸膜或双下肺网格状、磨玻璃状阴影,活检可见成群的纤维细胞灶[3]。以>40岁的男性多见,且预后较差,其中位生存期为2~3年,5年生存率<50%。随着病情的进展,极易引发低氧血症、肺源性心脏病、肺栓塞、弥漫功能性障碍等疾病,疾病后期多数患者因肺功能恶化引起的呼吸衰竭而死亡[4-5]。因此,尽早了解特发性肺间质纤维化患者预后情况,寻找可准确监测患者病情进展的指标,提早进行有效干预,对延长患者的生存时间,改善患者生活质量有重要意义。本研究旨在探讨特发性肺间质纤维化患者预后不良的影响因素及预测价值。
1 资料与方法
1.1 一般资料
选取2019年5月至2021年5月河北省胸科医院60例诊断为特发性肺间质纤维化的患者为研究对象。纳入标准:(1)符合2015年美国胸科学会(ATS)联合欧洲呼吸学会(ERS)、日本呼吸学会(JRS)以及拉丁美洲胸科协会(ALAT)颁布的特发性肺间质纤维化治疗指南中的相关诊断标准[6],且经影像学检测证实;(2)近两个月内未服用过免疫抑制剂或皮质类固醇药物;(3)自愿配合本次研究并签署知情同意书,符合医学伦理性原则。排除标准:(1)合并其他呼吸系统疾病,如肺癌、支气管哮喘、支气管扩张症、胸廓畸形、慢性阻塞性肺疾病等;(2)血流动力学不稳定(如急性左心衰、顽固性低血压、恶性心律失常、不稳定性心绞痛、近1个月内有急性心肌梗死病史等);(3)合并其他系统性疾病的患者,如严重肝、肾功不全、恶性肿瘤、神经肌肉疾病或严重脑血管意外后遗症者;(4)影响肌力的神经系统疾病,患有不稳定的骨折;(5)患有精神类疾病;(6)合并深静脉血栓的患者。
1.2 方法
1.2.1 治疗方法 所有患者均接受口服吡非尼酮(北京凯因科技股份有限公司)治疗,初始剂量200 mg/次,治疗第2周400 mg/次,治疗第3周开始增加至600 mg/次,3次/d,于餐后服用,持续服用4个月[7]。
1.2.2 疗效评估及分组 显效为患者咯痰、咳嗽及肺部啰音等症状明显减轻,X线胸片或高分辨率CT(HRCT)异常影像明显减少;有效为患者临床症状及体征有所缓解,X线胸片或HRCT异常影像略有减少;无效为患者各项症状均无变化或出现病情加重的情况,X线胸片或HRCT异常影像增多,特别是出现了蜂窝肺或肺动脉高压迹象。治疗4个月后,将显效和有效共44例归为预后良好组,无效16例归为预后不良组。
1.3 观察指标
(1)一般资料:包括患者性别、年龄、病程、酗酒、吸烟、干咳、胸闷情况、肺功能[肺总量(TLC)、肺活量(VC)及第1秒用力呼气量/用力肺活量(FEV1/FVC)]、氧分压(PaO2)、肿瘤坏死因子α(TNF-α)、白细胞介素4(IL-4)、干扰素γ(IFN-γ)表达水平;(2)影响特发性肺间质纤维化患者预后的因素;(3)危险因素对特发性肺间质纤维化患者预后不良的预测价值。
1.4 统计学分析

2 结果
2.1 两组患者一般资料比较
两组患者年龄、干咳、PaO2及TNF-α、IL-4、IFN-γ表达水平比较,差异有统计学意义(P<0.05)。见表1。
表1 两组患者一般资料比较
2.2 影响特发性肺间质纤维化患者预后的因素
将一般资料中可能影响特发性肺间质纤维化患者预后的因素纳入多因素Logistic回归分析方程,以是否预后不良为因变量,各项因素为协变量。排除混杂因素后结果显示,PaO2、TNF-α、IL-4、IFN-γ是特发性肺间质纤维化患者预后不良的危险因素(P<0.05)。见表2。
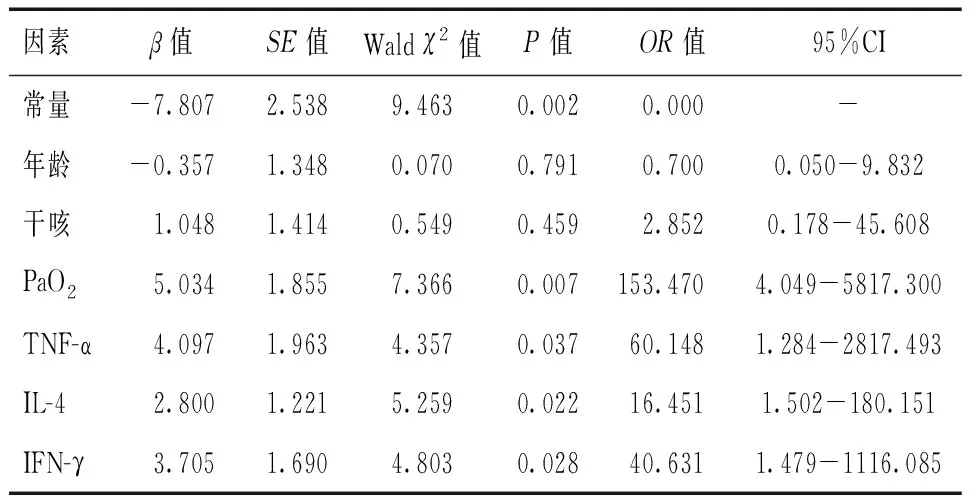
表2 影响特发性肺间质纤维化患者预后的因素
2.3 危险因素对特发性肺间质纤维化患者预后不良的预测价值
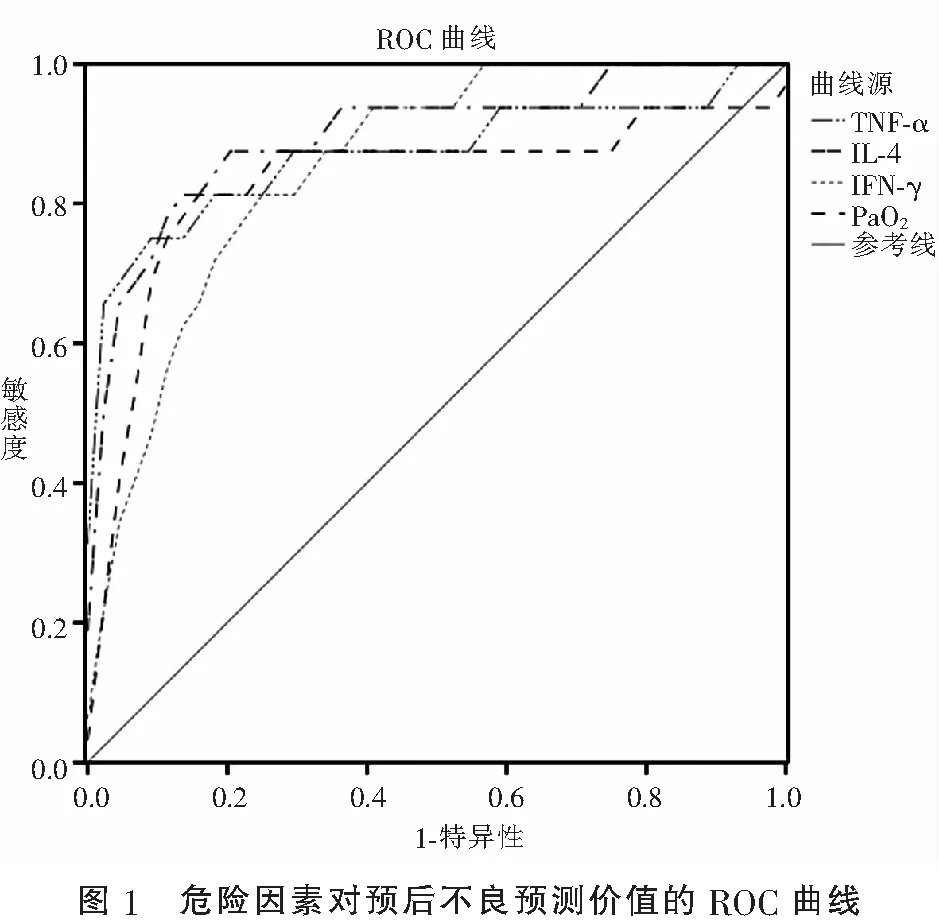
ROC曲线分析显示,PaO2、TNF-α、IL-4、IFN-γ的AUC分别为0.831、0.875、0.901和0.855;cut-off值分别为50.61 mmHg、12.91 pg/mL、66.52 pg/mL和23.22 pg/mL。其中IL-4Y预测价值较高(P<0.05),PaO2、TNF-α和IFN-γ预测价值中等(P<0.05)。见表3及图1。

表3 危险因素对预后不良的预测价值
3 讨论
目前治疗特发性肺间质纤维化除肺移植外并无有效的治愈方法,临床上主要采用免疫抑制与激素进行治疗,尽量减缓病情发展,降低肺功能下降速度,改善患者已发生纤维化的程度,避免出现急性加重情况,以期减轻患者痛苦,延长患者寿命,改善患者生活质量等。本研究60例患者均采用吡非尼酮治疗4个月,患者临床表现及细胞因子指标均有所改善。吡非尼酮是一种光谱抗纤维化药物,具有抗氧化和抗炎的作用,能减少TNF-α的生成,同时降低PDGF、TGF-β1和IGF-I的水平,抑制胶原合成,从而抑制成纤维细胞增殖,减少细胞外基质沉积,起到抗纤维化的作用,使患者肺功能得到改善,延缓疾病进展[9-11]。
本研究对比两组特发性肺间质纤维化患者预后情况,单因素分析发现,年龄、干咳、PaO2、TNF-α、IL-4、IFN-γ表达水平存在差异(P<0.05)。多因素排除混杂因素后PaO2、TNF-α、IL-4、IFN-γ指标为预后不良的危险因素(P<0.05)。研究[12-13]显示,年龄是特发性肺间质纤维化的危险因素之一,而本研究未得出此结论,原因可能由于病例数较少,患者年龄散无法较好的形成统计学模型。ROC曲线分析显示,PaO2、TNF-α、IL-4和IFN-γ四项指标的诊断价值均在中等以上(P<0.05),有较高的预测诊断意义。动脉血从肺内摄取O2,形成PaO2,PaO2的高低反映了肺毛细血管摄氧状况,也是反映外呼吸状况的指标。特发性肺间质纤维化患者因肺间质炎性反应及肺间质纤维增生,使吸入的氧气无法弥散入血管,造成患者缺氧、憋喘、呼吸困难等症状,过度通气也进一步降低了患者PaO2水平。本研究结果验证了这个结论,预后不良组患者PaO2水平较预后良好组偏低,且用于预测预后不良有一定的价值(P<0.05)。TNF-α为炎症级联反应的调节因子,是中性粒细胞和嗜酸性粒细胞的趋化因子,能刺激产生超氧化物,释放溶酶体,可刺激成纤维细胞聚集并快速增殖,促进胶原蛋白的合成,增加成纤维细胞的基因表达促进纤维化。TNF-α与肺泡上皮细胞表面受体结合,引起肺泡上皮细胞出现凋亡、坏死、脱屑、再生,损伤的细胞组织会产生更多TNF-α,持续诱发炎症形成纤维化。TNF-α还可与巨噬细胞产生的纤维连接蛋白共同作用于受损的肺组织加重炎症反应,形成急性肺泡炎[14-15]。IL-4是Th2中最具代表性的因子,主要由嗜酸性细胞和杀伤T细胞产生,在天然免疫和适应性免疫反应中均起到了关键性作用。肺泡上皮细胞损伤刺激嗜碱性粒细胞分泌IL-4,IL-4则刺激树突状细胞向其他免疫细胞呈递抗原并影响巨噬细胞的交替激活,由IL-4激活的巨噬细胞产生胶原分解因子基质金属蛋白酶-12,诱导损伤后的纤维化反应[16]。IL-4能刺激成纤维细胞大量增殖,引起肺组织结构重塑,肺泡壁基底膜增厚同时出现弥散性上皮纤维化,从而导致肺顺应性降低,肺功能逐渐下降[17]。IFN-γ是Th1的标志性细胞因子,具有抗病毒,抗肿瘤和免疫调控的作用,而且可拮抗调节IL-4的致纤维作用。有观点认为Th1和Th2平衡失调导致由此介导的免疫反应参与的肺损伤是引起肺间质纤维化的发病机制。目前已证实当Th2高表达时会发生肺间质纤维化,因IL-4在Th2中最具代表性,通过研究IL-4水平的变化可较直观地阐明Th2在肺间质纤维化患者的水平变化。当IFN-γ水平较低时,对IL-4纤维作用的拮抗能力减弱,使更多的纤维母细胞被激活,导致肺间质胶原沉积形成瘢痕[18-19]。本研究预后不良组IL-4水平高于预后良好组(P<0.05),IFN-γ水平则低于预后良好组(P<0.05),且IL-4指标的AUC值>0.90,因此分析IL-4和IFN-γ表达水平,可较好地预测特发性肺间质纤维化患者的预后情况。
综上所述,PaO2、TNF-α、IL-4、IFN-γ水平是特发性肺间质纤维化患者预后的危险因素,且具有较高的预后预测诊断价值。
