Foxp3和SMARCE1在宫颈癌中的表达及临床意义
2022-05-02周有俭刘曙光龙嘉莉曾超
周有俭,刘曙光,龙嘉莉,曾超
(中山大学附属第八医院病理科,广东 深圳 518033)
在全世界范围内,宫颈癌的发生率和致死率在女性生殖系统肿瘤中均为第一[1]。随着临床技术水平的提升,宫颈癌在诊疗方案已取得突破性进展(如手术方式、放化疗等),显著提高早期宫颈癌患者预后。但对于进展期的宫颈癌患者,现有临床治疗方案的疗效难以进一步提高[2]。宫颈癌发病相关分子较为复杂,探索与发病相关的新分子标志物对于宫颈癌的预防及靶向治疗尤为重要。
叉头样转录因子3(forkhead box protein 3,Foxp3)的表达,通过诱导体内T淋巴细胞功能紊乱,诱导癌细胞免疫逃逸[3-4]。除调节性T细胞(regulatory T cells,Treg细胞)表达Foxp3外,肺癌、肠癌和胶质瘤等部分实体肿瘤细胞中也存在不同水平的表达[5-9];SMARCE1的表达与乳腺癌、卵巢癌和胃癌患者的预后相关,并且SMARCE1是促进乳腺癌细胞浸润和转移的关键基因[10-14]。本研究拟探讨 Foxp3、SMARCE1蛋白的表达水平与宫颈癌患者临床病理特征的相关性。
1 资料与方法
1.1 一般资料
选取2015年1月至2020年12月中山大学附属第八医院病理科收治的60例宫颈癌患者作为研究组,同时选取同期30例慢性宫颈炎组织作为对照组。研究组中,年龄35~58岁,平均(46.5±0.8)岁;宫颈上皮内瘤变(cervicalintraepithelial neoplasia,CIN)15例,包括CIN1级4例、CIN2级6例、CIN3级5例。对照组中,年龄 30~55岁,平均(42.5±0.4)岁。
1.2 组织芯片制作
对每例组织标本,先在苏木素-伊红染色(hematoxylin and eosin,HE)切片上确定典型的组织,并在相应的蜡块上作好标记,将组织转移蜡模中。取97.5 g石蜡和2.5 g蜂蜡混合,反复加温溶解,冷却数次,制成空白蜡块。在该蜡块范围内组织阵列,用组织仪打孔(0.6 mm)制成组织微阵列模块。将构建好的组织芯片蜡块放入55 ℃ 温箱中约1~2 h,在蜡将要完全溶解前取出,室温下冷却,使蜡与新插入的小圆柱状组织融为一体,取下蜡块,于 4 ℃ 冰箱中保存备用。
1.3 免疫组化
于二甲苯中将组织芯片脱蜡,梯度酒精水化。磷酸盐缓冲液(PBS)冲洗,抗原修复后甩干。Foxp3一抗(德国Santa 公司,sc-53876,浓度1∶50); SMARCE1一抗(英国abcam公司,ab131328,浓度1∶100),室温孵育3 h。加入辣根过氧化物酶标二抗,室温孵育20 min。二氨基联苯胺四盐酸盐(DAB)显色,苏木素染色,封片。选取20个视野,每个视野计数100个癌细胞,对癌细胞染色强度和阳性细胞比例进行评分。染色强度:无着色为0分,浅黄色1分,黄色2分,棕色3分;阳性细胞比例:<10%为1分,10%~50%为2分,>50%为3分。染色强度和阳性细胞比例得分之和≥3分记为阳性。
1.4 质粒构建及转染
从HeLa细胞中提取信使核糖核酸(mRNA),通过逆转录聚合酶链反应扩增人Foxp3(NM_014009.4)全长互补/拷贝脱氧核糖核酸(cDNA)。引物序列设计:Foxp3-F∶5-′TGGTACCGAGCTCGCCACCATGCCCACCAGGCCTGGCAAG-3′;Foxp3-R∶5-′GATATCTGCAGAATTCTCAGGGGCCAGGTGTAGGGTTG-3′。将Foxp3 DNA片段克隆入pcDNA3.1构建重组pcDNA3.1-Foxp3质粒。用Lipofectamine 2000(美国Invitrogen公司)将空质粒pcDNA3.1和过表达质粒pcDNA3.1-Foxp3转染SiHa细胞。
1.5 Western blot实验
提取各组宫颈癌细胞蛋白,取上清液采用聚氰基丙烯酸正丁酯(BCA)试剂盒进行蛋白定量,加入5×Loading Buffer煮沸后,使用SDS-PAGE凝胶电泳分离蛋白,聚偏氟乙烯(PVDF)转膜、5%脱脂奶粉封闭,用1∶1 000稀释后的一抗过夜孵育,次日选择辣根过氧化物酶(HRP)标记的二抗,增强型化学发光(ECL)试剂盒显影。采用Bio-Rad凝胶成像系统检测染色条带的强度,计算目的蛋白和内参蛋白的光密度比值。
1.6 细胞免疫荧光实验
室温下4%多聚甲醛固定细胞15 min,室温下0.5% Triton X-100浸润20 min,然后与一抗孵育。主要使用的抗体如下: Foxp3 (1∶50稀释,德国santa), smarce1 (1∶100稀释,英国abcam)。4 ℃ 孵育过夜,加荧光二抗,滴加4′,6-二脒基-2-苯基吲哚(DAPI)避光孵育5 min,对标本进行染核,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
1.7 双荧光素酶实验
测序确定SMARCE1启动子片段(在5-3 bp和452-460 bp区域)并克隆到pGL3-Basic载体(Wisconsin,Promega)中。将细胞接种于24孔板,瞬时转染含有萤火虫荧光素酶报告子和重组启动子报告子的质粒。荧光素酶活性在孵育24 h后,使用双荧光素酶检测试剂盒(中国碧海)进行测定。转染效率以Renilla荧光素酶活性为标准。特异性启动子活性表现为实验组与对照组的变化。
1.8 染色质免疫共沉淀实验
染色质免疫共沉淀实验是依照ChIP检测试剂盒(美国Epigentek)实验步骤进行。5 μg Foxp3抗体(英国Abcam)和20 μL完全重悬蛋白A/G磁珠免疫沉淀染色质-蛋白复合物。实时荧光定量聚合酶链式反应(qPCR)扩增感兴趣区域或内部阴性控制区。每个样品进行3个重复的分析,沉淀的DNA的数量计算为输入样品的百分比。用于Chip-qPCR定量分析的引物列为:SMARCE1 F∶5′-TGTCAAAATCTCCACCCTGATG-3′;SMARCE1 R∶5′-CCACCACACCCTGCTAATTT-3′。
1.9 统计学分析
采用SPSS 19.0软件进行统计分析。计数资料以[n(%)]表示,组间比较使用χ2检验;等级资料以频数表示,组间比较使用U检验;Foxp3和SMARCE1 表达的相关性采用Spearman秩相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1 各组织Foxp3、SMARCE1阳性表达率比较
研究组Foxp3和SMARCE1阳性表达率均高于对照组,差异均有统计学意义(P<0.05)。见表1及图1。
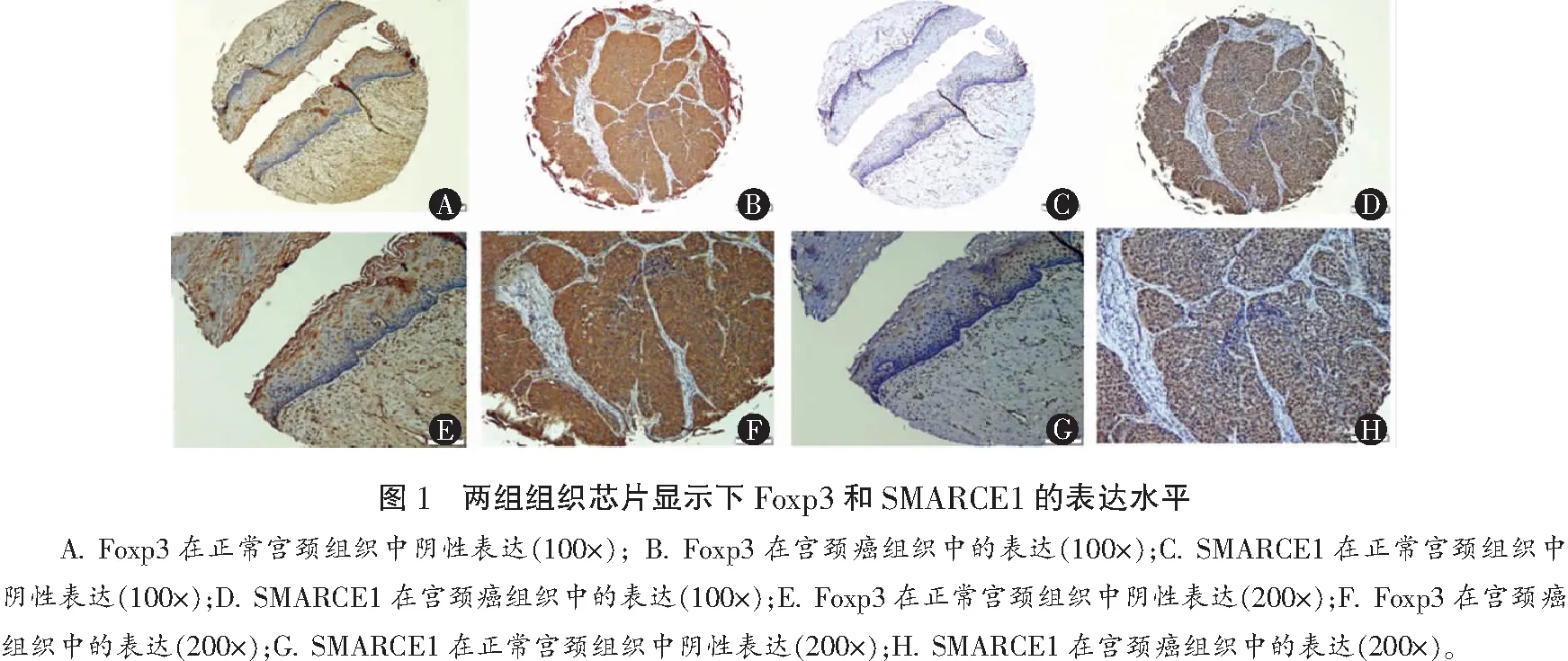

表1 两组Foxp3和SMARCE1表达比较[n(%)]
2.2 研究组中Foxp3和SMARCE1表达与宫颈癌临床病理关系
Foxp3蛋白阳性表达产物主要定位于宫颈癌肿瘤细胞的胞质,间质中的淋巴细胞也可见阳性表达,Foxp3蛋白表达与宫颈癌的TNM分期相关(P<0.05),而与年龄、肿瘤分化程度和淋巴结转移均无关(P>0.05)。SMARCE1蛋白阳性表达产物也主要定位于宫颈癌肿瘤细胞的胞质,SMARCE1蛋白与宫颈癌的淋巴结转移相关(P<0.05),但与年龄、肿瘤分化程度和临床分期无关(P>0.05)。见表2。
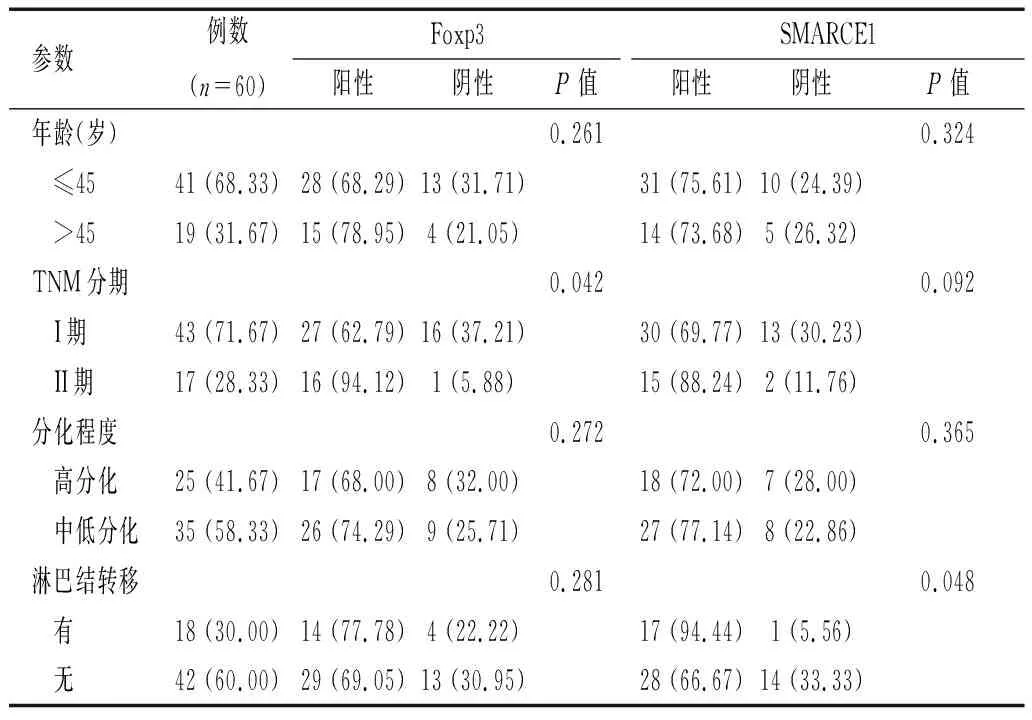
表2 研究组中Foxp3和SMARCE1表达与宫颈癌各临床病理参数之间的关系[n(%)]
2.3 研究组中Foxp3和SMARCE1在宫颈癌组织中表达相关性分析
Spearman秩相关分析显示Foxp3和SMARCE1表达呈正相关(r=0.894,P<0.05)。见表3。

表3 研究组中Foxp3和SMARCE1在宫颈癌组织中表达相关性
2.4 SMARCE1在宫颈CIN组织中的表达
免疫组化结果表明,SMARCE1在CIN1级组织中呈阴性表达,而SMARCE1在CIN3(原位癌)级组织中的染色强度和染色范围强于其在CIN2级组织中的表达,表明SMARCE1在宫颈高级别上皮内瘤变中的表达强于其在低级别上皮瘤病变,提示SMARCE1可能参与了宫颈癌的进展。见图2。

2.5 Foxp3调控宫颈癌细胞中SMARCE1表达
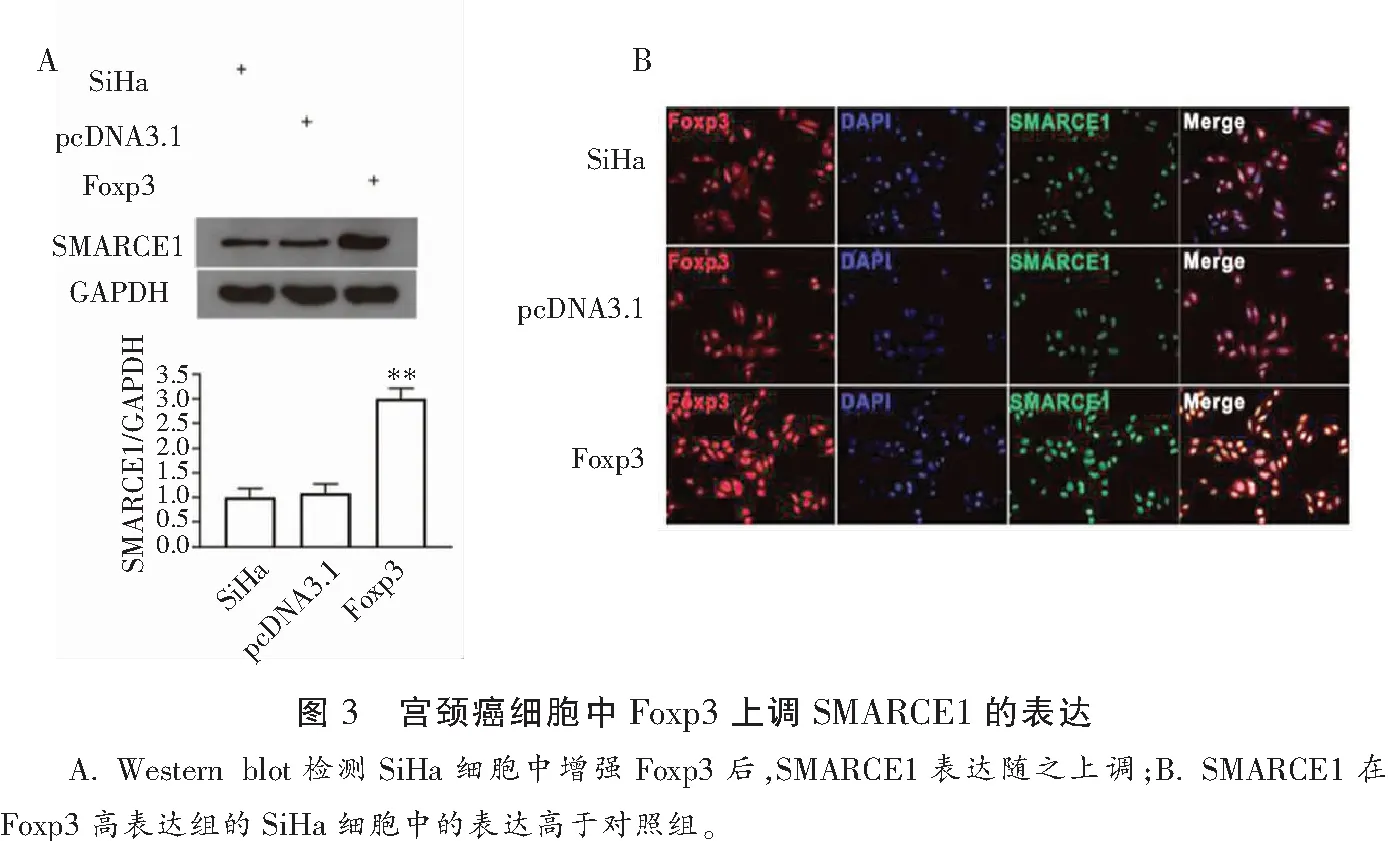
Western blot实验发现,与SiHa细胞组和转染pcDNA3.1空质粒组相比,增强宫颈癌细胞SiHa 中Foxp3表达后,SMARCE1表达随之上调。免疫荧光检测发现,与未处理组和对照组相比,上调SiHa细胞中Foxp3表达后,SMARCE1的荧光信号也随之增强。见图3。
双荧光素酶实验结果表明,与pGL-basic-SMARCE1报告基因和对照载体的共转染相比,共转染Foxp3过表达质粒和pGL-basic-SMARCE1报告基因显著提高了萤火虫对renilla荧光素酶活性的比率。本研究进一步利用JASPAR数据库预测转录因子Foxp3与SMARCE1基因相互作用的位置。SMARCE1启动子的5-13 bp和452-460 bp区域是Foxp3激活的关键区域。将Foxp3抗体沉淀的DNA进行凝胶电泳和qPCR检测,以确定转录因子Foxp3与SMARCE1启动子之间的关系。结果表明,转录因子Foxp3可直接结合到SMARCE1启动子区域,Foxp3过表达可使Foxp3更多地结合到SMARCE1启动子区域。因此,Foxp3可转录激活宫颈癌细胞中SMARCE1的表达。见图4。

3 讨论
宫颈癌是女性生殖系统最常见的恶性肿瘤,肿瘤的浸润或转移常提示预后差。晚期宫颈癌患者复发率高,化疗耐药,导致其生存率更低。因而探寻宫颈癌进展中的分子标志物,可为临床宫颈癌的免疫靶向治疗提供理论基础。
Foxp3 能抑制 CD4+T 淋巴细胞功能,阻碍 T 细胞的抗原提呈作用,降低自然杀伤性T淋巴细胞对于肿瘤细胞的杀伤作用。表达Foxp3的胃癌细胞可起到了模拟Treg细胞功能的作用,促进肿瘤免疫逃逸;Foxp3在恶性上皮性肿瘤组织中的表达显著强于其在卵巢良性、交界性上皮性肿瘤中的表达[15];SMARCE1高表达促进胃癌细胞转移,影响患者的预后[10]。目前关于Foxp3和SMARCE1在宫颈癌进展中的作用及其临床意义的研究甚少。
本研究中,研究组宫颈癌病灶组织中Foxp3和SMARCE1的表达阳性率显著高于对照组的正常宫颈组织,且临床分期较晚的患者中Foxp3和SMARCE1的表达阳性率较高,存在淋巴结转移的患者SMARCE1的表达异常高,提示了 Foxp3和SMARCE1等的异常表达均可能参与到了宫颈癌发生发展,与Sethuraman等[11]研究结果一致。进一步利用免疫组化研究发现,SMARCE1在宫颈高级别上皮内瘤变中的表达强于其在低级别上皮瘤病变中的表达,提示SMARCE1在宫颈癌的癌前病变中也起着重要的作用,很有可能在宫颈癌的癌变过程中起着关键性的促进作用。此外,本研究还发现,增强宫颈癌细胞中Foxp3表达后,SMARCE1表达也随之上调。双荧光素酶实验和免疫共沉淀实验也证实了Foxp3通过激活SMARCE1启动子区域激活SMARCE1表达。总之,本实验表明Foxp3/ SMARCE1通路在宫颈癌的癌变过程和发生发展的进程中均起着重要的作用。但是,本研究仅为单中心、小样本研究,后续仍需进行多中心、大样本研究以进一步验证相关结论。此外,本研究未阐明Foxp3和SMARCE1蛋白通过何种作用机制参与宫颈癌的发生发展过程,后续仍需开展更深入的生物学研究以进一步明确相关作用途径。
综上所述,宫颈癌中Foxp3和SMARCE1蛋白的表达成正相关,Foxp3可通过转录激活SMARCE1表达,参与宫颈癌的发生发展。
