多发性骨血管肉瘤一例
2022-04-28黄文鹏李莉明朱兵兵高剑波
黄文鹏 李莉明 王 睿 朱兵兵 高剑波
郑州大学第一附属医院放射科 (河南 郑州 450052)
1 临床资料
患者女,57岁,因“间断性头晕20余天,加重2h”至郑州大学第一附属医院神经外科就诊。患者20d前活动后出现头晕,持续数秒钟,发作时有黑懵,休息后自行缓解,2h前再次发作,较剧烈。患者既往体健,无家族遗传病史。入院后体格检查及实验室检查未见明显异常。
辅助检查:(1)头颅CT:额骨、枕骨多发骨质结构破坏,左侧枕骨局部骨质内见软组织肿块,大小约2.7cm×1.9cm,突入硬膜外,顶部局部稍受压(图1)。
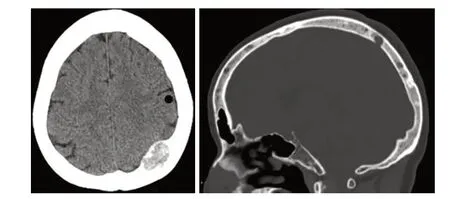
图1 多发性骨AS患者的头颅CT图像。图1A:CT横断面示左侧枕骨局部骨质内见软组织肿块突入硬膜外;图1B:骨窗矢状面示颅骨内多发骨质结构破坏。
(2)脑MRI:颅骨内见多发结节状混杂稍短T1信号,较大者位于左侧顶骨内,内见团片状混杂短或等T1信号、混杂长或等T2信号(图2A),周围见环形低信号,DWI上见扩大效应(图2B),邻近脑组织受压移位。增强扫描示颅骨内多发结节状稍高强化灶,边界较清晰,左侧顶骨内病灶呈不均匀明显强化(图2C),范围约3.6cm×2.7cm×2.9cm(上下径×左右径×前后径)。

图2 患者的脑MRI图像。图2A:T2WI横断位示混杂长信号或等信号,周围见环形低信号环;图2B:DWI上见扩大效应;图2C:增强示病灶斑片状不均匀强化。
(3)腰椎MRI:胸12、腰1~5椎体、骶1~2椎体及双侧髂骨内见斑片状长T1、混杂稍长T2信号(图3A),压脂序列上呈不均匀稍高信号,内见细网状囊腔,增强呈斑片状不均匀明显强化(图3B)。
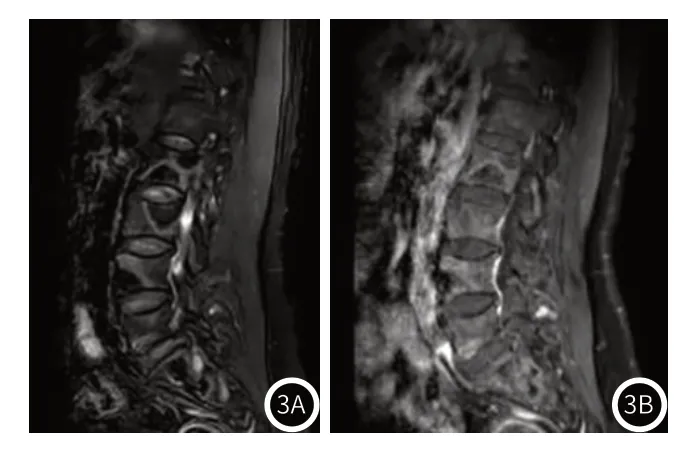
图3 患者的腰椎MRI图像。图3A:T2WI矢状位示病变呈混杂稍高信号;图3B:增强示病灶斑片状不均匀强化。
(4)PET-CT:颅面骨、胸骨、双侧锁骨、双侧肩胛骨、脊椎多个椎体及其附件、肋骨多处、骨盆骨及四肢长骨见多发骨质破坏影,部分放射性分布稍浓聚,SUVmax约7.9,部分伴软组织影形成(图4)。

图4 患者的PET-CT图像。图4A:颅骨见骨质破坏影,部分放射性分布稍浓聚,伴软组织影形成;图4B:多个椎体及其附件多发骨质破坏影,部分放射性分布稍浓聚。
患者行骨髓穿刺术,镜下HE及PAS染色示骨髓组织增生活跃,粒系增生,以中幼粒以下阶段成熟粒细胞为主,红系比例减低,淋巴细胞增多,巨核细胞不少;免疫组化检测:CD34(血管+)、MPO(粒细胞+)、CD235a(红细胞+)、CD20(灶性+)、CD3(灶性+)、CD61(巨核细胞+)、CD38(浆细胞+)、CD138(浆细胞+)。患者全麻后行经枕脑病损切除术,术中见肿瘤组织呈灰黄色,质地软韧不均,与正常脑组织有边界,肿瘤累及帽状腱膜下层,黏连紧密,左侧颅骨受肿瘤侵蚀部分缺如,枕叶皮层受压下陷。术后病理:光镜下见肿瘤细胞呈巢状、腺样排列,衬覆于血管壁,血管内皮细胞围成不规则相互吻合的血管腔,管腔大小不一,血管腔丰富,呈窦隙状结构,细胞核大、空泡状,核分裂象少见,胞浆嗜酸性(图5);

图5 患者的颅内病灶术后病理图像(HE染色×100)
免疫组化检测:CD31(+)、ERG(+)、SMA(+)、FLI-1(+)、CK(-)、EMA(-)、Des(-)、TFE-3(-)、CD68(-)、S-100(-)、K i-6 7(5%+)。经病理组织学确诊为高分化血管肉瘤(angiosarcoma,AS)。术后患者及家属要求出院,电话随访至6个月,患者死亡。
2 讨 论
骨的血管源性肿瘤比较少见,在原发性骨肿瘤中约占<1%,好发于四肢长骨[1-5]。AS起源于血管内皮细胞分化的血管内皮细胞或间叶细胞,进展快,生物学行为具有高度恶性。骨AS任何年龄段均可发生,多见于40~50岁的中年男性[6]。临床表现多为持续性非特异性疼痛,无其他特异性的症状和体征[1]。本研究中患者临床表现为间断性头晕,缺乏特异性,实验室检查亦无特殊表现,难以早期确诊,极易发生误诊误治。病因及发病机制目前尚不十分清楚,多数是自发产生的,明确的危险因素与长期的慢性淋巴水肿、放射治疗、接触电离辐射化学物质有关[7-8]。本研究中患者既往体健,无相关危险因素。目前尚无关于AS分子变化的全面研究。
骨AS组织病理特点为镜下见相互吻合、大小不一的血管腔由内皮细胞围成,内皮细胞沿窦状或海绵状腔、血管腔道生长。高分化AS呈小而实的成分,核分裂象少见,无明显异型性,血管腔丰富,呈窦隙状结构;低分化AS肿瘤细胞呈实性巢性,核仁分裂象多见,内多见坏死,血管腔数量不一。免疫组织化学检测,CD31、CD34是最敏感的标志物,在AS中有不同程度的表达[3-4,9]。
骨AS临床罕见,多为个案报道,对文献报道中影像表现进行总结,X线和CT主要表现为大小不一、边界欠清的片状溶骨性骨质破坏,位于骨皮质和(或)髓腔,骨膜反应少见,一般无硬化边,骨皮质的连续性可出现中断,多伴软组织肿块。MRI示病灶在T1WI上多为不均匀低信号,T2WI呈混杂稍高信号,DWI上呈高信号,增强可见病灶向心性非渐进性充填且不均匀强化或结节状渐进性强化[3-4]。本研究病例CT颅内病灶表现为边界清晰、无硬化边的溶骨性骨质破坏,周围无骨膜反应,可能由于肿瘤破坏迅速所致。MRI表现为骨皮质和髓腔同时受累,呈地图样、片状溶骨性骨质破坏,瘤内可见细网状囊腔,T1WI上为不均匀稍低信号,T2WI上为不均匀稍高信号,病灶信号混杂考虑与骨AS生长快,易发生坏死囊变以及出血有关,抑脂序列病灶呈稍高信号,增强后见病灶呈不均匀渐进性中度强化,强化程度和方式与肿瘤的组织病理和血管分布相关,对照影像图像与相关病理,可能因肿瘤细胞排列较紧密,间质少,呈浸润性生长,肿块内部的新生血管组成的血管腔隙不完整,因此增强扫描以明显不均匀强化为主[3]。有文献报道骨AS具有区域性受累、多中心病灶的特点[10],与肿瘤组织通过血性扩散的转移方式有关,呈区域性多中心发病。本研究病例PET-CT见全身多发骨质破坏,部分伴软组织病灶形成,与其报道相符,放射性分布稍浓聚,SUV值高于正常阈值,说明病灶具有较高葡萄糖代谢特点[4],骨髓活检亦显示AS细胞广泛浸润骨髓的正常造血组织。CT骨窗可观察骨质被肿瘤破坏的程度及范围,MRI可以提供病变形态、内部结构、生长特征以及对周围软组织的浸润情况,PET-CT可同时进行代谢及解剖成像,对于明确肿瘤的位置、有无淋巴结转移及远处转移、病灶代谢程度方面具有重要价值。
骨AS恶性程度高,容易复发和转移,目前尚无确切有效的治疗方式,其治疗方式目前主要有手术切除、手术联合化疗/放疗、单纯化疗、靶向治疗等,预后很差,5年生存率仅为10%~35%[4,11]。本例确诊时体内已出现多发病灶,从确诊到病死仅6个月。影像上需与多发性骨髓瘤相鉴别。多发性骨髓瘤常见于中老年人,以破坏性多发溶骨病变为特点,大多数出现严重骨痛、病理性骨折,病理表现为浆细胞浸润骨髓并破坏骨质,影像表现为呈穿凿样或地图样的骨质破坏灶,实验室检查可见高蛋白血症、高血钙、骨髓涂片上浆细胞增多。
综上所述,原发性骨AS临床表现不典型,影像学表现可以作为骨AS的辅助诊断,其确诊仍依赖于病理学检查。
