蔗糖循环法CO2间接矿化脱硫渣工艺研究
2022-04-27彭西周宋磊马奎岳海荣梁斌
彭西周,宋磊,马奎,岳海荣,梁斌
(四川大学 化工学院,四川 成都 610065)
如今温室效应产生了众多环境问题,CO2捕集技术是解决温室效应的重要方法,其中矿物封存技术是一种永久的固定CO2策略。一些碱性固废由于原料成本低、碳酸化速率快是一种理想的矿物封存原料[1]。目前间接矿化的工艺路线使用的浸取剂多为酸和氨,存在溶剂消耗大、回收困难等问题[2-3]。
蔗糖在碱性环境下和钙离子具有良好的络合能力[4-6]。本文研究了蔗糖循环浸取脱硫渣间接矿化CO2的工艺可行性,考察了工艺条件对脱硫渣中氢氧化钙浸取率的影响和浸取液矿化CO2的性能,并对工艺中关键的浸取剂蔗糖的循环稳定性进行了考察,同时得到了具有一定附加值的产物碳酸钙。
1 实验部分
1.1 材料与仪器
蔗糖、浓盐酸、乙醇等均为分析纯;CO2(99.5%);N2(99.999%);脱硫渣,取自西昌市蓝鼎环保脱硫渣堆场,干燥白色至淡黄色粉末,流动性较好,使用前未经处理。
FN316B型CO2红外线气体分析仪;Bruker D8 Advance型X-射线衍射仪;SU8220型场发射扫描电子显微镜;XRF-1800型X射线荧光光谱仪;STA 449F3型同步热分析仪;ZEISS Crossbeam 540型双束电镜;Bruker Avance NEO 600型核磁共振碳谱仪。
1.2 浸取实验
称取一定质量的水和蔗糖于500 mL夹套烧杯中,在室温下搅拌溶解蔗糖。快速加入20 g脱硫渣,开始浸取反应。每隔一段时间取4~5 mL浆液,立刻(5 s内)用针头过滤器过滤后,保存在样品管中,使用标准盐酸滴定分析溶液中Ca(OH)2含量,计算浸出率。
式中y——氢氧化钙浸出率,%;
ω——脱硫渣中氢氧化钙的质量分数,%;
V——消耗标准盐酸的体积,mL;
C——标准盐酸的浓度,mol/L;
ρ——糖溶液的密度,g/mL;
m糖——加入糖的质量,g;
m水——加入水的质量,g;
m渣——加入渣的质量,g。
1.3 矿化实验
取400 mL浸取液于750 mL法培烧瓶中,20 ℃采用CO2和N2混合气(12% CO2,88% N2)进行鼓泡矿化实验,流量为1 L/min。气体出口用微孔曝气器以提供良好的气体分布,用pH计检测反应时的pH值变化,同时用CO2红外线气体分析仪检测出口气体的CO2浓度。在pH=8~10时停止反应。过滤,固体干燥24 h,然后用热重检测CaCO3纯度。
1.4 循环实验
矿化反应的滤液加入一定质量蔗糖和水至500 mL,使其糖度为13.2%左右(第1次循环时蔗糖溶液的糖度),以弥补过滤和取样等造成的蔗糖损失,补加完毕后用于下一次浸取实验。
式中w——脱硫渣的矿化量,g-CO2/100 g-DFS;
f——矿化生成的CaCO3纯度,%;
mCaCO3——矿化生成的CaCO3质量,g;
m渣——反应时加入脱硫渣的质量,g。
2 结果与讨论
2.1 脱硫渣的理化性质
2.1.1 XRF分析 脱硫渣的化学组成见表1。

表1 脱硫渣中主要元素含量Table 1 The main element content of desulfurization slag
由表1可知,脱硫渣Ca、S含量很高,属于高硫高钙型脱硫渣。
2.1.2 XRD 脱硫渣XRD见图1。

图1 脱硫渣XRD谱图Fig.1 XRD patterns of desulfurization slag
由图1可知,脱硫渣中主要物相为Ca(OH)2、CaCO3、CaSO3·0.5H2O、CaSO4·2H2O和CaSO4·nH2O(n=0~0.67)。脱硫渣中的Ca(OH)2来源于未反应的脱硫剂,由脱硫剂中的氧化钙(CaO)加水消化产生,是一种具有较高反应活性的CO2矿化原料,随着脱硫渣弃置难以利用。
2.1.3 SEM 脱硫渣原料的SEM见图2。

图2 脱硫渣SEM图(a),脱硫渣切割后SEM图(b)Fig.2 SEM image of DFS(a),SEM image of DFS after cutting(b)
由图2(a)可知,脱硫渣表面有针状晶体,可能是在脱硫渣表面形成了钙矾石[Ca6Al2(SO4)3(OH)12·26(H2O)][7],在XRD图谱中没有观察到其谱峰,在SEM表征中也较少出现,说明其含量较低。对图2(a)中央的一个脱硫渣颗粒进行切割,以研究其分层结构,图2(b)为切割后的脱硫渣颗粒SEM图。
由图2(b)可知,脱硫渣分为内外两层。结合脱硫工艺可知,脱硫剂在喷淋吸收烟气中二氧化硫时,生成的硫相产物结晶沉积在未反应的脱硫剂表面,阻止其继续反应,致使内部的有效氧化钙无法得到利用。脱硫渣由两部分组成,外面为包裹的产物层,内部为未反应的脱硫剂。内部被包裹的Ca(OH)2很难和蔗糖溶液反应,若想增加脱硫渣的利用价值,可对其进行研磨处理,以破坏其包裹结构。
2.2 浸取过程工艺参数优化
2.2.1 转速对浸取率的影响 在蔗糖与氢氧化钙摩尔比为1∶1,液固比为10 mL/g,反应温度为20 ℃的条件下,考察转速对浸取率的影响,结果见图3。

图3 转速对氢氧化钙浸取率的影响Fig.3 The effect of agitation speed on the extraction rate of calcium hydroxide
由图3可知,随着转速的增加,浸取率增大,3.0 h时350 r/min和450 r/min转速下的萃取率均超过90%。转速的增加加强了脱硫渣颗粒表面的湍动,减小了传质阻力,有利于蔗糖分子在脱硫渣表面的扩散,加强了传质过程,反应变快。由于450 r/min时浆液已经充分混合,转速的增加对萃取率影响较小,且过大的转速也意味着更高的能耗,故将转速优选为450 r/min。
2.2.2 蔗糖与氢氧化钙摩尔比对浸取率的影响 在转速为450 r/min,反应温度为20 ℃,液固比为10 mL/g的条件下,考察了蔗糖与氢氧化钙摩尔比对浸取率的影响,每次实验时脱硫渣的质量为20 g,通过控制加水量来控制蔗糖溶液总体积为200 mL,实验结果见图4。
由图4可知,随着蔗糖与氢氧化钙摩尔比的提高,浸取率逐渐增大。在反应时间为3 h时,除摩尔比为1时的浸取率在90%以下,其余各组均超过了95%,可见适当过量的糖浓度的增加可以提高萃取率。在蔗糖与氢氧化钙摩尔比为1时,浸取率在各个时间点均要远低于其他组,说明蔗糖以化学计量比加入时反应进度小,而适当过量的蔗糖能大大增加浸取率。反应时间为3 h时,摩尔比在1.25以上,浸取率差别并不大。从经济性和浸取率综合考虑,糖与氢氧化钙摩尔比优选为1.25。
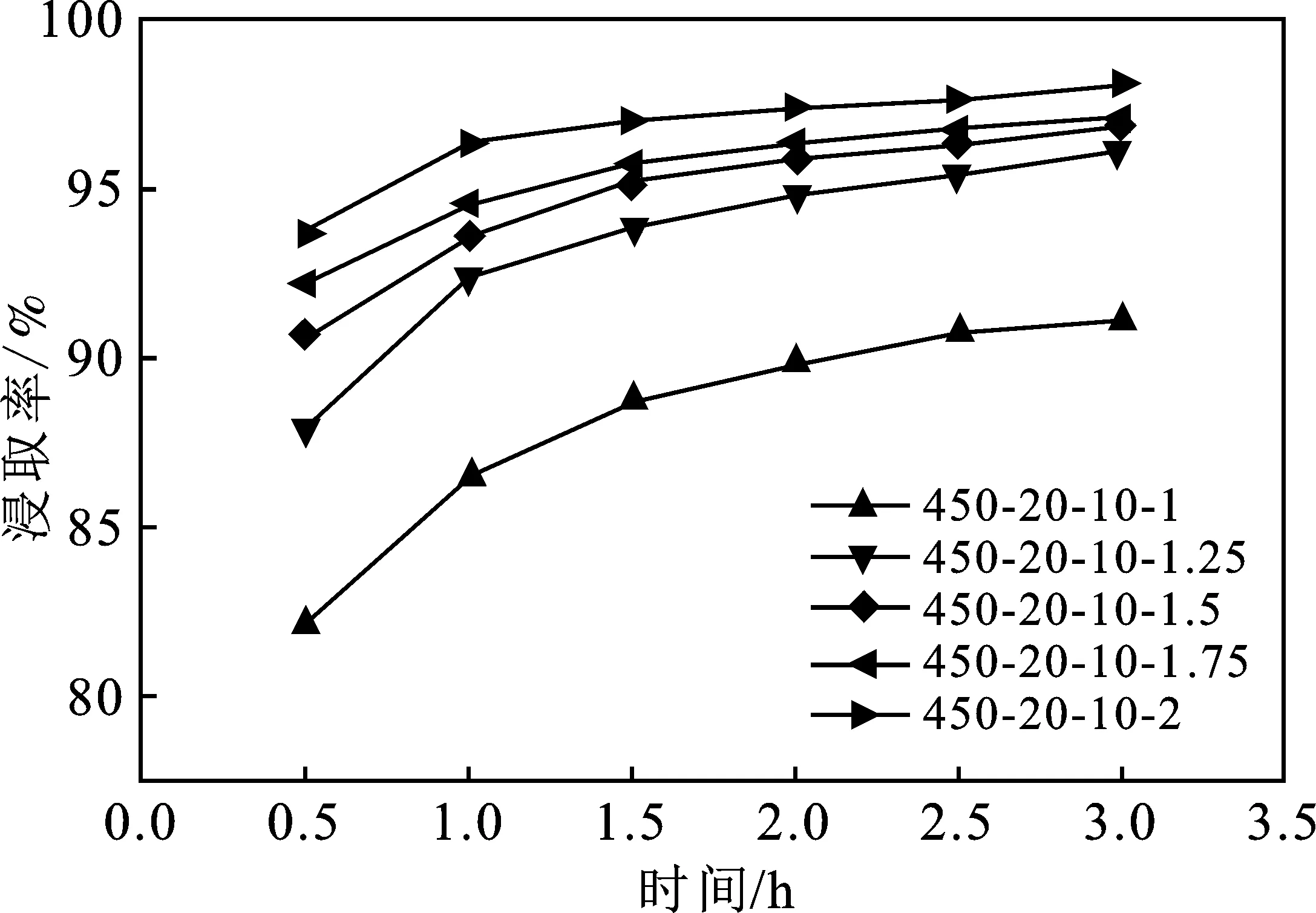
图4 蔗糖与氢氧化钙摩尔比对氢氧化钙浸取率的影响Fig.4 The effect of the molar ratio of n(C12H22O11)/n[Ca(OH)2] on the extraction rate of calcium hydroxide
2.2.3 液固比对浸取率的影响 液固比过大,浸取需水量高,不利于后续过滤等操作。液固比过小,蔗糖和氢氧化钙会形成大量的支化聚合物导致体系的黏度增加[4],不利于搅拌混合,同时也加大了后续过滤的难度。在450 r/min转速下,反应温度为20 ℃,蔗糖与氢氧化钙摩尔比为1.25的条件下,考察液固比对浸取率的影响,结果见图5。

图5 液固比对氢氧化钙浸取率的影响Fig.5 The effect of liquid-solid ratio on the extraction rate of calcium hydroxide
由图5可知,随着液固比的降低,浸取率逐渐提高,在3 h时浸取率均超过了95%。随着液固比的降低,单位浆液体积所含的氢氧化钙质量和蔗糖质量均提高,提升了反应初期的反应速率。但由于反应动力学的限制,在3 h时反应接近平衡,浸取率差别并不大,均在95%左右。液固比较高,浸取率较大,且溶剂体积小,有利于下一步减少溶液过滤所需要的时间,且较小的体积意味着工业上设备费用的降低。综上考虑,优选液固比为7 mL/g。
2.2.4 温度对浸取率的影响 在转速为450 r/min,液固比为7 mL/g,蔗糖与氢氧化钙摩尔比为1.25的条件下,考察温度对浸出率的影响,实验结果见图6。

图6 温度对氢氧化钙浸取率的影响Fig.6 The effect of temperature on the extraction rate of calcium hydroxide
由图6可知,在10~30 ℃时温度对浸取率的影响并不大;在30~50 ℃时,温度升高,浸取率大幅度下降。温度对浸出率的影响可能是由于以下两方面的原因:一方面,温度升高,氢氧化钙的溶解度减小,从而溶液pH值下降,蔗糖分子解离度变小,脱质子的蔗糖分子变少,蔗糖和氢氧化钙的反应性变低,浸取率变低;另一方面,温度升高,蔗糖分子和钙离子的络合稳定性变弱,致使反应平衡左移,浸取率变低,故30~50 ℃时浸取率逐渐变低。10~30 ℃时浸取率差别并不大,可能是由于在此温度区间内,虽然温度对氢氧化钙的溶解和蔗糖的络合能力均不利,但温度的升高,加快了反应速率,温度升高对反应的两方面正负作用,在宏观上表现为浸取率差别不大。
2.3 鼓泡矿化过程研究
2.3.1 温度对CO2矿化速率的影响 溶液温度对CO2矿化速率的影响见图7。
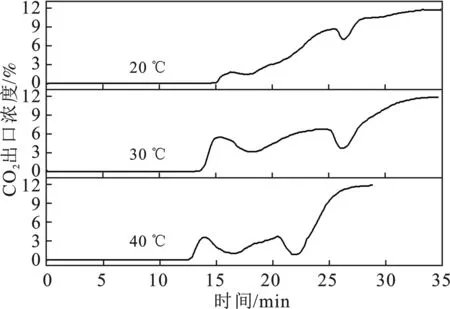
图7 温度对CO2矿化速率的影响Fig.7 The effect of temperature on the rate of CO2 mineralization
由图7可知,蔗糖钙溶液吸收CO2分为两个阶段:前一阶段,吸收率较好,CO2出口浓度较低;后一阶段,吸收率下降,且出现反复的现象。前一阶段,由于蔗糖钙溶液矿化时生成的碳酸钙和蔗糖分子中的氧原子上面的孤对电子静电作用而溶解在溶液中[7],并没有结晶成核,表现为溶液澄清,出口没有检测到CO2,说明此时CO2吸收效果好,矿化速率快;而在后一阶段,随着矿化的进行,溶液中的碳酸钙变多,超过了蔗糖的络合能力,此时碳酸钙大量从溶液中释放出来,碳酸钙大量结晶成核,溶液变为乳白色浑浊,且黏稠。可知随着矿化温度的提高,总的矿化时间减少,温度升高有利于缩短矿化时间。
2.3.2 间接矿化速率和直接矿化速率对比 对脱硫渣浸取液和氢氧化钙水溶液的矿化速率进行了对比,氢氧化钙的浓度与蔗糖钙的浓度一致,结果见图8。

图8 蔗糖钙溶液和氢氧化钙水溶液矿化速率对比Fig.8 Comparison of the mineralization rate of calcium saccharate solution and calcium hydroxide aqueous solution
由图8可知,氢氧化钙矿化时,溶液的pH值有一段平稳期,在此期间,CO2吸收速率稳定,最后由于溶液中氢氧化钙反应不断减少,导致pH快速下降,在pH=6.7左右反应完毕。而蔗糖钙溶液矿化时,pH先经历一个缓慢下降,再经历一个快速下降,最后溶液pH稳定在6.7。反应时间上,蔗糖钙溶液矿化完毕需要21 min,而氢氧化钙需要35 min,说明通过浸取,提高了溶液中氢氧化钙浓度,液相的传质阻力降低,传质速率加快,吸收速率更好,可知间接矿化可以提高矿化反应速率,在工业上意味着更小的设备体积和更短的操作时间,有利于减少操作费用。
2.3.3 矿化产物碳酸钙表征分析 碳酸钙的SEM、TG曲线、XRD见图9。

图9 碳酸钙样品的SEM图(a),TG曲线(b),XRD图(c)Fig.9 SEM images of CaCO3 samples(a),XRD pattern(b),TG curve(c)
由图9(a)可知,碳酸钙多为短棒型,并伴有一定数量的规则小颗粒,粒径约在0.1~1 μm,为亚微米级碳酸钙。由于碳酸钙生成过程中矿化速度并不均一,导致碳酸钙成核后生长速度在溶液各处有较大差异,因此生成的碳酸钙大小不一。由图9(b)可知,碳酸钙在600~810 ℃有明显的失重峰,归因于碳酸钙在高温下分解产生CO2所致。计算可知,碳酸钙的纯度为98%,由于矿化时的碳源为CO2,并未引入其他杂质离子,且脱硫渣浸取液中的杂质离子很容易水洗去除,因此得到的碳酸钙纯度较高,具有良好的工业应用前景。由图9(c)可知,碳酸钙为方解石晶型,产物纯度高,结晶度好。
2.4 蔗糖循环性探究
2.4.1 蔗糖溶液短期循环性 最优浸取条件下得到的脱硫渣浸取液的循环实验结果见表2。

表2 循环次数对浸取率和矿化量的影响Table 2 The influence of the number of cycles on the extraction rate and the amount of mineralization
由表2可知,5次循环中,浸取率均在93%以上和矿化量在9.2 g-CO2/100 g-DFS以上,说明蔗糖溶液在5次循环中均保持大致相同的性能。从每次循环结果来看,浸取率和矿化量有相同的变化趋势,浸取率较高的情况下矿化量也越高,说明矿化量取决于浸取过程所能浸出的钙离子量。蔗糖分子在碱性环境下会解离,但在弱碱性环境下又会重新生成蔗糖,从而在保持蔗糖的性质不变。
2.4.2 蔗糖溶液长期稳定性 蔗糖为非还原性糖,在酸性环境下会大量水解。在矿化结束后,溶液会处于接近酸性的状态,有可能会促进蔗糖的转化。在脱硫渣存在条件下,蔗糖在强碱性溶液环境中是否稳定也尚不清楚。为了探究脱硫渣浸取过程中蔗糖的长期稳定性,采用核磁共振碳谱研究了以下3个样品中的有机物种类:①新制蔗糖溶液;②蔗糖溶液密封放置6个月;③蔗糖溶液浸取脱硫渣并解析后密封放置6个月。通过溶液中有机物的种类来判断蔗糖有没有变质及可能的原因。实验结果见图10。
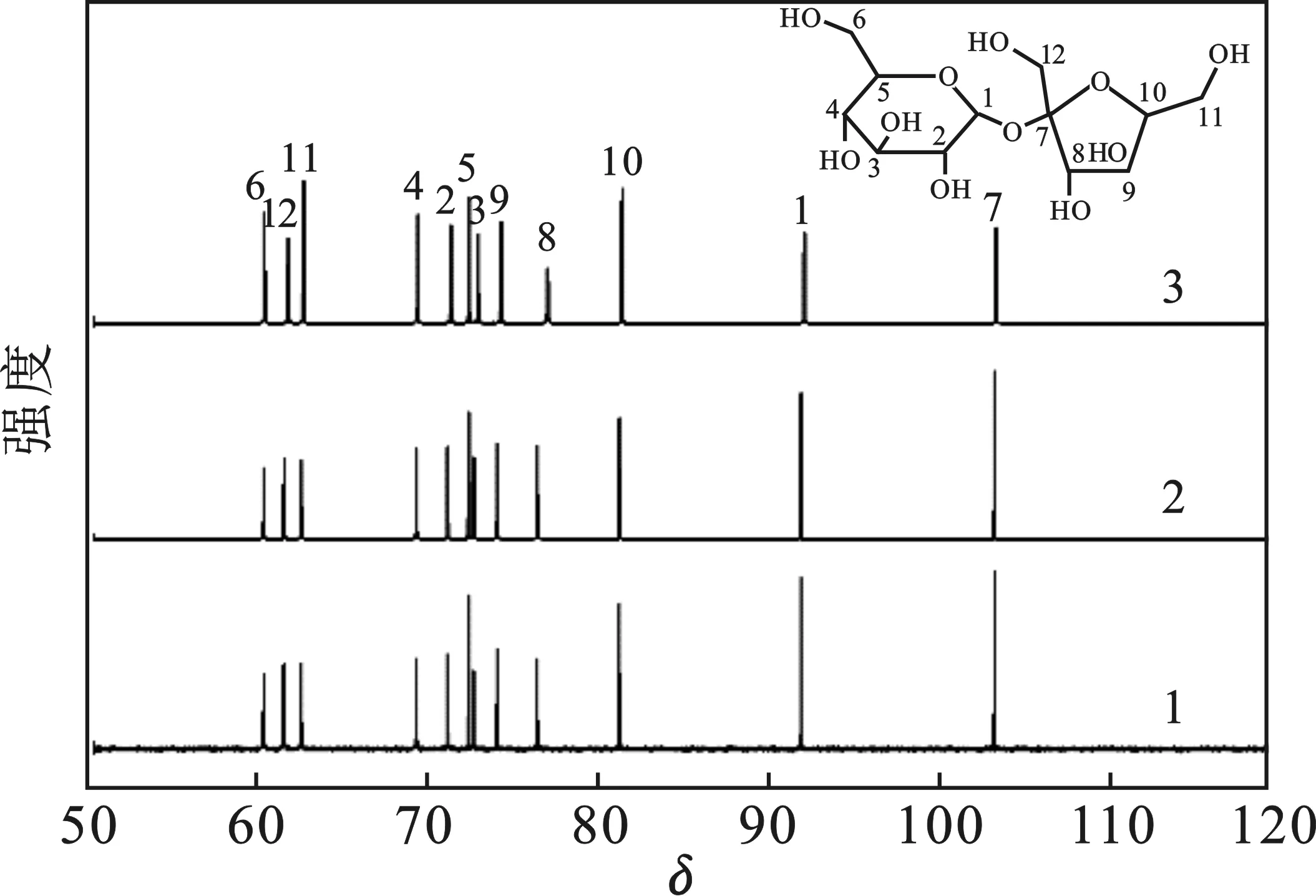
图10 不同条件下蔗糖溶液的13C NMRFig.10 13C NMR of sucrose solutionunder different conditions
由图10可知,不管是新制的蔗糖还是放置一定时间的蔗糖溶液的碳谱均一样,说明纯水环境中的蔗糖性质稳定;脱硫渣浸取过后解析出来的蔗糖碳化学环境也没有改变,表明脱硫渣中的复杂离子环境对蔗糖转换没有促进作用,蔗糖在碱性环境中解离,弱碱环境中解析后也没有变质。可以认为,蔗糖在整个循环过程中保持了良好的化学稳定性。
3 结论
蔗糖浸取脱硫渣在转速为450 r/min,液固比为7 mL/g,蔗糖与氢氧化钙摩尔比为1.25,室温下反应3 h的最佳工艺下,脱硫渣中Ca(OH)2浸取率可以达到95%。浸取完成后进行固液分离,固体为脱硫渣中的杂质组分CaCO3、CaSO3、CaSO4等,液体为富集后的含钙溶液。浸取液在高效矿化CO2的同时实现了蔗糖的再生,通过循环实验和稳定性测试说明,蔗糖在整个工艺中并未转化,是一种可循环的浸取剂。采用蔗糖循环法CO2间接矿化脱硫渣工艺,可以达到95 kg-CO2/t-DFS的碳减排,同时产生的碳酸钙有一定的工业价值。
