响应面法优化红薯叶多酚超声辅助提取工艺及其抗氧化活性研究
2022-04-27侯敏娜侯少平王泽坤赖普辉
侯敏娜,侯少平,王泽坤,赖普辉
(陕西国际商贸学院,陕西 咸阳 712046)
红薯(IpomoeabatatasLam.)又称甘薯、番薯、红苕、地瓜等,属于旋花科番薯属草本植物,在我国各地都有种植[1-2]。研究表明,红薯叶中含有黄酮类、多酚类及类胡萝卜素等多种成分,具有降低胆固醇、防止血管脂质沉积、防止动脉硬化、降血糖、抗氧化、抗肿瘤、促进新陈代谢等药理作用,是一种优质的天然食品[3-6]。我国是世界上红薯种植面积最大的国家,红薯叶资源十分丰富,除少量红薯叶作为蔬菜食用外,大多被丢弃或用作家畜饲料,造成巨大的资源浪费。因此,加强对红薯叶资源的开发利用,具有重要的经济效益和社会效益。作者采用超声辅助法提取红薯叶多酚,以红薯叶多酚提取率为评价指标,以提取温度、乙醇体积分数、料液比、提取时间为考察因素,在单因素实验的基础上,采用响应面法[7-8]优化红薯叶多酚的超声辅助提取工艺,并通过测定红薯叶多酚对DPPH自由基、ABTS 自由基的清除能力,评价其抗氧化活性。
1 实验
1.1 材料、试剂与仪器
红薯叶,2020年9月采摘于陕西省咸阳市乾县,品种为济薯25号,经陕西国际商贸学院中药学教研室雷国莲教授鉴定为旋花科番薯属植物红薯(IpomoeabatatasLam.)的干燥叶。
没食子酸标准品(批号110831-201906),中国食品药品检定研究院;DPPH(批号S18M11M109858)、ABTS(批号C10947528),上海麦克林生物科技有限公司;福林酚,上海荔达生物科技有限公司;乙醇,成都科隆化学有限公司;无水碳酸钠,天津天力化学试剂有限公司;实验所用试剂均为分析纯。
TU-1810 型紫外可见分光光度计,北京普析通用仪器有限责任公司;CP225D型电子分析天平,赛多利斯;KQ5200DE型数控超声波提取仪,昆山超声仪器有限公司;FW100型高速万能粉碎机,北京科伟永兴仪器有限公司;HG-9075L型立式鼓风干燥箱,北京亚太科隆技术有限公司。
1.2 红薯叶多酚的提取
将晒干的红薯叶除去茎和叶柄后于粉碎机中粉碎,置于干燥阴凉处保存[7]。称取红薯叶粉末1.0 g,置于100 mL锥形瓶中,按一定料液比加入一定体积分数的乙醇,超声一定时间,过滤,收集滤液,即为红薯叶多酚提取液。
1.3 红薯叶多酚提取率的测定
1.3.1 没食子酸标准曲线的绘制[8-11]
准确称取5 mg干燥的没食子酸标准品,用纯化水制成浓度为0.1 mg·mL-1的没食子酸标准溶液。分别移取没食子酸标准溶液0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于10 mL容量瓶中,加入1 mL福林酚溶液和2 mL碳酸钠溶液,用纯化水定容至刻度,避光反应1 h,以纯化水为空白,测定765 nm处吸光度。以没食子酸浓度为横坐标、吸光度为纵坐标绘制标准曲线(图1),拟合得线性回归方程为:y=0.836x+0.0624,R2=0.9967。
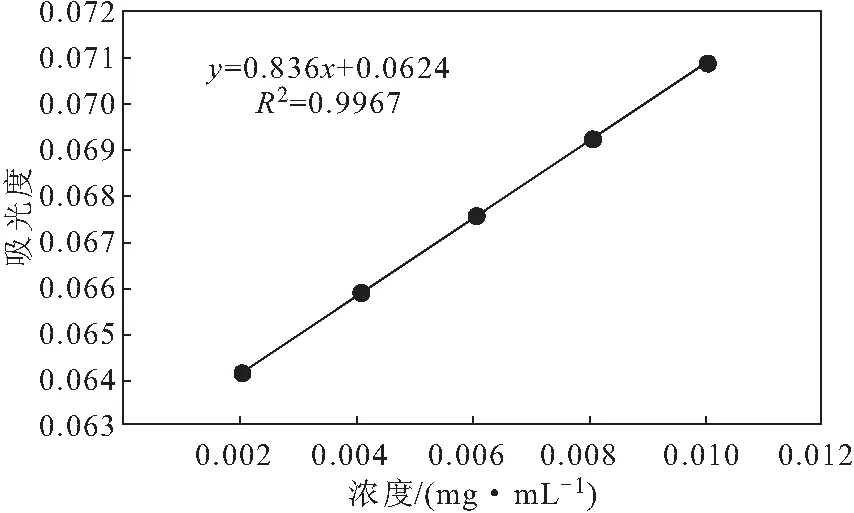
图1 没食子酸标准曲线
1.3.2 多酚提取率的测定
移取1 mL红薯叶多酚提取液,置于10 mL容量瓶中,用乙醇定容至刻度,按1.3.1测定吸光度,按式(1)计算多酚提取率:
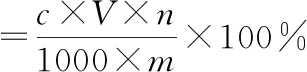
(1)
式中:c为经标准曲线方程计算得到的多酚浓度,mg·mL-1;V为提取液体积,mL;n为稀释倍数;m为红薯叶粉末质量,g。
1.4 提取工艺优化
采用单因素实验,考察乙醇体积分数(50%、60%、70%、80%、90%)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30,g∶mL,下同)、提取温度(40 ℃、50 ℃、60 ℃、70 ℃、80 ℃)、提取时间(30 min、35 min、40 min、45 min、50 min)对红薯叶多酚提取率的影响。
在单因素实验的基础上,以红薯叶多酚提取率为评价指标,以提取温度、乙醇体积分数、料液比、提取时间为自变量,利用 Design-Expert 8.0.6软件进行4因素3水平响应面实验设计,以进一步优化红薯叶多酚的超声辅助提取工艺。
1.5 抗氧化活性评价[9-12]
1.5.1 红薯叶多酚对DPPH自由基清除率的测定
分别配制浓度为4 mg·mL-1、8 mg·mL-1、12 mg·mL-1、16 mg·mL-1、20 mg·mL-1的红薯叶多酚溶液和VC对照溶液。准确移取各浓度待测溶液2 mL,加入DPPH自由基溶液2 mL,摇匀,暗处反应1 h,测定517 nm处吸光度,按式(2)计算DPPH自由基清除率:
(2)
式中:A0为2 mL DPPH自由基溶液+2 mL 72%乙醇的吸光度;A1为2 mL DPPH自由基溶液+2 mL待测溶液的吸光度;A2为2 mL 72%乙醇+2 mL待测溶液的吸光度。
1.5.2 红薯叶多酚对ABTS自由基清除率的测定
参照文献[10,12]方法测定734 nm处吸光度,按式(3)计算ABTS自由基清除率:
(3)
式中:A0为2 mL ABTS自由基溶液+2 mL 72%乙醇的吸光度;A1为2 mL ABTS自由基溶液+2 mL待测溶液的吸光度;A2为2 mL 72%乙醇+2 mL待测溶液的吸光度。
2 结果与讨论
2.1 单因素实验结果
2.1.1 乙醇体积分数的选择
在料液比为1∶25、提取时间为30 min、提取温度为60 ℃的条件下,考察乙醇体积分数对红薯叶多酚提取率的影响,结果见图2。
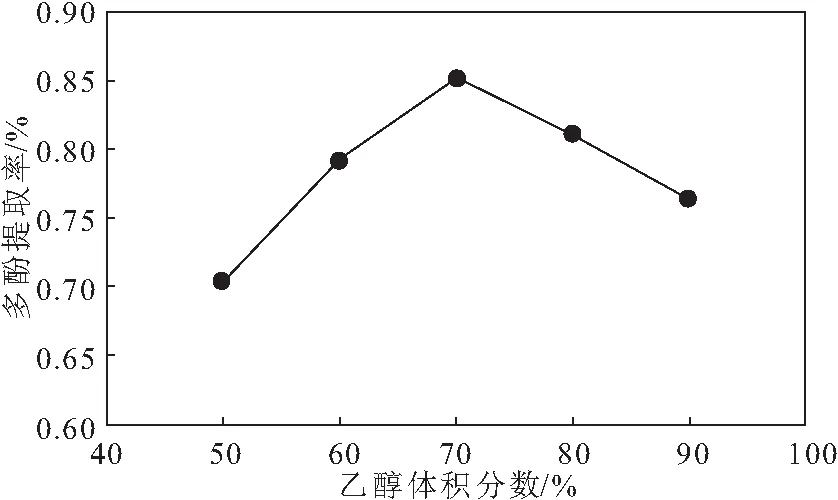
图2 乙醇体积分数对红薯叶多酚提取率的影响
由图2可知,随着乙醇体积分数的增大,红薯叶多酚提取率先升高后降低,当乙醇体积分数为70%时,多酚提取率达到最高。这是因为,乙醇体积分数过小时,溶剂极性较大,而多酚不易溶于强极性溶剂,导致多酚提取率较低;乙醇体积分数过大时,溶剂极性变小,多酚也不易溶于弱极性溶剂,且会引入较多弱极性杂质,导致多酚提取率下降。故选择乙醇体积分数70%作为响应面实验的中心点。
2.1.2 料液比的选择
在乙醇体积分数为70%、提取时间为30 min、提取温度为60 ℃的条件下,考察料液比对红薯叶多酚提取率的影响,结果见图3。
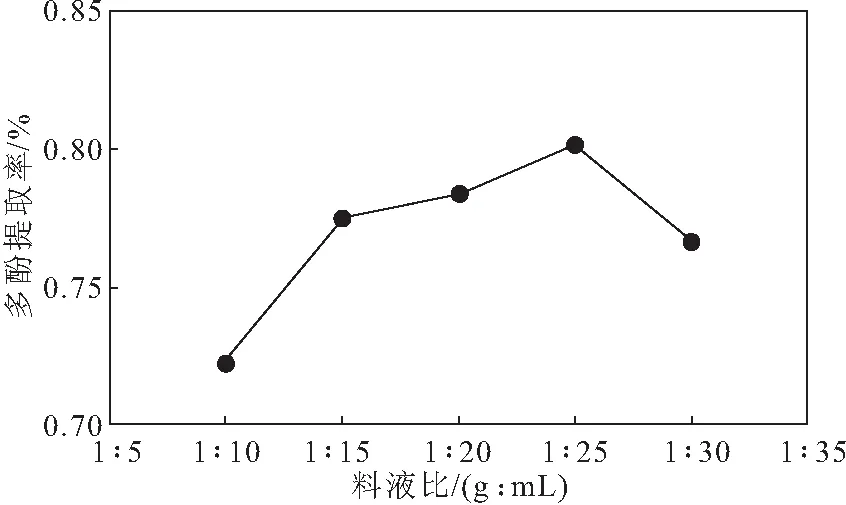
图3 料液比对红薯叶多酚提取率的影响
由图3可知,随着料液比的减小,即溶剂用量的增加,红薯叶多酚提取率先逐渐升高而后降低,当料液比为1∶25时,多酚提取率达到最高。这是因为,当料液比为1∶25时, 大部分目标成分已从红薯叶中溶出,达到动态平衡即饱和状态,再增加溶剂用量,反而会引入更多的杂质,使得后续过滤、纯化工序不但难度加大,还会将目标成分包裹在内而除掉, 导致多酚提取率降低。故选择料液比1∶25作为响应面实验的中心点。
2.1.3 提取温度的选择
在料液比为1∶25、乙醇体积分数为70%、提取时间为30 min的条件下,考察提取温度对红薯叶多酚提取率的影响,结果见图4。
由图4可知,随着提取温度的升高,红薯叶多酚提取率先升高后降低,当提取温度为60 ℃时,多酚提取率达到最高。可能是由于,提取温度过低时提取程度不够;但是提取温度过高时,会导致红薯叶多酚分解,多酚提取率降低。故选择提取温度60 ℃作为响应面实验的中心点。
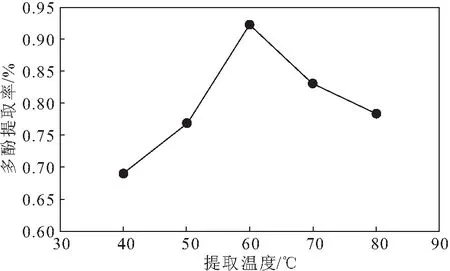
图4 提取温度对红薯叶多酚提取率的影响
2.1.4 提取时间的选择
在料液比为1∶25、乙醇体积分数为70%、提取温度为60 ℃的条件下,考察提取时间对红薯叶多酚提取率的影响,结果见图 5。
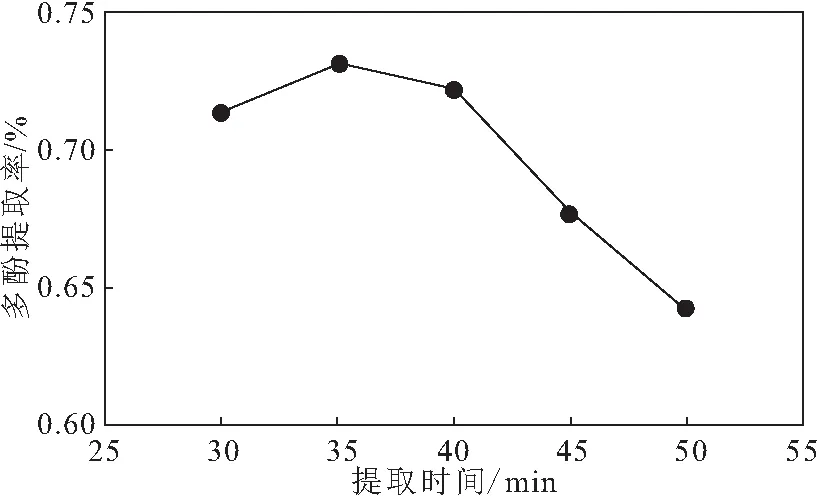
图5 提取时间对红薯叶多酚提取率的影响
由图 5可知,随着提取时间的延长,红薯叶多酚提取率先缓慢升高而后急剧降低,当提取时间为35 min时,多酚提取率达到最高。故选择提取时间35 min作为响应面实验的中心点。
2.2 响应面实验结果
2.2.1 响应面实验设计及结果(表1)
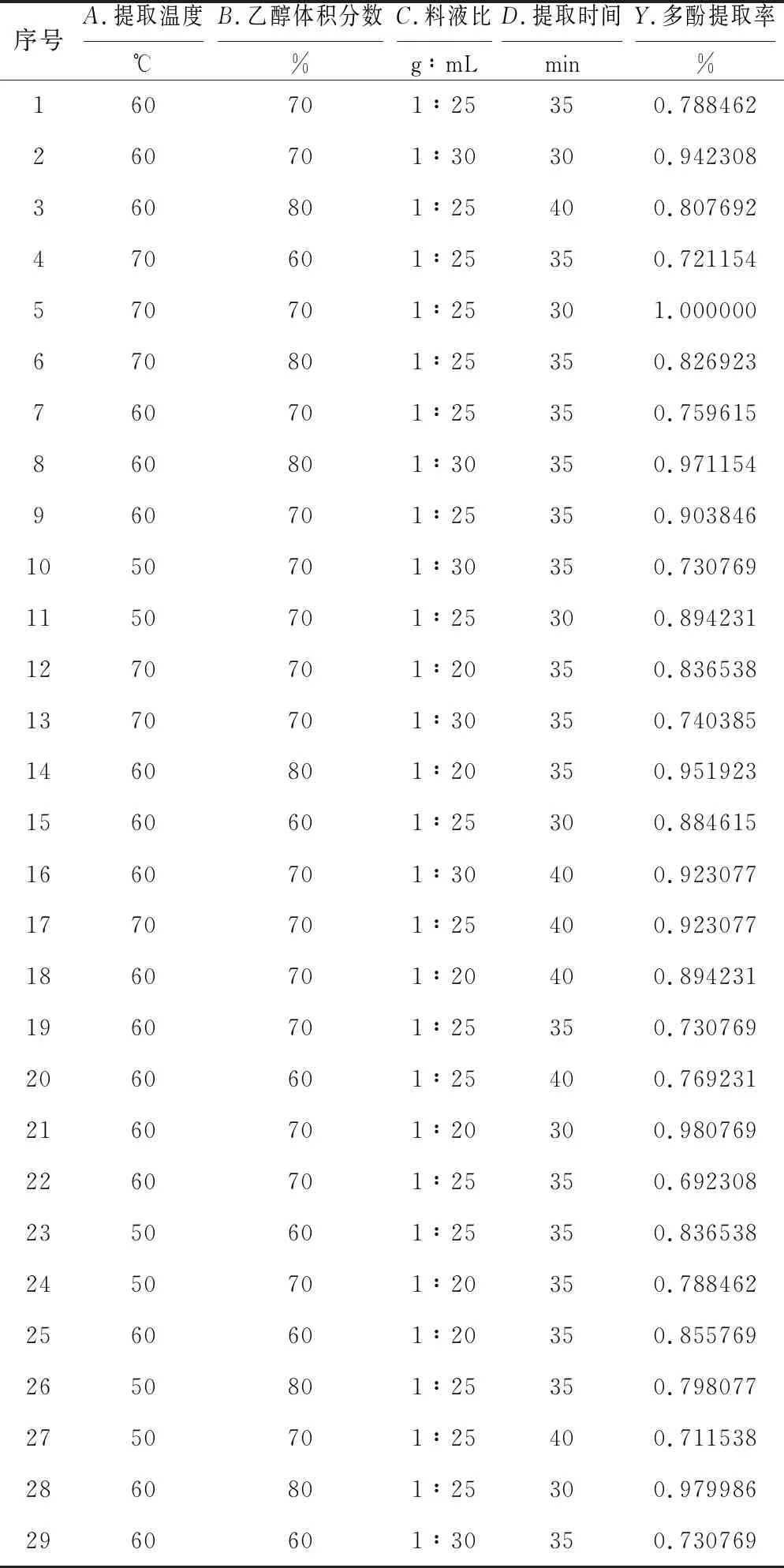
表1 响应面实验设计及结果
2.2.2 回归模型的建立与方差分析
采用 Design-Expert 8.0.6 软件对实验结果进行分析,得到多元回归方程:Y=0.90-(5.500E-003)A+0.012B-0.018C-(8.750E-003)D+0.025AB-(5.500E-003)AC+(4.250E-003)AD+0.014BC-0.021BD+0.034CD-0.012A2-0.028B2-0.018C2-0.055D2。
回归模型的方差分析见表 2。
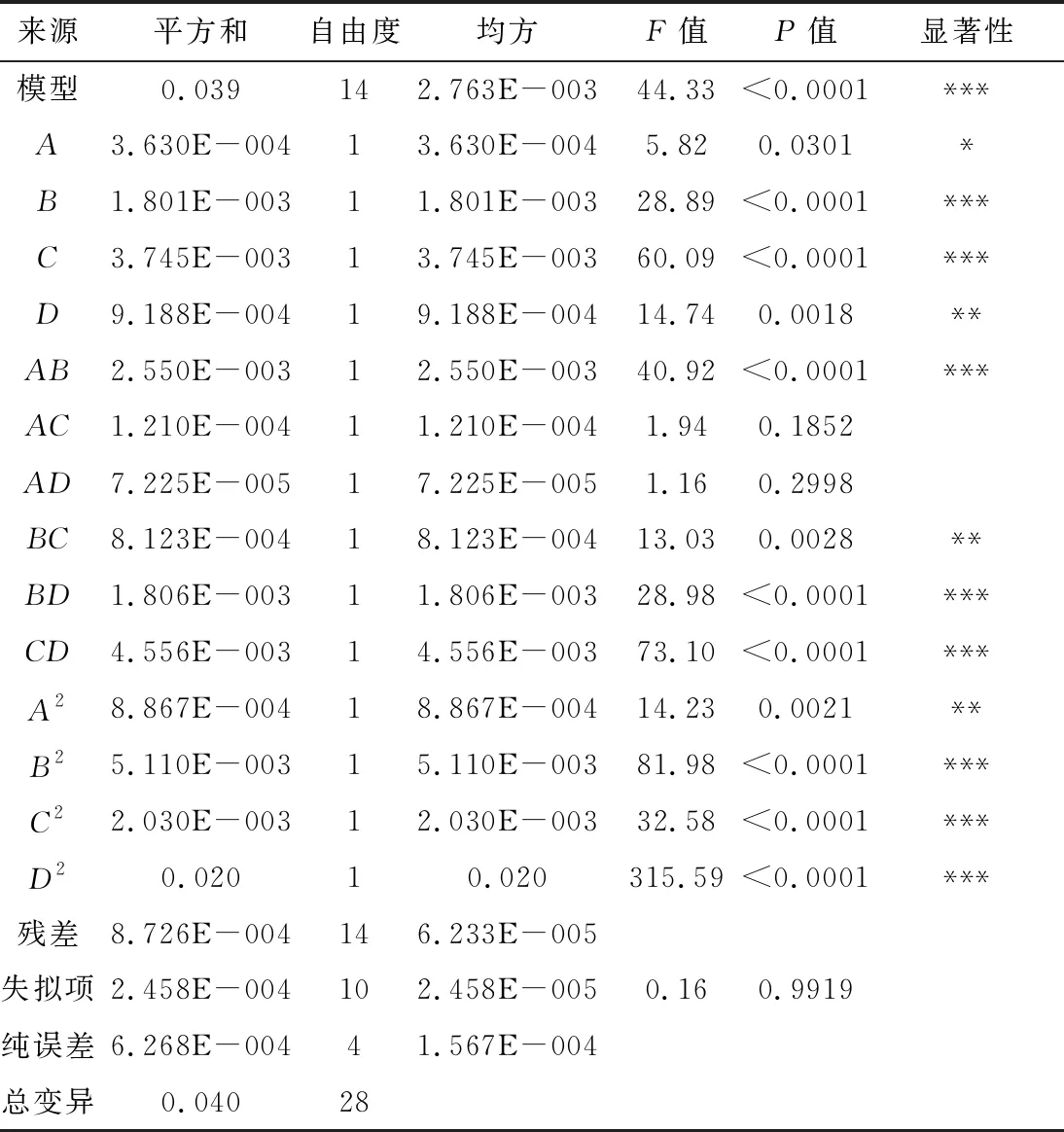
表2 方差分析
其中,一次项A、B、C、D对红薯叶多酚提取率的影响显著;交互项AB、BC、BD、CD,二次项A2、B2、C2、D2对红薯叶多酚提取率的影响极显著。从F值可知, 4个因素对红薯叶多酚提取率的影响大小依次为:C(料液比)>B(乙醇体积分数)>D(提取时间)>A(提取温度)。
2.2.3 响应面分析
各因素交互作用对红薯叶多酚提取率影响的响应面图如图6所示。
由图 6可知:乙醇体积分数的曲线平缓(图6a),变化幅度不大,说明乙醇体积分数对多酚提取率的影响较弱,当升高提取温度时,多酚提取率降低,影响较为明显;提取温度与料液比的曲线比较平缓(图6b),没有明显的升高或者降低,并且三维图接近于圆形,故对多酚提取率的影响不显著;提取时间的坡面较陡(图6c),说明提取时间对多酚提取率的影响大于提取温度,与方差分析结果一致;乙醇体积分数与提取时间均对多酚提取率的影响很大(图6e),这与方差分析中BD交互高度显著性相吻合;随着料液比的减小及提取时间的延长,多酚提取率均呈下降趋势,且幅度很大,提取时间的曲线不平滑(图6f),说明对多酚提取率的影响显著。
综上,红薯叶多酚提取工艺各参数的适宜范围为:提取温度 58~62 ℃、乙醇体积分数 70%~74%、料液比1∶(20~22)、提取时间 30~35 min。经软件分析得到红薯叶多酚的最佳提取工艺为:提取温度60.97 ℃、乙醇体积分数71.98%、料液比1∶21.17、提取时间33.25 min,在此条件下,红薯叶多酚提取率可达0.91006%。
2.3 工艺验证
考虑实际操作性,将红薯叶多酚的提取工艺调整为:提取温度61 ℃、乙醇体积分数72%、料液比1∶21(g∶mL)、提取时间33 min。在此条件下进行3次平行验证实验,红薯叶多酚提取率分别为:0.9081%、0.9072%、0.9048%,平均值为0.9066%,与理论值0.91006%很接近。说明响应面法优化得到的提取工艺可行。
2.4 抗氧化活性
红薯叶多酚对DPPH自由基、ABTS自由基的清除能力见图7。
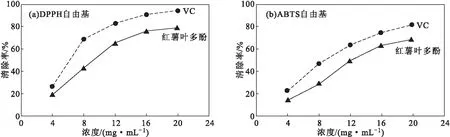
图7 红薯叶多酚对 DPPH 自由基(a)、ABTS自由基(b)的清除能力
由图 7可知,随着红薯叶多酚和VC浓度的增大,两者对 DPPH自由基、ABTS自由基的清除率均呈上升趋势,且VC的清除率始终大于红薯叶多酚的。当红薯叶多酚和VC的浓度为 20 mg·mL-1时,两者对DPPH自由基的清除率分别为78%、93%,对ABTS自由基的清除率分别为69%、82%。说明红薯叶多酚对DPPH自由基和ABTS自由基有较强的清除能力,但均弱于VC。
3 结论
以红薯叶多酚提取率为评价指标,以提取温度、乙醇体积分数、料液比、提取时间为考察因素,在单因素实验的基础上,采用响应面法优化红薯叶多酚的超声辅助提取工艺,并通过测定红薯叶多酚对DPPH 自由基及ABTS自由基的清除能力,评价其抗氧化活性。确定红薯叶多酚的最佳提取工艺为:提取温度61 ℃、乙醇体积分数72%、料液比1∶21(g∶mL)、提取时间33 min,在此条件下,红薯叶多酚提取率为0.9066%,与理论值0.91006%接近。红薯叶多酚具有一定的抗氧化活性,但在实验浓度范围内,其对DPPH自由基及ABTS自由基的清除率均低于VC。本研究为红薯叶资源的进一步开发利用提供了依据。
