过表达miR-411对宫颈癌细胞增殖、侵袭和凋亡的影响
2022-04-26唐亮阴敏张海肖燕马莹莹
唐亮 阴敏 张海 肖燕 马莹莹
宫颈癌是女性生殖系统发病率较高的恶性肿瘤,严重威胁女性生命健康,尽管随着手术、放化疗及靶向治疗等综合治疗的进步,宫颈癌诊疗有所改善,但对于晚期宫颈癌预后仍然很差[1]。宫颈癌发病机制复杂,涉及抑癌基因失活、癌基因激活等,因此,寻找影响宫颈癌发生发展机制有重要意义。越来越多研究表明,微小RNA(microRNA,miRNA)与宫颈癌发生发展密切相关[2]。miRNA是一类内源基因编码的非编码RNA,长度约18-25nt,不翻译蛋白,可通过与靶基因mRNA的3’UTR结合,抑制靶基因翻译,从而在转录及转录后水平影响多种细胞功能[3]。在肿瘤中,miRNA可发挥癌基因或抑癌基因样作用,与肿瘤发生发展及转移等密切相关[4]。miR-411定位于染色体14q32,目前在肺癌、肾癌等肿瘤中有研究[5,6],miR-411在宫颈癌中研究较少。有研究显示,miR-411可通过靶向STAT3抑制宫颈癌细胞增殖和侵袭能力[7],但miR-411对宫颈癌细胞凋亡及机制研究尚未明确。因此,本研究旨在miR-411对宫颈癌细胞增殖、侵袭和凋亡的影响,并进一步研究其作用机制。
1 材料与方法
1.1 试剂与仪器 DMEM培养基、胰酶、胎牛血清、Opti-MEM培养基均购自美国Gibco;Trizol、LipofectamineTM2000试剂盒购自美国Invitrogen;miR-411 mimics及miR-NC、miR-411 inhibitor及anti-miR-NC、PIK3R3 siRNA及阴性对照siRNA、PIK3R3过表达载体及空载体均购自苏州吉玛生物制剂有限公司;MTT及DMSO均购自美国Sigma;Transwell小室、Matrigel胶、流式细胞仪均购自美国BD;Annexin V-FITC/PI双染法细胞凋亡试剂盒购自南京凯基生物;双荧光素酶报告基因检测试剂盒购自美国Promega公司;BCA蛋白浓度测定试剂盒、ECL化学发光检测试剂盒均购自中国碧云天;PIK3R3、PI3K、p-AKT、PCNA、 E-cadherin和cleaved caspase3均购自美国Abcam;酶标仪、RT-PCR仪均购自美国Thermo公司。
1.2 细胞及培养 宫颈癌Caski、SiHa和C-33A细胞及正常宫颈上皮永生化细胞End1/E6E7均购自美国ATCC。所有细胞使用含10% FBS的DMEM完全培养基培养,培养条件为5%体积分数CO2、37℃培养箱。观察到细胞覆盖瓶底80%~90%面积时,胰酶消化、传代。传代后每2天换液1次。选择对数生长期细胞用于实验。
1.3 细胞转染 收集、计数对数生长期的SiHa细胞,以2×105个/孔接种于6孔板,放置于5%体积分数CO2、37℃培养箱培养。当细胞达70%~80%融合度时可进行转染。参照LipofectamineTM2000转染说明,使用Opti-MEM培养基分别稀释Lipo 2000、miR-411 mimics及miR-NC、miR-411 inhibitor及anti-miR-NC、PIK3R3 siRNA(si-PIK3R3)及阴性对照siRNA(si-NC)、PIK3R3过表达载体(pcDNA-PIK3R3)及空载体(pcDNA)请提供相关图片与数据。将稀释后的各组细胞与Lipo 2000充分混匀,室温条件下放置5 min,加入至6孔板相应孔内,放置于培养箱进行转染反应,6 h 后,更换为完全培养基继续培养。
1.4 qRT-PCR检测miR-411和PIK3R3表达 收集转染miR-411 mimics及PIK3R3 siRNA 48 h的SiHa细胞。Trizol法提取细胞总RNA,NanoDrop检测RNA样品浓度,选择符合要求的RNA逆转录为cDNA,加入SYBR green染色,设置5个复孔,按照荧光定量试剂盒说明进行PCR扩增。引物由上海生工合成,miR-411基因上下游引物分别为:5’-GGGGTAGTAGACCGTATAG-3’,5’-TGCGTGTCGTGGAGTC-3’;U6基因上下游引物分别为:5’-CTCGCTTCGGCAGCACA-3’,5’-TGGTGTCGTGGAGTCG-3’ ;PIK3R3基因上下游引物分别为:5’-CTTGCTCTGTGGTGGCCGAT-3’,5’-GACGTTGAGGGA GTCGTTGT-3’;GAPDH基因上下游引物分别为:5’-GAAGGTGAAGGTCGGAGTC-3’,5’-GAAGATGGTGATGGGATTTC-3’。通过2-△△Ct法计算miR-411和PIK3R3 mRNA表达水平。实验重复3次。
1.5 MTT检测细胞增殖 以5 000个/孔接种对数生长期的SiHa细胞于96孔板,常规培养24 h,待细胞贴壁,按照1.3方法进行转染,每组设置5个复孔。转染48 h,收集细胞,每孔加20 μl MTT溶液(5 mg/ml),继续培养4 h。弃掉上清,以150 μl/孔加DMSO溶液,混匀。酶标仪测定490 nm波长各孔的光密度值(OD值)。实验重复3次。
1.6 Transwell小室检测细胞侵袭能力 Transwell小室滤膜(8 μm孔径)中添加50 μl的Matrigel混合液(Matrigel胶∶培养基=1∶6),使混合液完全覆盖滤膜,放置在37℃培养箱孵育2 h使Matrigel凝固。待Matrigel凝固后,在Transwell小室上室加100 μl无血清培养基,下室加600 μl无血清培养基,37℃平衡过夜。胰酶消化转染48 h的各组细胞,PBS漂洗2次,计数。取1×105个细胞,100 μl无血清培养基重悬,后将细胞悬液添加至小室上室,下室加500 μl完全培养基。小室放置于培养箱常规孵育48 h,拭掉上室细胞,4%多聚甲醛固定20 min,0.1%结晶紫染色10 min,PBS洗涤2次。显微镜下随机选择5个视野,观察穿过膜的细胞数,拍照,统计数量。实验重复3次。
1.7 Annexin V-FITC/PI双染法检测细胞凋亡 依据细胞凋亡试剂盒说明,胰酶消化转染48 h的各组细胞,调整细胞浓度为5×105个/ml,预冷PBS洗涤细胞,结合缓冲液重悬细胞。取100 μl细胞悬液,加入5 μl Annexin V-FITC和5 μl PI,避光室温孵育15~20 min,加400 μl结合缓冲液,1 h内流式细胞仪检测。实验重复3次。
1.8 双荧光素酶报告基因实验 构建含miR-411和PIK3R3结合位点的PIK3R3野生型及突变型3’UTR 报告质粒,命名为WT和MUT。接种SiHa细胞于24孔板,密度为5×104个/孔,放置于培养箱常规培养,细胞达80%融合时,将WT/MUT的PIK3R3 3’UTR质粒分别与miR-411 mimics和miR-NC共转染至SiHa细胞,转染参照Lipofectamine 2000说明,每组设置3个重复孔。转染48 h,检测各组细胞荧光素酶活性。实验重复3次。
1.9 Western blotting检测PIK3R3、PI3K、p-AKT、PCNA、 E-cadherin和cleaved caspase3表达 收集转染miR-411 mimics/inhibitor 48 h的SiHa细胞,离心,在细胞沉淀中加适量RIPA裂解液,混匀,室温在冰上放置30 min,4℃离心,收集上清,总蛋白在上清液中。BCA蛋白浓度测定试剂盒检测蛋白浓度。在蛋白中添加5×上样缓冲液,100℃水浴10 min,离心,收集上清。凝胶上样孔加40 μg蛋白,每孔等量蛋白,电泳后转PVDF膜,转好的膜放置在TBST液中清洗5 min,室温条件将膜放置在5%脱脂奶粉中封闭1 h,TBST洗膜。膜放到经封闭液稀释的一抗中,4℃孵育过夜。TBST洗膜。膜放到经封闭液稀释的HRP标记的二抗中,室温孵育2 h。TBST洗膜,吸干膜上水分,在膜含蛋白面滴加ECL反应液,暗室内2 min,膜用保鲜膜覆盖,暗室内显影。Quantity One软件分析各抗体条带灰度值。实验重复3次。

2 结果
2.1 miR-411在宫颈癌细胞表达 qRT-PCR检测miR-411在不同宫颈癌细胞表达,结果显示,miR-411在Caski、SiHa和C-33A细胞表达均明显低于在End1/E6E7细胞表达(P<0.05)。选择表达最低的SiHa细胞作为研究对象。见表1。

表1 miR-411在宫颈癌Caski、Sika和C-33A细胞表达
2.2 miR-411可靶向调节PIK3R3表达 miR-411的5’UTR与PIK3R3的3’UTR存在7个连续的结合位点。双荧光素酶检测结果显示,miR-411 mimics与PIK3R3野生型质粒共转染,荧光素酶活性明显降低(P<0.05),而与PIK3R3突变型质粒共转染,荧光素酶活性无明显变化(P>0.05)。miR-411 mimics可明显抑制PIK3R3表达,而miR-411 inhibitor可明显促进PIK3R3表达(P<0.05)。提示miR-411和PIK3R3存在靶向关系,miR-411可负调控PIK3R3表达。见表2,图1。

表2 2组细胞荧光素酶活性
2.3 过表达miR-411对SiHa细胞增殖、侵袭和凋亡的影响 miR-411 mimics转染SiHa细胞48 h,miR-411表达明显升高(P<0.05)。说明过表达miR-411的SiHa细胞建立成功。细胞增殖、侵袭和凋亡检测结果显示,与miR-NC组比较,miR-411 mimics组细胞OD值明显降低,细胞侵袭数明显降低,凋亡率明显升高(P<0.05)。见图2,表3。

图2 过表达miR-411对SiHa细胞增殖、侵袭(A,×200)和凋亡(B)的影响

表3 过表达miR-411对SiHa细胞增殖、侵袭和凋亡影响
2.4 抑制PIK3R3表达对SiHa细胞增殖、侵袭和凋亡的影响 与si-NC组比较,si-PIK3R3组PIK3R3表达明显降低,细胞增殖及侵袭能力明显降低,凋亡率升高,差异均有统计学意义(P<0.05)。见图3,表4。

图3 抑制PIK3R3表达对SiHa细胞增殖、侵袭(A,×200)和凋亡(B)影响

表4 抑制PIK3R3表达对SiHa细胞增殖、侵袭和凋亡影响
2.5 过表达PIK3R3可逆转miR-411对SiHa细胞增殖、侵袭和凋亡影响 各组细胞增殖、细胞侵袭数及细胞凋亡率检测结果显示,与miR-NC组比较,miR-411 mimics组和miR-411 mimics+pcDNA组细胞增殖和细胞侵袭数明显降低,细胞凋亡率明显升高(P<0.05),与miR-411 mimics+pcDNA组比较,miR-411 mimics+pcDNA-PIK3R3组细胞增殖和细胞侵袭数明显升高,细胞凋亡率明显降低(P<0.05)。见图4,表5。
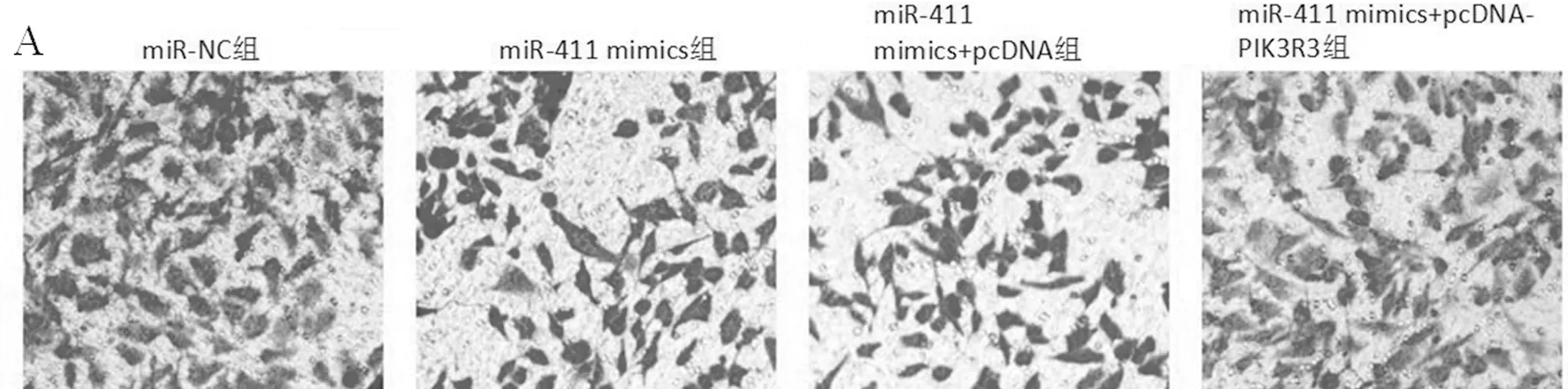

图4 过表达PIK3R3可逆转miR-411对SiHa细胞增殖、侵袭(A,×200)和凋亡(B)影响

表5 5转染细胞OD值、细胞侵袭数及细胞凋亡率
2.6 过表达miR-411对PI3K、p-AKT、PCNA、 E-cadherin和cleaved caspase3表达的影响 Western blotting检测结果显示,与miR-NC组比较,miR-411 mimics组PI3K、p-AKT和PCNA表达均明显降低(P<0.05), E-cadherin和cleaved caspase3表达均明显升高(P<0.05);与miR-411 mimics+pcDNA组比较,miR-411 mimics+pcDNA-PIK3R3组PI3K、p-AKT和PCNA表达均明显升高(P<0.05), E-cadherin和cleaved caspase3表达均明显降低(P<0.05)。见表6,图5。

表6 4组细胞PI3K、p-AKT、PCNA、 E-cadherin和cleaved caspase3蛋白相对表达量
3 讨论
作为一类非编码RNA,miRNA可通过调节靶基因表达,从而参与细胞死亡、细胞分化、细胞代谢等多个生理过程。已有研究表明,miRNA与心血管疾病、癌症、糖尿病等多种人类疾病密切相关[8-10]。有研究显示,宫颈癌可引起miRNA表达失调,如Pereira等[11]通过对miRNA表达谱分析,发现在宫颈鳞癌组织中有31个异常表达的miRNA,这些miRNA可作为宫颈鳞癌诊疗标志物。已有多项研究表明,miR-411与肿瘤生长有关,如Zhang等[12]研究显示,过表达miR-411可抑制肾癌细胞增殖和侵袭能力,并促进细胞凋亡。Chen等[13]研究显示,miR-411可通过调节DSLC27A2影响卵巢癌化疗敏感性。Zhang等[14]研究显示,miR-411-5p可通过靶向GRB2抑制乳腺癌细胞增殖和转移。本研究检测结果显示,miR-411在乳腺癌细胞表达明显降低,过表达miR-411可明显抑制SiHa细胞增殖和侵袭能力,并促进细胞凋亡,其中的细胞增殖和侵袭结果与既往研究结果[7]一致。
磷脂酰肌醇-3激酶调节亚基3(PIK3R3)是PI3K重要的调节亚基,已有研究报道其在包括宫颈癌在内的多种肿瘤中高表达,其表达有促进肿瘤增殖、转移及化疗抵抗等功效[15,16]。有研究显示,miR-212可靶向PIK3R3抑制结直肠癌细胞的活力和侵袭能力[17];miR-511可靶向PIK3R3抑制肝癌细胞生长和转移[18]。也有研究表明,miR-411可靶向PIK3R3抑制结直肠癌细胞增殖和侵袭,并促进细胞凋亡[19]。本研究通过双荧光素酶报告基因实验及miR-411mimics/inhibitor对PIK3R3表达影响,证明miR-411可靶向负调控PIK3R3表达。抑制PIK3R3表达可明显降低SiHa细胞增殖和侵袭能力,并促进细胞凋亡,而过表达PIK3R3可减弱miR-411对细胞增殖、侵袭和凋亡的影响。提示miR-411可靶向抑制PIK3R3抑制宫颈癌细胞生长。
PI3K/AKT信号通路是一条与肿瘤发生发展密切相关的信号途径,在包括宫颈癌在内的多种肿瘤中被激活[20,21],研究表明,抑制该信号通路是有效的抗肿瘤手段[22]。AKT是PI3K的下游分子,其活化后可通过调节PCNA、E-cadherin、caspase3等基因表达,从而影响细胞的生长、增殖等过程[23]。PCNA与DNA合成密切相关,其表达高低可反映细胞增殖状态,有研究显示,PIK3R3可通过其NH2末端与RBI和PCNA互作,从而发挥癌基因功能。上皮间质转化(EMT)是引起恶性肿瘤发生远处转移的关键步骤,E-cadherin是EMT的标志蛋白,有研究显示,PIK3R3可通过ZEB1介导的EMT促进胰腺癌转移[24]。caspase3是凋亡相关的caspase家族关键酶,其活化可促进细胞凋亡[25]。本研究结果显示,过表达miR-411可抑制PI3K、p-AKT和PCNA表达,促进 E-cadherin和cleaved caspase3表达;而过表达PIK3R3可逆转miR-411对PI3K、p-AKT、PCNA、 E-cadherin和cleaved caspase3表达的影响。有研究显示,miR-365可靶向PIK3R3抑制AKT/mTOR信号通路,从而降低胶质瘤细胞的增殖、侵袭和迁移能力[26]。提示miR-411可靶向PIK3R3抑制PI3K/AKT信号通路,从而抑制宫颈癌细胞生长。
综上所述,miR-411在宫颈癌细胞低表达,过表达miR-411可抑制宫颈癌细胞增殖和侵袭能力,并促进细胞凋亡,提示miR-411/PIK3R3在宫颈癌发病中有一定作用,有望成为宫颈癌治疗的潜在靶点。
