携带不同原噬菌体的黄龙病菌在柑橘木虱体内的增殖及致病力
2022-04-21黄家权李莉吴丰年郑正邓晓玲
黄家权,李莉,吴丰年,郑正,邓晓玲
携带不同原噬菌体的黄龙病菌在柑橘木虱体内的增殖及致病力
黄家权1,李莉1,吴丰年2,郑正1,邓晓玲1
1华南农业大学植物保护学院,广州 510642;2韩山师范学院生命科学与食品工程学院,广东潮州 521041
在中国,柑橘黄龙病(citrus Huanglongbing,HLB)是由候选韧皮部杆菌亚洲种(‘Liberibacter asiaticus’,Las)所引起的一种毁灭性病害,严重威胁着柑橘产业的可持续发展。前期研究表明Las全基因组上鉴定出3种单独类型的原噬菌体基因序列,而广东黄龙病菌主要以Type-2原噬菌体类型和Type-1+3混合原噬菌体类型为主。这两种Las菌株在传病媒介——柑橘木虱()体内的增殖及其对寄主植物的致病力差异依然不清楚。【】比较Type-2-Las菌株和Type-1+3-Las菌株在柑橘木虱体内的增殖能力和对砂糖橘(Blanco cv. shatangju)的致病力差异。嫁接准备含有不同Las菌株的砂糖橘,分别将50头柑橘木虱若虫和50头成虫放置到含有不同Las菌株的砂糖橘嫩梢上刺吸获菌 6、12、18 d,利用荧光定量PCR检测并统计柑橘木虱若虫期、成虫期对Type-2-Las和Type-1+3-Las的获菌率和获菌量差异。饲养分别携带Type-2-Las和Type-1+3-Las菌株的柑橘木虱种群,分别将携带Type-2-Las和Type-1+3-Las菌株的20头柑橘木虱成虫置于健康砂糖橘嫩梢上刺吸2周,移除木虱后统计柑橘木虱获菌率和获菌量,每月追踪砂糖橘症状变化和叶片病菌浓度,利用光学显微镜观察接种360 d时叶片韧皮部和薄壁细胞形态学变化情况。柑橘木虱以若虫形态对Type-2-Las和Type-1+3-Las菌株的获菌率和获菌量无显著差异,但柑橘木虱以成虫形态对Type-2-Las的获菌率和获菌量显著高于Type-1+3-Las菌株。在虫传后120 d时接种Type-2-CLas菌株的叶片附近新叶会呈现更严重的斑驳症状。Type-2-Las菌株侵染砂糖橘一年后抽出的新叶转绿不正常,出现均匀黄化、小叶的明显症状,而Type-1+3-CLas菌株新叶症状则为典型斑驳和革质化。叶片解剖观察结果发现,在叶片病菌浓度相近的情况下,相比于接种了Type-1+3-Las 的叶片,接种了Type-2-Las菌株的叶片韧皮部细胞发生更严重的细胞塌缩,在叶脉和叶肉薄壁细胞内造成较多的淀粉粒积累。Type-2-Las比Type-1+3-Las更容易在柑橘木虱成虫体内增殖,且达到较高的病菌浓度,间接证明了Type-2-Las菌株具有高传染性。感染Type-2-Las的新叶呈现均匀黄化、叶小的症状,而感染Type-1+3-Las的新叶呈现较为斑驳和革质化的症状,Type-2-Las比Type-1+3-Las造成更严重的叶脉韧皮部塌缩和淀粉粒积累情况,说明Type-2-Las比Type-1+3-Las对柑橘具有更强的致病力。
柑橘黄龙病;候选韧皮部杆菌亚洲种;原噬菌体;柑橘木虱;致病力
0 引言
【研究意义】柑橘黄龙病(citrus Huanglongbing,HLB)是世界柑橘生产上的毁灭性病害[1],由韧皮部杆菌属‘Liberibacter spp.’引起[2],在我国,主要是由亚洲种‘Liberibacter asiaticus’(Las)所引起[3]。广东是最早发生柑橘黄龙病的地方,该病害在20世纪50年代开始流行危害[4-5]。前期研究表明,Las基因组鉴定出多种类型原噬菌体,广东地区的Las菌株主要为携带Type 2原噬菌体类型的Las(简称Type-2-Las)以及携带Type 1和Type 3混合原噬菌体类型的Las(简称Type-1+3-Las),而目前尚未有针对这两种菌株在柑橘木虱()体内增殖情况以及致病力差异的研究。【前人研究进展】近年来,已从Las全基因组中鉴定出3种单独的原噬菌体类型:Type 1(SC1)、Type 2(SC2)、Type 3(P-JXGC-3)[6-7],并且成功应用于柑橘黄龙病菌种群多样性分析[8]。在美国佛罗里达地区报道的UF506菌株中Type 1和Type 2噬菌体可以整合在同一染色体上,为单一Las菌株。在中国主要的黄龙病流行区,Type 2原噬菌体类型是优势菌株,而Type 1类型往往是与其他原噬菌体类型混合,尤其是与Type 3原噬菌体类型[9-10]。在广东地区,Type-2-Las检出频率最高,Type-1+3-Las检出频率高于Type 3单独原噬菌体类型和其他混合类型,Type 1单独原噬菌体类型未被检出[10]。已有研究表明Type 2原噬菌体可编码假定的黏附素基因和过氧化物酶基因来增强细菌定殖和抵抗植物免疫反应,延缓症状表现[6,11]。Type-1+3-Las上的Type 1原噬菌体序列编码假定的裂解基因和穿孔蛋白基因参与噬菌体裂解循环,而Type 3原噬菌体序列则编码了限制-修饰系统(R-M),抑制外来DNA的入侵[7,12]。柑橘黄龙病的传播蔓延主要依赖于其昆虫媒介——亚洲柑橘木虱[13],柑橘木虱若虫及成虫均可从柑橘黄龙病树获菌[14],若虫期的获菌率和获菌量高于成虫期[15]。柑橘木虱传病效率与带菌木虱数量、病菌浓度、枝梢幼嫩程度有明显关系,而若虫期获菌的柑橘木虱比成虫期获菌的柑橘木虱具有更高的传病效率,单头柑橘木虱可实现病菌传播[14,16-18]。在柑橘木虱传播Las后,植株有几个月的潜伏期[19-21],此时基于荧光定量PCR的检测方法可实现病菌的早期追踪[22]。柑橘黄龙病树感病初期的叶片典型症状为新梢新叶在发育过程中停止转绿,出现新叶均匀黄化、革质化,老叶出现斑驳、叶脉肿大等[4]。显症叶片的微观症状主要呈现为韧皮部塌缩及细胞形变,薄壁细胞内淀粉粒积累,胼胝质沉积导致筛孔堵塞[23]。【本研究切入点】在广东地区主要存在Type-2-Las和Type-1+3-Las菌株,目前尚未有柑橘木虱获取和传播Type-2-Las和Type-1+3-Las 菌株的报道,亦未见针对这两种Las菌株致病力差异的探讨。【拟解决的关键问题】比较Type-2-Las和Type-1+3-Las在柑橘木虱体内的增殖情况,在此基础上,通过从宏观和微观症状上的比较来解析两种Las菌株的致病力差异。
1 材料与方法
试验于 2018 年 3 月至 2020 年 11 月在华南农业大学植物保护学院柑橘黄龙病研究室完成。
1.1 供试材料
含有Las的枝条采集于广东省惠州市博罗县杨村镇柑橘基地,使用Las的3种原噬菌体特异性引物(表1)检测出Type-1+3-Las 和Type-2-Las,而后将含有不同Las菌株的芽条分别嫁接于健康砂糖橘材料。两个月后提取DNA,检测Las感染情况和原噬菌体类型。
柑橘木虱种群饲养在华南农业大学柑橘黄龙病研究室的健康九里香,来自于单一父本母本的3代种群。供试柑橘木虱成虫是在九里香上羽化2 d的成虫,在刺吸病株前进行1 d饥饿处理。柑橘木虱若虫是在九里香上由卵孵化的3龄若虫。

表1 实时荧光定量PCR引物序列信息
1.2 健康柑橘木虱若虫和成虫获取不同CLas菌株的比较
参考Wu等[15]的方法,研究柑橘木虱若虫期和成虫期Type-1+3-Las和Type-2-Las的获菌率和获菌量差异,设置如下:(1)健康木虱若虫饲菌处理:分别将50头3龄柑橘木虱若虫用毛笔从九里香上转移至病株嫩梢上,刺吸6、12、18 d各收集10头柑橘木虱,单头提取DNA。其中6 d采集的为5龄若虫,12 d时柑橘木虱已全部羽化为成虫,设置3组病株重复;(2)健康木虱成虫饲菌处理:分别将50头刚羽化的健康柑橘木虱成虫置于不同Las菌株的柑橘嫩梢上,刺吸6、12、18 d各收集10头柑橘木虱,单头提取DNA。上述木虱DNA使用Las-4G引物检测Las浓度,并记录木虱获菌率和获菌量,设置3组病株重复。
1.3 携带不同CLas菌株的柑橘木虱传病比较和叶片症状观察
为比较不同Las菌株的致病力差异,将腹部为橙黄色的健康柑橘木虱雌虫置于带有嫩芽的不同Las菌株砂糖橘上产卵,待产卵后将健康柑橘木虱移走,待卵孵化并继续刺吸获菌至成虫后2周,检测柑橘木虱带菌率。对病株上的带菌木虱种群随机采样10头成虫进行检测,确认柑橘木虱种群带菌率为80%以上后,分别从种群内取20头携带不同Las菌株的柑橘木虱成虫转移至两组各10株健康砂糖橘的一周龄嫩梢上并套袋,放置于同等条件下刺吸传病。待木虱取食2周后,移走柑橘木虱,统计木虱存活率并提取DNA,利用Las-4G引物检测并统计木虱带菌量,对植株喷施70%吡虫啉水分散粒剂(中科化工)2000倍进行虫害防治,后放置于华南农业大学植物保护学院网室中,统一水肥管理。移除柑橘木虱后的60d开始对植株进行树势拍照观察,至360 d结束。
1.4 感染不同CLas菌株的柑橘叶片韧皮部和薄壁组织切片观察
在360 d时,对感染不同Las菌株叶片的叶中脉和叶肉组织的韧皮部和薄壁细胞进行观察,具体方法:对病叶的叶柄往上约0.5 cm处截取约1 cm的叶中脉,对病叶左侧叶片截取约0.5 cm×0.5 cm的矩形叶片,均放入F.A.A固定液中固定24 h。F.A.A固定液配比为福尔马林溶液(38%甲醛)5 mL与70%酒精90 mL、冰醋酸5 mL[25]。固定后的样品送往武汉塞维尔公司进行番红固绿染色并制作石蜡切片,最后使用Nikon ECLIPSE Ni series显微镜对切片进行观察并拍照记录。
1.5 DNA提取和实时荧光定量PCR检测
植物DNA提取:柑橘叶片剪取叶中脉和枝条韧皮部直接剪碎进行DNA提取。总DNA的提取方法参照 OMEGA BIO-TEK公司的植物DNA提取试剂盒HP Plant DNA Kit(200)(2485-02)。柑橘木虱DNA提取:单头柑橘木虱成虫和单头5龄若虫分别放入1.5 ml离心管中,使用研磨棒研磨后,提取方法参照北京天根生化科技公司的血液/细胞/组织基因组DNA提取试剂盒(DP-304-02),DNA定容60μL。DNA样品使用核酸定量仪Nanodrop(Thermo Fisher Scientific)进行纯度和浓度的测定,提取的DNA保存于-20℃备用。
采用实时荧光定量PCR(qPCR)的方法对植物和昆虫DNA样品中的Las(Las-4G-qPCR)及其原噬菌体区域(Prophage-qPCR)进行检测,参考ZHENG等的方法[10,25],具体引物序列参照表1。所有反应均在Bio-Rad Real-Time PCR仪(Bio-Rad Laboratories Inc., HercuLes,CA,USA)上进行。针对1.2和1.3试验中柑橘木虱和病株样品采用Taq-Man-qPCR定量检测,以ddH2O为空白对照,健康柑橘木虱DNA样本为阴性对照,已知含有Las的柑橘木虱DNA为阳性对照。Taq-Man-qPCR产生的Ct值大于34代表样本不含有Las,数值小于32代表样本含有Las。参考文献[26]中以菌株质粒和拷贝数为计算依据来检测样品中Las数量的方法,Las-4G-qPCR使用含有引物Las-4G扩增片段的pEASY-T1(TransGen Biotech)重组质粒制作标准曲线,共7个梯度(10倍稀释)。初始的质粒浓度用核酸定量仪(Qubit)进行测定。质粒的拷贝数计算公式为质粒拷贝数=(阿伏伽德罗常数×浓度)/(重组质粒碱基对长度×1×109×650),阿伏伽德罗常数为6.022×1023,浓度单位为ng·μL-1。通过qPCR得出的标准曲线方程,计算每个引物的扩增效率,对每个样品进行拷贝数的换算。Las的浓度以总DNA的换算拷贝数来表示,Las-4G 引物是针对Las基因组上具有3个拷贝的16S rRNA基因位点设计的引物,且DNA定容体积为60 μL,因此单头柑橘木虱总Las数目的计算公式为(样品换算拷贝数值/3)×60 μL。
1.6 数据统计与分析
数据分析使用R语言实现,参考WU[15]的方法(https://gist.github.com/eduardofox2/7a904d7422bace 77e2d8f8ee517f77f5)。基于试验数据的重复性和正态分布分析,本试验的数据使用非参数分析中的Kruskal-Wallis 秩和检验方法进行三因子分析和Wilcoxon Mann-Whitney检验进行双因子分析。
2 结果
2.1 健康柑橘木虱若虫与成虫获取不同CLas菌株的比较
利用Wilcoxon Mann-Whitney检验方法统计柑橘木虱若虫期刺吸对Type-1+3-Las和Type-2-Las 的总获菌率和获菌量,结果如表2所示,在连续采样时间内的总获菌率和获菌量均无显著差异(获菌率=0.08>0.05;获菌量=0.91>0.05)。利用Kruskal-Wallis秩和检验方法对Type-1+3-Las和Type-2-Las在柑橘木虱体内的增殖情况进行分析,结果显示5龄若虫对Type-1+3-Las的获菌率明显低于羽化后成虫的获菌率,若虫期对Type-2-Las和Type-1+3-Las的获菌量分别在12 d和18 d达到最高,而Type-2-Las的获菌量在18 d回落。
利用Wilcoxon Mann-Whitney检验方法统计柑橘木虱成虫期刺吸对Type-1+3-Las和Type-2-Las的总获菌率和获菌量,结果如表2所示,健康柑橘木虱成虫在连续采样时间内对Type-2-Las的总获菌率和获菌量均显著高于在Type-1+3-Las(获菌率=0.009<0.05;获菌量=2.25e-05<0.05),在12 d的Las个数达到最高的单虫(4.59±1.27)×106个,显著高于成虫在其他时间段的获菌量,且与木虱若虫期在12 d时的获菌量接近。
2.2 携带不同CLas菌株的柑橘木虱传病情况及植株症状观察
Type-1+3-Las和Type-2-Las的虫传植株分别有8个重复样本。在进行虫传前,对健康砂糖橘嫩梢叶片进行qPCR检测,结果显示用于虫传试验的植株在试验前均不携带Las(表3)。在虫传两周后对袋内存活的柑橘木虱进行检测,结果显示用于Type 1+3虫传的8组柑橘木虱的获菌率为100%,Ct值范围为21.25—22.84,而用于Type 2虫传的8组柑橘木虱除了CCT2-2、2-5、2-7、2-8植株的获菌率分别为94.12%、50.00%、88.89%、20.00%外,其余4组柑橘木虱获菌率均为100%,Ct值范围为21.05—25.74(表3)。对获菌率>50%的柑橘木虱带菌Ct值进行统计,结果表明在柑橘木虱体内的两种菌株浓度无显著差异。在移除媒介昆虫后的60 d对两组虫传的嫩梢进行qPCR检测,结果显示在60 d时,Type 1+3组的传病率为87.5%,而Type 2组的传病率为42.86%,至360 d时对抽发新梢进行检测,虫传植株获菌率均为100%。
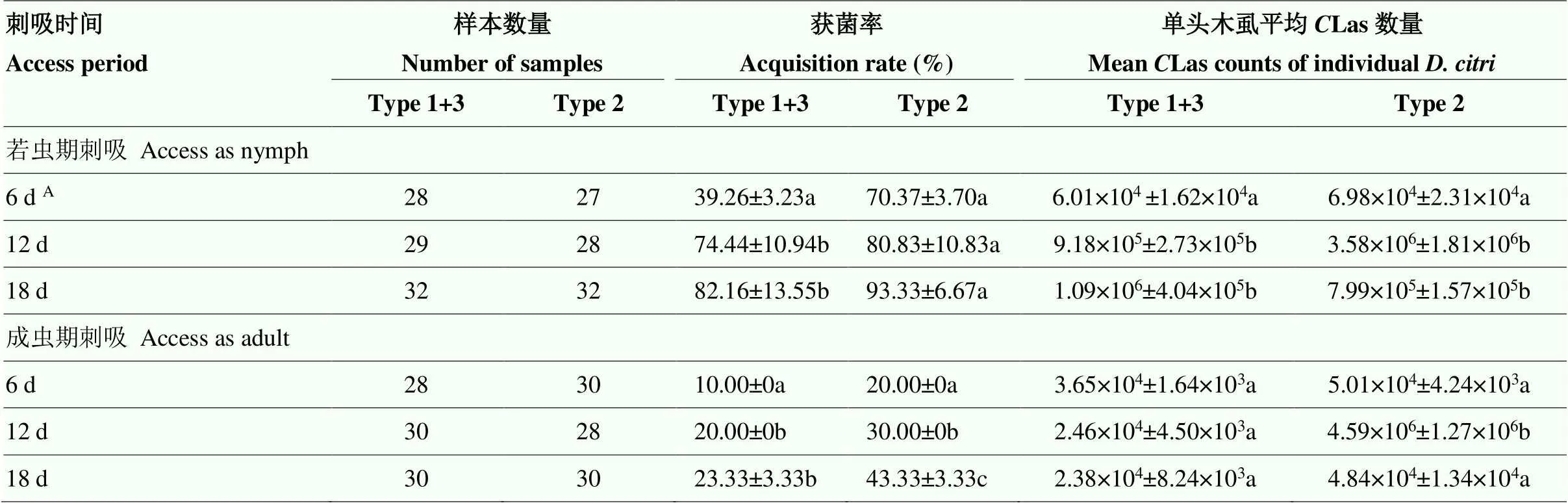
表2 不同虫期的柑橘木虱对不同CLas菌株的获菌率及获菌量
A柑橘木虱在5龄若虫期收集were collected at 5th instar nymph stage;数据后小写字母lowercases after the data:利用Kruskal-Wallis秩和检验方法对连续取样时间内的数值进行统计分析,字母的相异表示在置信区间为95%的水平下,与其他值有显著差异Kruskal-wallis rank sum test was used to statistic the value of continuous sampling times, different lowercases represent significant variance among the value within 95% confidence interval
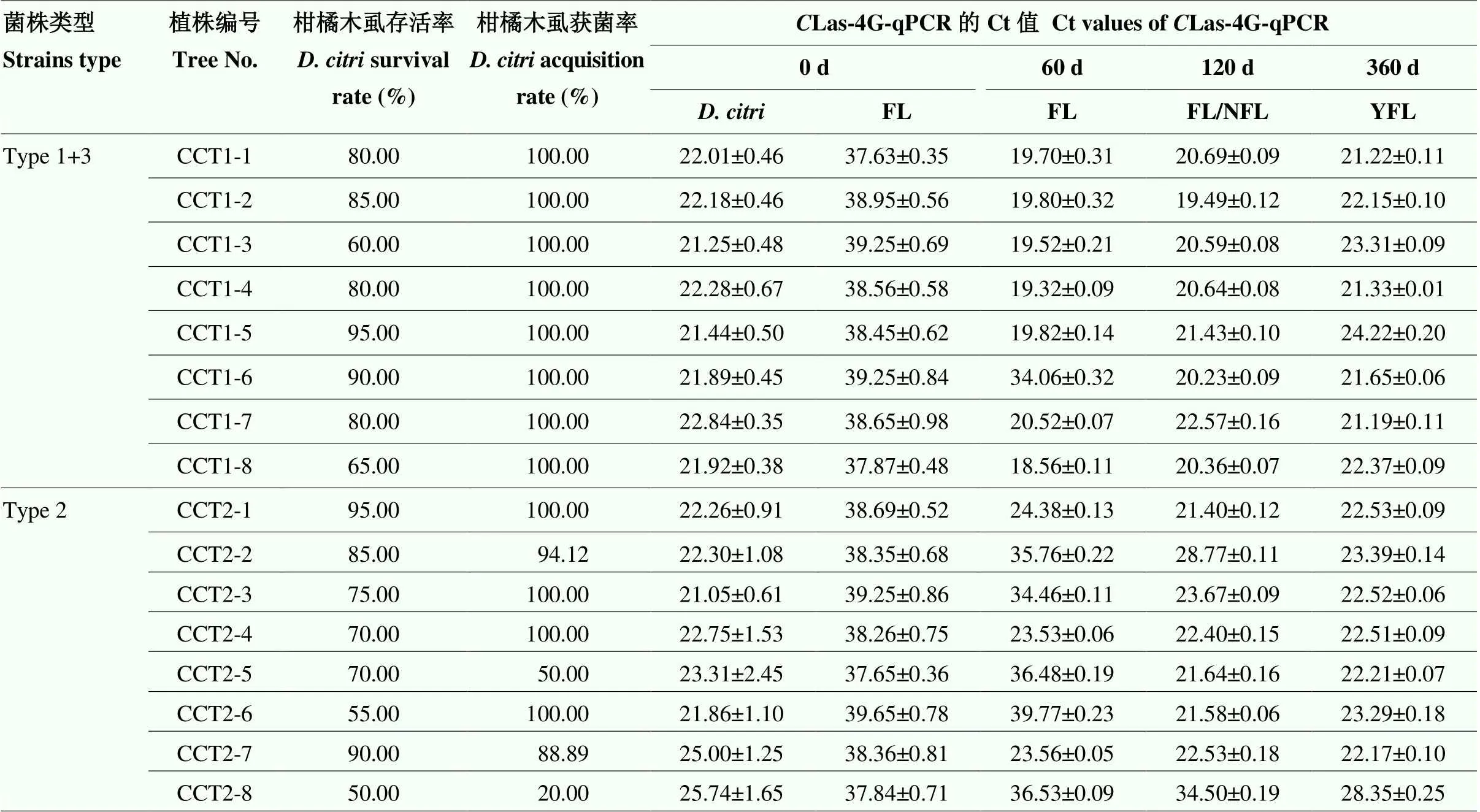
表3 经柑橘木虱传播的不同CLas菌株对植株的侵染情况
FL:柑橘木虱直接刺吸的嫩叶Flush leaves;NFL:柑橘木虱刺吸部位附近的嫩叶Near flush leaves;YFL:移除媒介昆虫后新抽出的嫩叶Leaves emerged afterremoval。图1同 The same as Fig. 1
对虫传后的植株的症状观察结果显示,在移除媒介昆虫60 d时所有虫传植株的木虱刺吸部位出现了叶片卷曲、异常革质化的症状,但是并没有出现明显的黄龙病症状。在120 d时能观察到邻近的新梢出现斑驳的症状,而Type-2-Las虫传植株的斑驳症状更为严重;在360 d时,Type-2-Las病树新抽出的叶片普遍出现叶小,均匀黄化等症状,而Type-1+3-Las病树新抽出的叶片普遍为斑驳,叶肉轻微黄化,叶片大小正常(图1)。

图1 不同CLas菌株引起的柑橘黄龙病症状差异
2.3 感染不同CLas菌株的叶片韧皮部和薄壁组织的显微切片观察
分别采集图1 中处于360 d的Type-1+3-Las和Type-2-Las的Ct值无显著差异的新抽梢叶片,对其叶中脉和叶肉组织进行切片观察,结果显示在叶中脉组织中,与健康叶片相比,感染了Type-1+3-Las和Type-2-Las的韧皮部细胞出现明显的不规则排列和细胞变形(图2-a、2-c、2-e)。感染了Type-2-Las的中脉韧皮部细胞(图2-c)较Type-1+3-Las的塌缩程度更为严重(图2-a)。感染了Type-1+3-Las和Type-2-Las的中脉薄壁细胞对比健康叶片出现淀粉粒积累的现象,但是相比于Type-1+3-Las,Type-2-Las叶片的薄壁细胞出现了更明显的淀粉粒积累(图2-a、2-c)。在叶肉薄壁组织中,感染了Type-1+3-Las和Type-2-Las的叶片(图2-b、2-d)对比健康叶片(图2-f)出现明显的淀粉粒积累,而感染Type-2-Las的叶肉薄壁组织中淀粉粒积累程度是最高的。

红色数字:使用CLas-4G引物的Ct值Red numbers below the leaf images are the Ct value generated by qPCR using CLas-4G primer;黑色箭头:指向淀粉粒积累的位置Black arrow pointed out the starch granule;红色箭头:指向韧皮部细胞塌缩的位置red arrow pointed out the collapse of phloem cell;蓝色和红色矩形框:叶肉和叶中脉组织切片采样区域Mesophyll tissues enclosed by blue rectangle and midrib tissues enclosed by red rectangle in leaves were sampled for tissue section;Pa:薄壁细胞parenchyma cell;Ph:韧皮部phloem;Xy:木质部xylem;Fi:韧皮部纤维phloem fibers;Pi:髓心pith
3 讨论
笔者课题组在2010—2019年间从广东不同地市采集的柑橘黄龙病样本中,检出Type-2-Las为频率最高的菌株,其次为Type-1+3-Las[10]。因此,本研究以柑橘木虱为传病昆虫媒介,研究Type-2-Las和Type-1+3-Las两种不同菌株在柑橘木虱体内的增殖情况以及这两种Las菌株对砂糖橘的致病力差异。
3.1 Type-2-CLas菌株的强增殖能力是其成为广东地区主要菌株的原因
柑橘木虱在若虫期分别获取不同Las菌株后,虽然对Type-2-Las的获菌指标都高于Type-1+ 3-Las,但是并没达到统计学的差异。前人研究表明,柑橘木虱在若虫期获取Las的能力和随后的增殖浓度都明显高于成虫期获菌[15,17],而这两种Las菌株都成功在木虱若虫体内增殖,原噬菌体区域的基因可能并未对Las的后期增殖产生显著的影响。而柑橘木虱成虫期对Type-2-Las的获菌率和获菌量显著高于对Type-1+3-Las的获菌率和获菌量,推测原因可能是SC2(Type 2)可以编码黏附素,从而增强病菌在寄主细胞上的黏附性[6],促使Type-2-Las对比于Type-1+3-Las更容易侵染柑橘木虱成虫,且具备在木虱体内增殖的能力。WU等[15]研究表明,在成虫期获菌的柑橘木虱比在若虫期获菌的木虱更难以传播病菌至植株,这是因为健康柑橘木虱只能获取低浓度的Las。本试验结果显示,虽然成虫期柑橘木虱的获菌率仍然显著低于若虫期获菌,但成虫期在12 d检测到的Type-2-Las获菌量与若虫期在12 d检测到的Type- 2-Las获菌量无显著差异(表2)。CCT2-8植株被携带Type-2-Las的两头柑橘木虱刺吸,在移除媒介昆虫360 d时可检测出黄龙病菌(表3)。结合前人研究中提到,单头带菌柑橘木虱可传播Las至植株[14,16]。笔者由此推断健康柑橘木虱成虫也存在一定概率获得较高的Type-2-Las浓度且具备传播能力,这可能是Type-2-Las菌株在广东地区始终保持优势地位的原因。Type-2-Las菌株在广东等低海拔地区为优势菌株,而在中国高海拔地区,如云南、贵州等地,则以Type 1+3-Las 菌株为主[27]。同样地,在云南、贵州、四川等高海拔地区的柑橘木虱种群为MG1种群,区别于广东、广西地区的MG2种群[28]。因此未来可以进一步探讨云南、贵州、四川地区柑橘木虱种群对Type-1+3-Las菌株的获取情况和传播能力,这将为柑橘木虱和柑橘黄龙病菌共进化提供直接证据。
3.2 Type-2-CLas菌株对砂糖橘造成的严重症状与其自身致病因子与侵染的寄主品种相关
本研究对虫传后的植株进行跟踪拍照,发现木虱直接刺吸的部位都发生了物理上的形变(图1),与前人描述的物理危害一致[29]。在移除媒介昆虫后的60 d和120 d时可在直接刺吸的叶片检测出高浓度病菌(较低的Ct值),可叶片并未出现典型的黄龙病症状。这可能是由于Las具有编码过氧化物酶基因的能力,降低植物的自身免疫反应,延缓了被刺吸叶片上症状的表现,间接增强Las定殖能力[30]。而在120 d时,在两种类型的病株上都观察到邻近的新梢叶片(未被直接刺吸),仍出现斑驳的症状,这与PANDEY等[31]近期的虫传研究结果一致。从总体症状上观察,Type-2-Las对柑橘叶片造成的症状比Type-1+3-Las的严重,特别是360 d时,Type-2-Las的病株抽出的新梢成熟后均为小叶、严重革质化、均匀黄化的症状(图1)。对感病叶片的韧皮部和薄壁细胞进行显微观察,可清晰看出Type-2-Las叶片的韧皮部塌缩情况和淀粉粒积累情况严重于Type-1+3-Las的叶片(图2)。植株对Las的免疫应激响应会导致韧皮部筛管堵塞,进而造成韧皮部细胞塌缩,光合产物无法运转出去,而光合作用相关基因的上调进一步加剧淀粉粒在薄壁细胞的积累[23]。淀粉的积累会负反馈调节光合作用,并且过量的淀粉积累会破坏叶绿体的类囊体结构,加剧叶片的衰老[32]。由此推测Type-2-Las 菌株导致的均匀黄化症状与过量淀粉粒积累有关。由于处于同等发育状态且具有接近Las浓度的Type-1+3类型感病叶片并未出现如此严重的症状,因此本研究推测砂糖橘在感染Type-2-Las之后产生更严重的症状的原因可能有两点:(1)Type-2-Las菌株本身相对于Type-1+3-Las具有更强的致病因子,这部分基因可能在Type 2原噬菌体序列上,目前已知的是Type-2-Las具有编码过氧化物酶基因的能力[11],而过氧化物酶可降解由植物产生的过氧化合物,从而增强Type-2-Las的系统侵染能力;(2)本研究使用的指示植物为广东传统种植的砂糖橘,而不同柑橘品种对于柑橘黄龙病的抗性和症状表现程度均不相同,如椪柑是感病品种,植株叶片感染后会显现典型的斑驳黄化、小叶等症状,而琯溪蜜柚是耐病品种,叶片仅显现斑驳、褪绿的等轻微症状[33]。
3.3 展望
在本文中仅开展了Type-1+3-Las和Type-2-Las菌株对砂糖橘的致病力差异研究,而在今后可进一步比较这两种菌株对其他柑橘品种造成症状的差异,这对于病原-寄主互作研究具有一定的意义。Type-2-Las更易于在东南地区柑橘木虱种群成虫内增殖且具有较高传播能力,说明Type-2-Las具有高传染性;另外,通过柑橘木虱传播Type-2-Las导致砂糖橘表现更为严重的叶片症状和韧皮部组织破坏,说明Type-2-Las菌株对于砂糖橘具有更强的致病性,综合以上两个结果可得出在我国广东地区,Type-2-Las比Type-1+3-Las对砂糖橘具有更高的危害性。已知Type-1+3-Las和Type -2-Las的基因组存在差异,因此今后可通过病原-媒介-寄主三者互作转录组分析等手段挖掘造成这两种菌株致病力差异的基因和效应因子,进一步探明造成这一差异的致病机制与通路。
4 结论
Type-2-Las 比Type-1+3-Las更容易在柑橘木虱成虫体内增殖,且达到较高的病菌浓度,证明Type-2-Las菌株具有高传染性。感染Type-2-Las的新叶呈现均匀黄化、叶小、革质化的症状,Type-2-Las比Type-1+3-Las造成更严重的叶脉韧皮部塌缩和淀粉粒积累情况,表明在我国广东地区,Type-2-Las比Type-1+3-Las对柑橘具有更强的致病力。
[1] BOVÉ J M. Huanglongbing: A destructive, newly-emerging, century-old disease of citrus. Journal of Plant Pathology, 2006, 88(1): 7-37.
[2] JAGOUEIX S, BOVÉ J M, GARNIER M. The phloem-limited bacterium of greening disease of citrus is a member of the alpha subdivision of the Proteobacteria. International Journal of Systematic Bacteriology, 1994, 44(3): 379-386.
[3] 邓晓玲, 唐伟文. 应用PCR技术检测柑桔黄龙病病原的研究. 华南农业大学学报, 1996, 17(3): 119-120.
DENG X L, TANG W W. The studies on detection of citrus huanglongbing pathogen by polymerase chain reaction. Journal of South China Agricultural University, 1996, 17(3): 119-120. (in Chinese)
[4] 林孔湘. 柑桔黄梢(黄龙)病研究Ⅰ-病情调查. 植物病理学报, 1956, 2(1): 1-11.
LIN K X. Observation on yellow shoots disease of citrus.Acta Phytopathologica Sinica, 1956, 2(1): 1-11. (in Chinese)
[5] ZHENG Z, CHEN J, DENG X. Historical perspectives, management, and current research of citrus HLB in Guangdong Province of China, where the disease has been endemic for over a hundred years. Phytopathology, 2018, 108(11): 1224-1236.
[6] ZHANG S, FLORES-CRUZ Z, ZHOU L, KANG B H, FLEITES L A, GOOCH M D, WULFF N A, DAVIS M J, DUAN Y P, GABRIEL D W. ‘. Liberibacter asiaticus’ carries an excision plasmid prophage and a chromosomally integrated prophage that becomes lytic in plant infections. Molecular Plant-Microbe Interactions, 2011, 24(4): 458-468.
[7] ZHENG Z, BAO M, WU F, VAN HORN C, CHEN J, DENG X. A type 3 prophage of ‘Liberibacter asiaticus’ carrying a restriction-modification system. Phytopathology, 2018, 108(4): 454-461.
[8] DAI Z, WU F, ZHENG Z, YOKOMI R, KUMAGAI L, CAI W, RASCOE J, POLEK M, CHEN J, DENG X. Prophage diversity of ‘Liberibacter asiaticus’ strains in California. Phytopathology, 2019, 109(4): 551-559.
[9] 李嘉慧, 郑正, 邓晓玲. 基于原噬菌体类型的我国柑橘黄龙病菌种群遗传结构分析. 植物病理学报, 2019, 49(3): 334-342.
LI J H, ZHENG Z, DENG X L. Population genetic structure of ‘Liberibacter asiaticus’ in China based on the prophage types. Acta Phytopathologica Sinica, 2019, 49(3): 334-342. (in Chinese)
[10] ZHENG Y, HUANG H, HUANG Z, DENG X, ZHENG Z, XU M. Prophage region and short tandem repeats of ‘Liberibacter asiaticus’ reveal significant population structure in China. Plant Pathology, 2021, 70(4): 959-969.
[11] JAIN M, FLEITES L A, GABRIEL D W. Prophage-encoded peroxidase in ‘Liberibacter asiaticus’ is a secreted effector that suppresses plant defenses. Molecular Plant-Microbe Interactions, 2015, 28(12): 1330-1337.
[12] FLEITES L A, JAIN M, ZHANG S, GABRIEL D W. ‘Liberibacter asiaticus’ prophage late genes may limit host range and culturability. Applied and Environmental Microbiology, 2014, 80(19): 6023-6230.
[13] 范国成, 刘波, 吴如健, 李韬, 蔡子坚, 柯冲. 中国柑橘黄龙病研究30年. 福建农业学报, 2009, 24(2): 183-190.
Fan G C, Liu B, Wu R J, Li T, Cai Z J, Ke C. Thirty years of research on citrus Huanglongbing in China. Fujian Journal of Agricultural Sciences, 2009, 24(2): 183-190. (in Chinese)
[14] 许长藩, 夏雨华, 李开本, 柯冲. 柑桔木虱传播黄龙病的规律及病原在虫体内分布的研究. 福建农业学报, 1988, 3(2): 57-62.
XU C F, XIA Y H, Li K B, Ke C. studies on the law of transmission of citrus huanglongbing by psyllid,and the distribution of pathogen in the adult. Fujian Journal of Agricultural Sciences, 1988, 3(2): 57-62. (in Chinese)
[15] WU F, HUANG J, XU M, FOX E G P, BEATTIE G A C, HOLFORD P, CEN Y, DENG X. Host and environmental factors influencing ‘Liberibacter asiaticus’ acquisition in. Pest Management Science, 2018, 74(12): 2738-2746.
[16] INOUE H, OHNISHI J, ITO T, TOMIMURA K, MIYATA S, IWANAMI T, ASHIHARA W. Enhanced proliferation and efficient transmission of ‘Liberibacter asiaticus’ by adultafter acquisition feeding in the nymphal stage. Annals of Applied Biology, 2009, 155(1): 29-36.
[17] PELZ-STELINSKI K S, BRLANSKY R H, EBERT T A, ROGERS M E. Transmission parameters forLiberibacter asiaticus by Asian citrus psyllid (Hemiptera: Psyllidae). Journal of economic entomology, 2010, 103(5): 1531-1541.
[18] HALL D G, ALBRECHT U, BOWMAN K D. Transmission rates of ‘. Liberibacter asiaticus’ by Asian citrus psyllid are enhanced by the presence and developmental stage of citrus flush. Journal of Economic Entomology, 2016, 109(2): 558-563.
[19] 陈循渊, 廖长青. 柑桔木虱生物学特性观察及其与黄龙病的关系. 中国柑桔, 1982(4): 14-17.
CHEN X Y, LIAO C Q. Observation on biological characteristics ofand its relationship with citrus huanglongbing. Chinese citrus, 1982(4): 14-17. (in Chinese)
[20] LEE J A, HALBERT S E, DAWSON W O, ROBERTSON C J, KEESLING J E, SINGER B H. Asymptomatic spread of huanglongbing and implications for disease control. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(24): 7605-7610.
[21] GOTTWALD T R. Current epidemiological understanding of citrus huanglongbing. Annual review of phytopathology, 2010, 48: 119-139.
[22] LI W, HARTUNG J S, LEVY L. Quantitative real-time PCR for detection and identification ofLiberibacter species associated with citrus huanglongbing. Journal of microbiological methods, 2006, 66(1): 104-115.
[23] KIM J S, SAGARAM U S, BURNS J K, LI J L, WANG N. Response of sweet orange () to ‘Liberibacter asiaticus’ infection: microscopy and microarray analyses. Phytopathology, 2009, 99(1): 50-57.
[24] BAO M, ZHENG Z, SUN X, CHEN J, DENG X. Enhancing PCR capacity to detect ‘Liberibacter asiaticus’ utilizing whole genome sequence information. Plant Disease, 2020, 104(2): 527-532.
[25] SPURR A R. A low-viscosity epoxy resin embedding medium for electron microscopy. Journal of ultrastructure research, 1969, 26(1/2): 31-43.
[26] WANG Z, YIN Y, HU H, YUAN Q, PENG G, XIA Y. Development and application of molecular-based diagnosis for ‘Liberibacter asiaticus’, the causal pathogen of citrus huanglongbing. Plant Pathology, 2006, 55(5): 630-638.
[27] FU S, BAI Z, SU H, LIU J, HARTUNG J S, ZHOU C, WANG X. Occurrence of prophage and historical perspectives associated with the dissemination of huanglongbing in mainland China. Plant Pathology, 2020, 69(1): 132-138.
[28] WU F, JIANG H, BEATTIE G A, HOLFORD P, CHEN J, WALLIS C M, ZHENG Z, DENG X, CEN Y. Population diversity of(Hemiptera: Liviidae) in China based on whole mitochondrial genome sequences. Pestmanagement science, 2018, 74(11): 2569-2577.
[29] 谢佩华, 苏朝安, 林自国. 柑桔木虱生物学研究. 浙江农业大学学报, 1989, 15(2): 198-202.
XIE P H, SU C A, LIN Z G. Studies on the biology of the citrus psylla,Kuwayama (Homoptera, Psyllidae). Acta Agriculturae Universitatis Zhejiangensis, 1989, 15(2): 198-202. (in Chinese)
[30] JAIN M, MUNOZ-BODNAR A, ZHANG S, GABRIEL D W. A secreted ‘Liberibacter asiaticus’ peroxiredoxin simultaneously suppresses both localized and systemic innate immune responses.Molecular Plant-Microbe Interactions, 2018, 31(12): 1312-1322.
[31] PANDEY S S, WANG N. Targeted early detection of citrus Huanglongbing causal agent ‘Liberibacter asiaticus’ before symptom expression. Phytopathology, 2019, 109(6): 952-959.
[32] PAUL M J, FOYER C H. Sink regulation of photosynthesis. Journal of experimental botany, 2001, 52(360): 1383-1400.
[33] 刘登全, 崔朝宇, 蒋军喜, 龙珑. 不同柑橘品种对黄龙病的抗性鉴定. 江西农业大学学报, 2014, 36(1): 97-101.
LIU D Q, CUI C Y, JIANG J X, LONG L. Resistance identification of difference citrus cultivars against Huanglongbing. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(1): 97-101. (in Chinese)
Proliferation of Two Types Prophage of ‘Liberibacter asiaticus’ inand their Pathogenicity
HUANG JiaQuan1, LI Li1, WU FengNian2, ZHENG Zheng1, DENG XiaoLing1
1College of Plant Protection, South China Agricultural University, Guangzhou 510642;2School of Life Sciences and Food Engineering, Hanshan Normal University, Chaozhou 521041, Guangdong
【】In China, citrus Huanglongbing is a destructive disease associated with ‘liberibacter asiaticus’ (Las), which currently threatening the sustainable development of citrus industry. Previous studies had identified three types of prophage sequences in the genome ofLas strains. Prophage group typing analysis revealed that the Type 2 prophage strains and Type 1+3 prophage strains dominated in Guangdong province. However, the difference in propagation capacity of these two strains ofLas in Asian citri psyllid () and pathogenicity of these two strains leading by insect transmission remains unknown.【】The objective of this study is to assess the difference in proliferation capacity between Type-2-Las and Type-1+3-Las inand the pathogenicity variations between them onBlanco cv. shatangju.【】The buds with different strains ofLas were grafted to healthy Shatangju. Fifty nymphal and fifty adultwere caged on the young shoots of infected shatangjuto acquire different strains ofLas for 6, 12, and 18 days, respectively. Real-time quantitative PCR (qPCR) was used to detect and analyze the difference in the acquisition rate and quantity of Type-2-Las and Type-1+3-Las between the nymphal stage and the adult stage of. Further, twenty adultinfected with Type-2-Las or Type-1+3-Las were placed on the young shoots of healthy shatangju to inoculate for two weeks, respectively. Thewere collected and detected by qPCR. The general information of infection rate and quantity ofLas was collected. Symptom development of shatangju and titers ofLas in leaves were monitored each month. Morphological change of leaves phloem and parenchyma cell was visualized by light microscopy 360 days after inoculation.【】There was no significant difference between acquisition rate and quantity of Type-2-Las and Type-1+3-Las detected inthat fed on the infected plant at the nymphal stage. In contrast to fed as nymphs, the acquisition rate and quantity of Type-2-Las were significantly higher than Type-1+3-Las whenfed on infected plant at the adult stage. The leaves presented more severe mottled symptom after inoculation with Type-2-Las at 120 d afterremoval. The immature leaves at young shoots had an obstacle on turning green, presenting leathery, small size, and yellowing which was infected with Type-2-Las. The symptoms on Type-1+3-Las infected plants were presented as typical mottled leaves and leathery. Anatomical analyses indicated that Type-2-Las caused more severe damage to phloem and accumulated more starch in parenchyma cell even if the titer of Type-1+3-Las was closed to Type-2-Las.【】Compared to Type-1+3-Las, Type-2-Las was more capable of invading and proliferating in adult, accompanied by a higher titer ofLas which indirectly proved the high contagious capacity of Type-2-Las. The young leaves infected with Type-2-Las presented symptoms of uniform yellowing, small size, while infected with Type-1+3-Las showed lightly mottled and leathery. Type-2-Las destroyed more phloem cells and caused severe starch accumulation, indicating that Type-2-Las had stronger pathogenicity to citrus than Type-1+3-Las.
citrus Huanglongbing; ‘Liberibacter asiaticus’ (Las); prophage;; pathogenicity

10.3864/j.issn.0578-1752.2022.04.008
2021-07-14;
2021-08-13
国家自然科学基金青年科学基金(31801742)、广东省重点研发计划(2019B020217003)
黄家权,E-mail:380794041@qq.com。通信作者邓晓玲,E-mail:xldeng@scau.edu.cn
(责任编辑 岳梅)
