木蝴蝶总黄酮提取工艺优选*
2022-04-20严绪华方振峰
严绪华 ,梅 凌 ,方振峰
(1. 湖北省武汉市中医医院综合药学部,湖北 武汉 430010; 2. 江汉大学医学院药学系,湖北 武汉 430056)
木蝴蝶为紫葳科木蝴蝶属植物木蝴蝶Oroxylum indicum(L.)Vent 的干燥成熟种子,其果实一般在秋、冬季采收[1],主要分布于我国福建、台湾、广东、广西、四川、贵州、云南等地[2]。其最早记载于《滇南本草》,原名千张纸,《本草纲目拾遗》中开始用木蝴蝶名,沿用至今[3]。木蝴蝶具有清肺利咽、疏肝和胃功效,常用于治疗肺热咳嗽、喉痹、音哑[4]、肝胃气痛等症[5],具有抗炎、止咳等作用的主要成分为黄酮类化合物[3,6]。目前,从木蝴蝶中分离得到白杨素、黄芩素、黄芩苷、木蝴蝶苷A、木蝴蝶苷B、槲皮素等60 多个黄酮化合物[6],其抗肿瘤作用较好[7-10]。目前,木蝴蝶总黄酮的提取方法有超声浸渍法、回流提取法等[11-15],但其方法学研究均不完整。木蝴蝶B 是中药木蝴蝶的特征性成分,2020 年版《中国药典(一部)》规定,以木蝴蝶B含量作为评价中药木蝴蝶质量的指标。为此,本研究中以木蝴蝶苷B 为对照品,筛选了提取木蝴蝶总黄酮的最优工艺,并进行了验证,为其提取工艺的开发提供参考。现报道如下。
1 仪器与试药
1.1 仪器
UV-1780 型双光束紫外-可见分光光度计(岛津仪器<苏州>有限公司);岛津AUX120型分析天平(岛津仪器有限公司,精度为0.01 mg);ME104E 型电子天平(梅特勒- 托利多仪器< 上海> 有限公司,精度为0.000 1 g);KM - 500DE 型超声波清洗器(昆山美美超声仪器有限公司,功率为500 W,频率为40 kHz);SHZ-D(Ⅲ)型循环水式真空泵(巩义市予华仪器有限公司);HH.S型电热恒温水浴锅(上海跃进医疗机械厂);FW-100型高速万能粉碎机(天津市华鑫仪器厂)。
1.2 试药
木蝴蝶苷B 标准品(上海源叶生物科技有限公司,批号为B20881,纯度不低于98%);95%乙醇、甲醇、硝酸铝[Al(NO3)3]、亚硝酸钠(NaNO2)均为分析纯,购于国药集团化学试剂有限公司;氢氧化钠(NaOH,分析纯,上海沃凯生物技术有限公司);水为实验室自制超纯水;木蝴蝶(批号为20190912),产地云南,购自亳州中药材市场,经江汉大学张涛教授鉴定为正品。
2 方法与结果
2.1 木蝴蝶苷B 含量测定
2.1.1 溶液制备
取木蝴蝶苷B 标准品2 mg,精密称定,置10 mL 容量瓶中,加甲醇适量,超声使溶解,用甲醇定容,即得质量浓度为0.203 0 mg/mL的木蝴蝶苷B对照品溶液。取木蝴蝶粉末3.0 g,精密称定,用75%乙醇溶液60 mL回流提取2 h,趁热抽滤,将滤液蒸干,用适量甲醇超声(功率为500 W,频率为40 kHz)使溶解,转移至100 mL 容量瓶中,用甲醇定容,摇匀,即得供试品溶液。精密量取对照品溶液、供试品溶液、蒸馏水各适量,分别置10 mL容量瓶中,加入5% NaNO2溶液0.4 mL,摇匀,静置6 min,再加入 10%Al(NO3)3溶液 0.4 mL,摇匀,静置6 min,加入4% NaOH 溶液4 mL,用甲醇定容,摇匀,静置15 min[16],即得对照品显色溶剂、供试品显色溶剂和空白显色溶剂。
2.1.2 方法学考察
线性关系考察:精密吸取木蝴蝶苷B 对照品溶液25,50,250,500,1 000,2 000 μL,分别置10 mL 容量瓶中,分别按2.1.1 项下方法制备显色溶剂,得系列质量浓度的标准品溶液。以空白显色溶剂为空白溶液,分别在387 nm 波长处测定紫外吸光度,以对照品溶液质量浓度(C,μg/mL)为横坐标、吸光度(A)为纵坐标进行线性回归,得回归方程A=0.012 8C+0.000 4,r=0.999 6(n= 6)。结果表明,木蝴蝶苷B 质量浓度在0.50~40.00 μg/mL范围内与吸光度线性关系良好。
检测限和定量限确定:在387 nm 波长处连续测定空白显色溶剂6次,记录吸光度,得平均吸光度值,即噪音。取对照品溶液按2.1.1 项下方法制备显色溶剂,稀释成不同质量浓度进行吸光度测定,扣除空白,以3倍信噪比的质量浓度为检测限,得到检测限为4.22 μg/L;以10 倍信噪比的质量浓度为定量限,得到定量限为13.11 μg/L。
日内精密度与日间精密度试验:精密吸取对照品溶液0.5 mL,置100 mL 容量瓶中,按2.1.1 项下方法制备显色溶剂,于387 nm 波长处测定6 次,记录吸光度;连续测定3 d,每天2 次,记录吸光度。结果木蝴蝶苷B吸光度的RSD分别为0.17%和0.29%(n= 6),表明仪器的日内和日间精密度均良好。
重复性试验:取同一批(批号为20190912)样品粉末3 g,精密称定,共6份,按2.1.1项下方法制备供试品溶液和显色溶剂,于387 nm 波长处测定吸光度。结果吸光度的RSD为0.52%(n=6),表明方法重复性良好。
稳定性试验:精密吸取重复性试验项下供试品溶液0.25 mL,置50 mL 容量瓶中,按2.1.1 项下方法制备显色溶剂,分别于0,1,6,24,36,48 h 时在387 nm 波长处测定吸光度。结果吸光度的RSD为0.79%(n=6),表明供试品溶液在48 h内稳定性良好。
加样回收试验:取样品粉末3 g,共9 份,精密称定,分别按样品含量的80%,100%,120%加入标准品,按2.1.1项下方法制备供试品溶液和显色溶剂,于387 nm波长处测定吸光度,并计算加样回收率。结果见表1。

表1 木蝴蝶苷B加样回收试验结果(n=9)Tab.1 Results of recovery test of Oroxin B(n=9)
2.2 木蝴蝶总黄酮提取工艺优选
2.2.1 提取方法
回流提取法:取木蝴蝶粉末3.0 g,精密称定,置100 mL 圆底烧瓶中,加入75%乙醇溶液60 mL,连接冷凝回流装置,80 ℃回流提取2 h,抽滤,将滤液蒸干,用甲醇少量、多次润洗,转移溶液,置50 mL 容量瓶中,用甲醇定容,摇匀,部分过滤,取续滤液0.05 mL,置10 mL容量瓶中,按2.1.1 项下方法制备显色溶剂,于387 nm波长处测定吸光度3次。结果木蝴蝶总黄酮的平均含量为2.14 mg/g,RSD为0.27%(n=3)。
超声提取法:取木蝴蝶药材3.0 g,精密称定,置100 mL 圆底烧瓶中,加入75%乙醇溶液60 mL,于40 ℃超声(功率为500 W,频率为40 kHz)萃取30 min,抽滤,将滤液蒸干,用甲醇少量、多次润洗,转移溶液,置50 mL容量瓶中,用甲醇定容,摇匀,部分过滤,取续滤液0.05 mL,置10 mL 容量瓶中,按2.1.1 项下方法制备显色溶剂,于387 nm 波长处测定吸光度3 次。结果木蝴蝶总黄酮的平均含量为1.73 mg/g,RSD为0.58%(n=3)。
煎煮法:取木蝴蝶粉末3.0 g,精密称定,置100 mL烧杯中,加入蒸馏水60 mL,煮沸30 min,抽滤,将滤液蒸干,用甲醇少量、多次润洗,转移溶液,置50 mL 容量瓶中,用甲醇定容,摇匀,部分过滤,取续滤液0.05 mL,置10 mL 容量瓶中,按2.1.1 项下方法制备显色溶剂,于387 nm 波长处测定吸光度3 次。结果木蝴蝶总黄酮的平均含量为0.73 mg/g,RSD为0.22%(n=3)。
单因素ANOVO 方差分析结果:采用SPSS 22.0 统计学软件对3 种提取方法所得总黄酮含量进行单因素ANOVO 方差分析,结果见表2。不同方法测得的总黄酮含量的数值均满足方差齐性的前提条件(P=0.243 >0.05)。结果表明,不同提取方法得到的总黄酮含量差异显著。故木蝴蝶总黄酮最优提取方法选择回流提取法。

表2 提取方法影响总黄酮含量的单因素方差分析结果Tab.2 Results of single-factor ANOVA of extraction methods affecting the content of total flavonoids
2.2.2 提取溶剂种类
取木蝴蝶粉末3.0 g,共3份,精密称定,分别置100 mL圆底烧瓶中,分别加入60 mL 蒸馏水、乙醇、甲醇,按2.1.1项下方法制备供试品溶液和显色溶剂,以387 nm波长处测定吸光度,计算木蝴蝶总黄酮的含量。结果见图1。在测得的总黄酮含量的数值满足方差齐性的前提条件(P= 0.464 >0.05)下,进行提取溶剂影响木蝴蝶总黄酮含量的单因素ANOVA 统计分析,结果见表3。结果表明,不同提取溶剂对总黄酮含量的影响显著。由图1可知,总黄酮含量最高时所用溶剂为乙醇,故以乙醇作为木蝴蝶总黄酮的提取溶剂。

表3 提取溶剂影响木蝴蝶总黄酮含量的单因素方差分析结果Tab.3 Results of single-factor ANOVA of extraction solvent affecting the content of total flavonoids in Oroxyli Semen

图1 提取溶剂种类考察Fig.1 Investigation results of the types of extraction solvent
2.2.3 提取溶剂体积分数
取木蝴蝶粉末3.0 g,共5份,精密称定,分别置100 mL圆底烧瓶中,分别加入60 mL 20%,40%,60%,75%,95%乙醇,按2.1.1项下方法制备供试品溶液和显色溶剂,于387 nm 波长处测定吸光度,计算木蝴蝶的总黄酮含量。结果见图2。同时,在测得总黄酮含量的数值满足方差齐性的前提条件(P= 0.893 >0.05)下,进行乙醇体积分数影响木蝴蝶总黄酮含量的单因素ANOVA 分析和两两间多重比较LSD检验。结果见表4和表5。结果表明,乙醇体积分数对总黄酮含量的影响显著,且各浓度下所得总黄酮含量差异显著(P< 0.001)。由图2 可知,总黄酮含量在75%乙醇体积分数时最大,故75%为木蝴蝶总黄酮的最佳提取溶剂体积分数。

表4 乙醇体积分数影响木蝴蝶总黄酮含量的单因素方差分析结果Tab.4 Results of single-factor ANOVA of the ethanol volume fraction affecting the content of total flavonoids in Oroxyli Semen

表5 不同乙醇体积分数组间多重比较LSD检验结果Tab.5 Results of the LSD test for multiple comparisons among groups with different ethanol volume fraction

图2 提取溶剂浓度考察Fig.2 Investigation results of extraction solvent concentration
2.2.4 提取温度
取木蝴蝶粉末3.0 g,共6份,精密称定,分别置100 mL圆底烧瓶中,分别加入75%乙醇60 mL,分别于40,50,60,70,80,90 ℃下回流,按2.1.1 项下方法制备供试品溶液和显色溶剂,于387 nm 波长处测定吸光度,计算木蝴蝶总黄酮的含量。结果见图3。同时,在测得的总黄酮含量的数值满足方差齐性的前提条件(P=0.549 >0.05)下,进行提取温度影响木蝴蝶总黄酮含量的单因素ANOVA 分析和两两间多重比较LSD 检验。结果见表6和表7。可知,随着温度不断升高,黄酮的含量呈现先升高后下降最后又升高的趋势,在60 ℃时达到最高值;不同提取温度对总黄酮含量的影响非常显著;60 ℃与50 ℃时所得总黄酮含量差异显著(P< 0.05),60 ℃与70 ℃时所得总黄酮含量差异极显著(P< 0.001)。故选择60 ℃为木蝴蝶总黄酮的最佳提取温度。

图3 提取温度考察Fig.3 Investigation results of extraction temperatures

表6 提取温度影响木蝴蝶总黄酮含量的单因素方差分析结果Tab.6 Results of single factor ANOVA of the extraction temperatures affecting the content of total flavonoids in Oroxyli Semen

表7 不同提取温度组间多重比较LSD检验结果Tab.7 Results of the LSD test for multiple comparisons among groups with different extraction temperatures
2.2.5 提取时间
取木蝴蝶粉末3.0 g,共5 份,精密称定,分别置于100 mL 圆底烧瓶中,分别回流提取0.5,1.0,1.5,2.0,3.0 h,按2.1.1 项下方法制备供试品溶液和显色溶剂,于387 nm 波长处测定吸光度,计算木蝴蝶总黄酮的含量。结果见图4。同时,在测得总黄酮含量的数值满足方差齐性的前提条件(P= 0.096 >0.05)下,进行提取时间影响木蝴蝶总黄酮含量的单因素ANOVA 分析和两两间多重比较LSD 检验。结果见表8 和表9。可知,总黄酮含量在提取3 h 达到最高,与提取1.5 h 时的含量相近;不同提取时间对总黄酮含量的影响非常显著;提取1.5 h 和3.0 h与其他提取时间所得总黄酮含量显著差异(P<0.001),而提取 1.5 h 和 3.0 h 所得总黄酮含量无显著差异(P= 0.147 >0.05)。考虑到工业化生产的能耗,故选择1.5 h 为木蝴蝶总黄酮的最佳提取时间。

表8 提取时间影响木蝴蝶总黄酮含量的单因素方差分析结果Tab.8 Results of single-factor ANOVA of the extraction time affecting the content of total flavonoids in Oroxyli Semen

表9 不同提取时间组间多重比较LSD检验结果Tab.9 Results of the LSD test for multiple comparisons among groups with different extraction time

图4 提取时间考察Fig.4 Investigation results of extraction time
2.2.6 料液比
取木蝴蝶粉末3.0 g,共5 份,精密称定,分别置合适的圆底烧瓶中,分别加入1∶10,1∶15,1∶20,1∶30,1∶40(m/V)的75%乙醇,按2.1.1项下方法制备供试品溶液和显色溶剂,于387 nm 波长处测定吸光度,计算木蝴蝶总黄酮的含量。结果见图5。同时,在测得总黄酮含量的数值满足方差齐性的前提条件(P=0.622 >0.05)下,进行了料液比影响木蝴蝶总黄酮含量的单因素ANOVA 分析和两两间多重比较LSD 检验。结果见表10和表11。可知,随着料液比的增大,木蝴蝶总黄酮的含量先增大后减小,料液比为1∶20(m/V)时,总黄酮含量最大;不同料液比对总黄酮含量的影响非常显著;料液比为1∶20(m/V)时和其他料液比所得总黄酮含量有极显著差异(P<0.001)。故选择1∶20(m/V)为木蝴蝶总黄酮提取的最佳料液比。

表10 液料比影响木蝴蝶总黄酮含量的单因素方差分析结果Tab.10 Results of single-factor ANOVA of the solid / liquid ratios affecting the content of total flavonoids in Oroxyli Semen
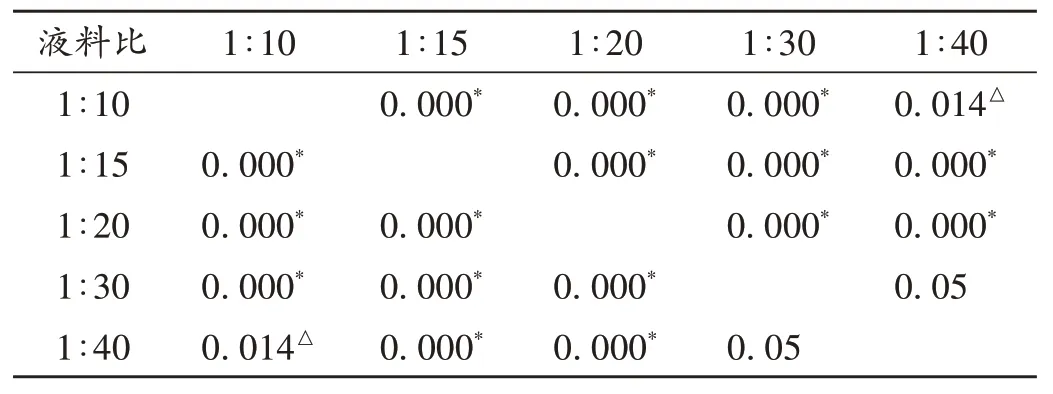
表11 不同料液比组间多重比较LSD检验结果Tab.11 Results of the LSD test for multiple comparisons among groups with different solid / liquid ratios

图5 料液比考察Fig.5 Investigation results of solid / liquid ratios
2.3 验证试验
取木蝴蝶粉末3.0 g,共3份,精密称定,以2.2项下优选的提取工艺条件,按2.1.1项下方法制备供试品溶液和显色溶剂,于387 nm 波长处测定吸光度,并计算木蝴蝶总黄酮的含量。结果木蝴蝶总黄酮含量的平均值为2.23 mg/ g,RSD为1.49%(n= 3),表明优选的提取工艺合理。
3 讨论
提取方法选择:木蝴蝶总黄酮包括苷及其苷元,苷元在水中的溶解度差,在乙醇中的溶解度好,而黄酮苷在水中和乙醇中溶解度均较好。煎煮法虽然遵循古法,但由于水中黄酮苷元的溶解性较差,故煎煮法所得总黄酮的含量最低。超声提取法是利用超声波的空化效应和震荡力[17],破坏植物细胞壁,使溶剂充分深入到细胞中,从而达到较好的提取效果,操作简单,提取时间短[18-19],但提取率偏低。回流提取法虽然耗时,操作相对烦琐,但提取率高。
溶剂种类选择:甲醇和乙醇,能溶解大部分化合物,但甲醇的价格通常比乙醇贵,乙醇还具有一定增溶作用。因此,在大部分试验中,尤其是工业化生产,优先选择乙醇作溶剂。本研究中采用甲醇、乙醇和水3 种不同溶剂进行提取,结果以乙醇为溶剂时,木蝴蝶中总黄酮的含量最高,故优先选用乙醇为溶剂。
溶剂体积分数选择:黄酮类化合物中通常存在多个酚羟基或糖,总黄酮的极性也会相应变大,要使总黄酮溶出,用极性稍大的溶剂效果会更好。由单因素试验结果可知,当乙醇体积分数小、极性很大时,总黄酮含量较低;当乙醇体积分数为75%时,木蝴蝶中总黄酮溶出最多,含量最高;当乙醇体积分数增大到95%时,溶剂极性变小,木蝴蝶中极性小的物质更易溶出,总黄酮含量相应变小。
提取温度选择:单因素试验中,随着温度的升高,提取所得总黄酮含量先升高,在60 ℃到达顶点后显著下降,在80 ℃时最低,之后又略有升高。分析原因,可能是因为低于60 ℃时,随着温度升高加快了黄酮类成分的扩散速度,有助于溶质扩散,超过60 ℃时黄酮中酚羟基在高温下易被氧化[20],导致总黄酮被破坏,含量明显下降。
提取时间选择:单因素试验中,提取0.5 h 时总黄酮含量较高,随后下降,然后升高,接着又下降、升高,呈波浪变化。分析原因,可能是在提取0.5 h 前,提取溶剂的黏度较低,质点传质效果好,扩散系数也较大[20],有利于总黄酮在乙醇中溶解度的增加,含量较高,之后黏度增大,溶出变慢,含量下降,随着黄酮苷类成分的大量溶出和苷元类部分溶出,总黄酮含量也随之增加,在提取1.5 h 时达到峰值,之后色素和杂质的溶出量增加,总黄酮含量降低,但随着时间的延长,黄酮类成分溶解更多,含量逐渐增加。
料液比选择:单因素试验中,随着提取溶剂体积的增大,提取所得总黄酮的含量先升高,后降低。分析其原因,可能是由于随着溶剂体积的不断增加,木蝴蝶粉末与溶剂的接触面积会不断增大,使木蝴蝶中总黄酮成分更易溶出[21]。当料液比为1∶20(m/V)时,木蝴蝶中黄酮类成分基本溶出,继续增加溶剂体积,不会明显增加总黄酮的溶出量,相反会使色素和杂质的溶出量增加,降低总黄酮含量。
综上所述,所建立的方法操作简单,结果可靠,数据准确,可为木蝴蝶中黄酮类化合物的进一步开发和利用提供参考。
