老年复发上颌窦原始神经外胚层肿瘤病例报告与文献复习
2022-04-18殷霞
殷霞
(解放军联勤保障部队第九二一医院血液肿瘤科,湖南 长沙 410000)
原始神经外胚层肿瘤(primitive neuroectodermal tumors,PNET)是一种来源于不同细胞分化神经外胚层高度恶性的小圆细胞肿瘤,多发生在中枢神经系统,但除中枢神经系统外,鼻窦、头骨、咬肌等也有发生,在PNET诊断中,免疫组化检测是区别小圆细胞肿瘤的重要工具,如横纹肌肉瘤、神经瘤、淋巴瘤和尤文肉瘤等,该病具有高度恶性,疾病发展过程中具有局部浸润和远处转移的特点,其预后差,治疗包括外科手术和术后放化疗,但疗效差[1]。现报道1例原发于上颌窦的PNET/ES病例,通过回顾临床病历,包括人口(年龄、性别)、临床(体征和症状,鼻窦及口咽部位复发、转移、随访)、组织病理学、影像学和治疗等资料,总结诊断治疗进展。
1 病例资料
患者,男,66岁,病史19年。患者于2001年3月无意间发现右侧眶下肿块,伴牙痛,患者至当地医院就诊,诊断为“牙源性上颌窦炎”,予以拔牙,之后右侧面部肿胀;3月15日行颌面部CT示:右侧上颌窦窦腔内软组织肿块灶,以上颌窦癌可能性大(见图1A)。3月17日至中南大学湘雅一医院就诊,生化检测显示肿瘤标志物水平无明显升高,行病理活检确诊为“上颌窦恶性肿瘤”,3月29日于全麻下行“右上颌骨扩大全切术+气管切开术+右颈外动脉结扎术”,术后病理:右上颌窦小圆细胞性恶性肿瘤,考虑为原始神经外胚叶肿瘤,侵犯骨组织及软组织;4月7日至5月8日予以6MVX放疗DT60 Gy/30次,右眼电子线补量10 Gy/5次,治疗后未定期复查及继续治疗。2015年6月无明显诱因,自觉双侧鼻腔内有异物感,症状持续未有缓解。2019年4月自觉双侧鼻腔异物感明显加重且反复出血,于6月28日至中南大学湘雅一医院复查,行颌面部MRI检查提示:鼻腔及双侧筛窦团块状软组织肿块并侵犯周围组织,考虑复发(见图1B)。患者本人拒绝手术,于2019年7月9日至联勤保障部队第921医院治疗,入院后鼻内镜检查提示双侧鼻腔可见新生物(见图3A),并取鼻腔肿块活检,病理结果显示,小圆细胞性恶性肿瘤(图2A~B)。中南大学湘雅一医院进一步完善免疫组化:(右鼻腔)小圆细胞恶性肿瘤,结合免疫组化检查倾向PNET/尤文肉瘤;免疫组化结果:CD99(+),CgA(-),CK-Pan(-),CD34(-),CD56(+),Syn(+),S-100(+),Ki67(+,40%),HMB45(-),Myogenin(-),SMA(-),CD31(-)(见图2C~D)。根据病理结果,诊断为小圆细胞恶性肿瘤。复发肿瘤进行再程姑息放疗,7月11日CT(见图1C)定位并在三维放射治疗计划系统下勾画靶区,制定放疗计划;采用直线加速器6MV-X线常规分割放射治疗2 Gy/次,每周执行5次,放疗剂量DT50 Gy/25次;8月14日CT重新定位,发现肿块明显消退(见图1D),予以放疗缩野后局部推量DT10 Gy/5次,局部姑息放疗总量为60 Gy。放疗后鼻腔及口腔肿块消退,鼻腔通气。定期随访,第1个月颌面部MRI(见图1E)、第3个月的颌面部磁共振(见图1F)显示肿块明显消退;随访第1个月(见图3B)及第3个月(见图3C)鼻咽内镜提示鼻腔及鼻咽部可见较多痂皮,未见明显新生物。
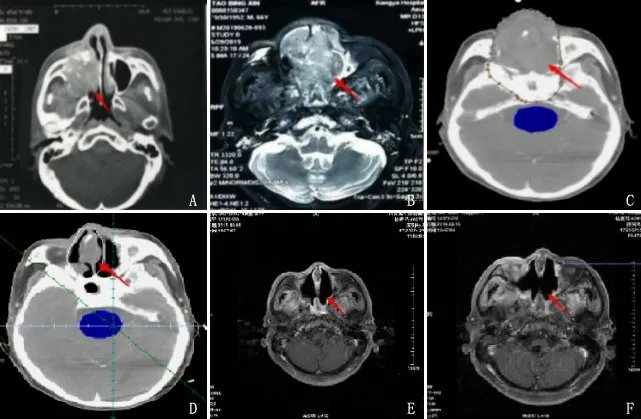
图1 颌面部CT

图2 小圆细胞性恶性肿瘤镜下特征(HE染色×20)

图3 鼻咽镜检查
2 讨论
2.1 诊断PNET 按其神经外胚层肿瘤起源细分为3大类:①中枢PNET(center primitive neuroectodermal tumor,cPNET),包括起源于中枢神经系统的肿瘤,如作为髓母细胞瘤;②神经母细胞瘤,包括肿瘤产生于自主神经系统;③周围PNET(perifer primitive nevroekodermal tumor,pPNET),起源于中枢神经系统之外[2]。本研究进一步收索国内外文献总结PNETs诊断依据如下。
2.1.1 病理 近年来,世界卫生组织定义pPNET也被归为Ewing肿瘤家族(ewing family tumors,EFT)中的一部分,因为pPNET和非典型Ewing’s肉瘤二者免疫组织化学、细胞遗传学及分子遗传学存在相似之处。目前pPNET的诊断主要通过组织学、免疫组织化学和分子遗传学分析。首先pPNET病理组织学体现在小圆细胞肿瘤,光镜下多呈现Homer-Wright菊形团结构,而Schmidt和Herrmann共同提出pPNET的病理诊断标准:光镜下具有Homer-Wright菊形团结构或免疫组化至少两项神经分化标记(Vim、NSE、CgA、NF、S-100)阳性[3]。pPNET免疫组化的诊断,国内李瑞健等[4]指出,免疫组织化学中CD99对pPNET的阳性率为90%~100%[4]。封冰等[5]研究指出,80例患者中CD99(+~+++)72例,突触素(Syn+~++)49例,波形纤维蛋白(Vimentin+~+++)26例。Anirban等[6]总结4例头颈部pPNET病例中,免疫组化显示MIC-2、vimentin、NSE均为阳性,其研究还进一步发现,pPNET存在不同程度的神经分化,神经分化标记物(Vim、NSE、Syn、CgA、NF、S-100)阳性率为18%~95%,以NSE阳性率最高,但均缺乏特异性,且广泛的神经分化是否预示较差的预后尚无定论,目前多数文献持否定看法,因而需进一步分析各神经标记物的预后意义。Justin等[7]研究指出,鼻腔小圆蓝细胞瘤的Ewing/pPNET,不仅表现出特殊的弥漫性细胞角蛋白,也出现常规pPNET的染色和膜CD99标记特征。pPNET的分子遗传学分析诊断中,多认为t(11,21)(q24;q12)处的染色体易位对诊断EW/pPNET家族肿瘤具有重要意义,且易位将导致一个融合基因,导致FLI1或ERG的脱氧核糖核酸结合区被富含谷氨酰胺的EWS基因所代替。Sara等[8]14例EFT/PNET免疫组化研究显示,CD99呈弥漫性阳性(100%),波形蛋白呈弥漫性阳性(86%),且应用FISH或RTPCR技术检测8例EWSR1异常,也体现出了EWSR1在分子遗传学分析诊断的价值。
2.1.2 影像 Hou等[3]研究指出,年轻患者出现巨大、性质不确定且具有侵袭性的肿块,CT或MRI影像呈现出一种密度不均匀或信号强度不等,病灶内通常无钙化,即使有也常为细小的、针尖样钙化,局部缺乏淋巴结病变,通常提示PNET的诊断。国内封冰等[5]研究也指出,CT和MRI多表现为体积较大的局部肿块,边界不清,邻近组织受压推移。原发于骨组织者多表现为溶骨性破坏伴骨外低密度软组织肿块影。CT可见瘤体内密度不均,可呈轻至中度强化。MRI T1WI表现为等信号,其内可见低信号坏死区,T2WI表现为不均匀高信号,花环或蜂窝状强化。Anirban等[6]研究也指出,PNET在头颈区域,临床表现取决于受累部位,但由于肿块效应,通常包括周围结构的疼痛和肿胀,发烧也很常见。其他报道的体征和症状有颅神经病、眼球突出、鼻出血、鼻塞、嗅觉丧失、颈部肿块、头痛等。在本病例中,以鼻出血、面部疼痛、鼻塞为主诉。一旦发现肿瘤,需进行影像学评估,以了解病变的特征和程度。CT扫描显示有或无骨侵蚀的异质强化软组织肿块,偶见瘤内钙化。MRI在T1加权像上显示为等强度肿块,在T2加权像上显示为高强度肿块。David等[9]指出,典型的尤文氏肉瘤,通常累及长骨,放射学表现为“洋葱剥皮”骨膜反应;虽然这也被描述为神经外胚层肿瘤病变的特征,但这一特征在面部骨骼中不太常见。溶骨性病变不是ESFTs的一种病理影像学特征,因其他疾病,如骨肉瘤、神经母细胞瘤、淋巴肉瘤、骨髓炎和转移癌也可表现出类似的图像模式。在颅骨中,这些肿瘤表现为渗透性的、破坏性的病变,伴有大的相关软组织成分,无钙化,反映肿瘤的侵袭性。放射学特征包括“虫蛀的”渗透性骨质破坏、丰富的骨膜反应(洋葱皮、日射、有刺、末端有毛发)、皮质侵蚀和相关软组织肿块的存在。尤文氏肉瘤的PNS CT显示,弥漫性增强的软组织肿块伴骨质破坏,通常未见钙化。然而,在其他PNS肿瘤(鳞状细胞癌、感觉神经母细胞瘤、淋巴瘤等)中也可看到类似的变化。尤文氏肉瘤的MRI典型表现为T1W1呈低信号至等信号,T2W1呈低信号至高信号。本例病例基本符合上述描述特点。另外Chiaki等[10]研究结果表明,由于18F-FDG PET/CT对EW/pPNET的骨髓受累的特异性为100%,因此,在18F-FDG PET/CT检查后确认无转移的情况下,可免除骨髓穿刺和活检检查,18F-FDG PET/CT是ES/PNET患者骨髓受累诊断应用中的最佳初始检查。
2.2 治疗 由于pPNET发病率低,目前尚无标准治疗方案,局限期患者以手术为主,配合放化疗,但在临床治疗中,化疗用药、周期数及放疗剂量等问题仍需进一步积累经验。
国外CESS 81、CESS 86和EICESS 92试验分析指出,术后放疗失败率明显低于术前。而CESS和EICESS试验研究指出,病灶内切除术后放射治疗与直接接受放射治疗的患者有相同的局部控制率,无明显差异,因此,明显否定了局部手术的益处。说明单纯的手术目的在于缩小肿瘤,但不能根治性完全切除时,与单纯放射治疗疗效并无差别[9]。当放射治疗运用于上颌窦和上颌骨的Ewing/pPNET,需注意高辐射剂量所诱发的第二肿瘤发生,尤其是当局部剂量>40 Gy时。IESS-Ⅰ和IESS-Ⅱ试验的数据可显示两组均联合用放射治疗控制局部复发。而化疗一般采取多周期联合化疗,有效药物包括异环磷酰胺、阿霉素、表阿霉素、长春新碱、依托泊苷、环磷酰胺及放线菌素-D等[9]。而对于晚期pPNET患者的巩固治疗多推荐大剂量化疗联合自体外周血造血干细胞移植,待病情缓解后可考虑再次手术。Sara等[8]研究指出,尤文肉瘤发于鼻腔,由于复杂的解剖结构,完全切除手术难度较大,且大多数鼻腔尤文肉瘤相较于典型的四肢骨和软组织尤文肿瘤,疾病进展似乎没有过于激进,从本例患者可以看出,手术治疗后联合局部放射治疗,术后生存时间长达19年,生存时间较长[8]。Rosa等[11]研究指出,13例接受手术的上颌窦肉瘤患者中,有92%的患者接受了术后辅助放疗,69%的患者接受了完全切除(R0)且无一复发。在31%的R1病例随访中,仅2例复发,其更指出上颌窦肉瘤最重要的预后因素是肿瘤分级和临床分期,同时,也是最好的生存预测因子,且最初接受手术治疗的患者比接受其他治疗的患者存活率更高[10]。James[12]首次提出了尤文肉瘤的放射敏感性。过去认为放疗优于手术,局部控制率(50%~70%)可接受,而长期预后差,很大程度上因缺乏有效化疗、出现远处转移。而本病例患者术后19年才出现复发,复发病灶肿瘤放射治疗敏感,局部适形放疗总剂量达50 Gy,肿瘤明显缩小,放疗后1月及3月复查鼻内镜及颌面部MRI均未见明显新生物[12]。David等[9]研究指出,新辅助化疗结合手术和/(或)放射治疗提高肿瘤控制率,可显著提高疗效,其研究结论指出早期患者手术比单纯放射治疗疗效更佳。
而分子靶向治疗是近年来肿瘤学领域的研究热点。通过基因组免疫沉淀及RNA干扰技术发现,EWS/FLI-1融合基因可在基因组水平广泛结合于DNA的不同位点,包括启动子区和基因内、基因间区域,产生对基因的抑制或诱导作用,最近研究的IGF-1通路和抑制多聚核糖聚合酶已经开始在临床中进行试验。在体外研究中,如蛋白质-蛋白之间的小分子抑制剂、RNA干扰技术、LSD1的抑制、HDAC、和DNA甲基转移酶等对抑制人尤文肉瘤细胞的增殖和生长效果确切。在临床试验的网页上有两个即将开展的靶向药物临床试验,一是由牛津大学主办关于患有复发和/或难治性尤文肉瘤的18~70岁患者的小样本Ⅱ期试验,另一个是儿童肿瘤学组主办的关于长春新碱-托泊替康-环磷酰胺在非转移尤因肉瘤标准化疗大样本Ⅲ期随机对照试验[13-14]。
3 小结
PNETs/Es的标准治疗方案为手术、放疗和化疗等综合治疗。手术治疗的重点是切除原发肿瘤,化疗是抑制肿瘤生长和转移的重要途径,放疗是以上两种治疗方式的补充治疗。然而,即使联合治疗有一定的疗效,可延长生存期,但恶性肿瘤的预后较差,大部分人不能耐受化疗的不良反应而终止治疗。患者在过去19年里保持良好的心态及规律的作息时间,增强自身免疫能力,从而达到抵抗肿瘤的作用。
